

植物学报 ›› 2024, Vol. 59 ›› Issue (3): 347-350.DOI: 10.11983/CBB24070 cstr: 32102.14.CBB24070
收稿日期:2024-05-06
接受日期:2024-05-13
出版日期:2024-05-10
发布日期:2024-05-10
通讯作者:
王佳伟, 中国科学院分子植物科学卓越创新中心研究员, 新基石研究员, 博士生导师。曾获腾讯科学探索奖、谈家桢生命科学创新奖、中国青年科技奖及国家杰出青年基金, 入选科技部中青年科技领军人才, 国家科技创新领军人才, 科睿唯安“高被引科学家”(2021-2023年)。主要从事植物发育生物学研究, 在植物年龄与再生领域开展系统性研究。以通讯作者身份在Cell、Science、Dev Cell、Nature Plants等国际主流期刊上发表研究论文30余篇。目前其研究团队以一年生草本植物拟南芥和十字花科多年生草本植物为模式, 利用遗传学、反向遗传学和多组学技术, 解析植物年龄不可逆的分子机理、植物生活史策略的演化、多年生植物干细胞长久维持及植物再生的分子机制。E-mail: 基金资助:
Ren-Yu Liao1,2,3, Jia-Wei Wang1,2,3,*( )
)
Received:2024-05-06
Accepted:2024-05-13
Online:2024-05-10
Published:2024-05-10
Contact:
E-mail: 摘要: 多细胞生物常因暴露在各种生物和非生物胁迫下而导致器官损伤或缺失。植物因固着性而演化出强大的再生能力以适应环境。尽管细胞损伤是植物组织修复和器官再生的原初物理诱因, 然而引发再生反应局部伤口信号的化学本质及其调控再生机制一直是科学界的难解之谜。最近一项研究发现1个调控植物局部伤口响应与再生能力的小肽REF1。研究表明, REF1与其受体PORK1通过植物损伤响应及细胞重编程关键转录因子WIND1促进植物再生。尤为重要的是, 外源施加REF1小肽可不同程度地提高几种作物的再生效率。这一发现不仅为理解植物损伤响应和再生的分子机制打开了全新视角, 而且为提高作物的再生能力和遗传转化效率提供了潜在的应用策略。
廖人玉, 王佳伟. 从损伤到重生——REF1小肽如何激发植物的内在再生潜能. 植物学报, 2024, 59(3): 347-350.
Ren-Yu Liao, Jia-Wei Wang. From Wound to Rebirth: How does REF1 Peptide Activate Intrinsic Regenerative Potential of Plants?. Chinese Bulletin of Botany, 2024, 59(3): 347-350.
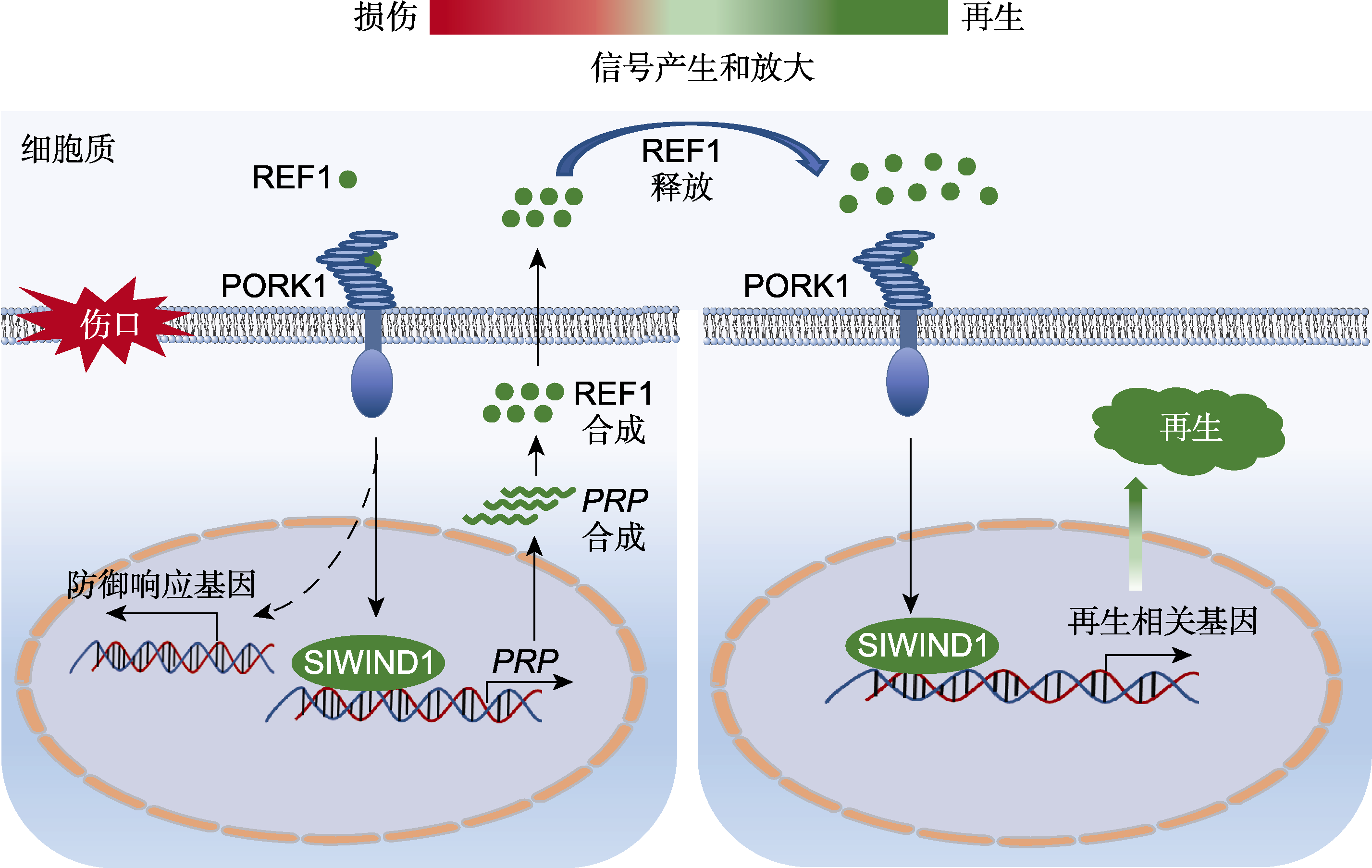
图1 番茄REF1-PORK1-SIWIND1介导的损伤响应及再生正反馈环路 REF1 (绿色圆点)作为一个局部信号调节番茄组织修复和再生。损伤促进REF1产生, REF1通过与细胞表面受体PORK1结合, 启动SIWIND1调控的再生途径。除启动细胞重编程外, SIWIND1还可识别REF1前体基因PRP启动子上的VWRE基序, 以激活其表达, 从而放大REF1信号。
Figure 1 An REF1-PORK1-SIWIND1 directed positive feedback loop for wounding response and regeneration in tomato REF1 (green dots) is a local wounding signal that regulates tissue repair and regeneration in tomato. Injury triggers the production of REF1, which binds to PORK1 on the cell surface and subsequently initiates SlWIND1-regulated regeneration pathway. In addition to orchestrating the cellular reprogramming for regeneration, SlWIND1 can also bind the VWRE motif on the promoter of PRP to activate its expression, thereby amplifying the REF1 signaling for regeneration.
| [1] |
Birnbaum KD, Alvarado AS (2008). Slicing across kingdoms: regeneration in plants and animals. Cell 132, 697-710.
DOI PMID |
| [2] |
Davenport RJ (2005). What controls organ regeneration? Science 309, 84.
PMID |
| [3] | Iwase A, Harashima H, Ikeuchi M, Rymen B, Ohnuma M, Komaki S, Morohashi K, Kurata T, Nakata M, Ohme- Takagi M, Grotewold E, Sugimoto K (2017). WIND1 promotes shoot regeneration through transcriptional activation of ENHANCER OF SHOOT REGENERATION1 in Arabidopsis. Plant Cell 29, 54-69. |
| [4] | Iwase A, Mitsuda N, Koyama T, Hiratsu K, Kojima M, Arai T, Inoue Y, Seki M, Sakakibara H, Sugimoto K, Ohme- Takagi M (2011). The AP2/ERF transcription factor WIND1 controls cell dedifferentiation in Arabidopsis. Curr Biol 21, 508-514. |
| [5] | Kennedy D, Norman C (2005). What don’t we know? S- cience 309, 75. |
| [6] | Liao RY, Wang JW (2023). Analysis of meristems and plant regeneration at single-cell resolution. Curr Opin Plant Biol 74, 102378. |
| [7] | Mathew MM, Prasad K (2021). Model systems for regeneration: Arabidopsis. Development 148, dev195347. |
| [8] |
Pearce G, Strydom D, Johnson S, Ryan CA (1991). A polypeptide from tomato leaves induces wound-inducible proteinase inhibitor proteins. Science 253, 895-897.
DOI PMID |
| [9] |
Pulianmackal AJ, Kareem AVK, Durgaprasad K, Trivedi ZB, Prasad K (2014). Competence and regulatory inte- ractions during regeneration in plants. Front Plant Sci 5, 142.
DOI PMID |
| [10] |
Sena G, Birnbaum KD (2010). Built to rebuild: in search of organizing principles in plant regeneration. Curr Opin Genet Dev 20, 460-465.
DOI PMID |
| [11] |
Sugimoto K, Gordon SP, Meyerowitz EM (2011). Regeneration in plants and animals: dedifferentiation, transdiffe- rentiation, or just differentiation? Trends Cell Biol 21, 212-218.
DOI PMID |
| [12] |
Sugimoto K, Temman H, Kadokura S, Matsunaga S (2019). To regenerate or not to regenerate: factors that drive plant regeneration. Curr Opin Plant Biol 47, 138-150.
DOI PMID |
| [13] | Yang WT, Zhai HW, Wu FM, Deng L, Chao Y, Meng XW, Chen Q, Liu CH, Bie XM, Sun CL, Yu Y, Zhang XF, Zhang XY, Chang ZQ, Xue M, Zhao YJ, Meng XB, Li BS, Zhang XS, Zhang DJ, Zhao XY, Gao CX, Li JY, Li CY (2024). eptide REF1 is a local wound signal promoting plant regeneration. Cell doi: 10.1016/j.cell.2024.04.040. |
| [14] | Zhang J, Li YX, Bao QX, Wang HB, Hou SG (2022). Plant elicitor peptide 1 fortifies root cell walls and triggers a systemic root-to-shoot immune signaling in Arabidopsis. Plant Signal Behav 17, 2034270. |
| [1] | 李晶晶, 李艳飞, 王安琪, 王佳颖, 邓成燕, 卢敏, 马剑英, 戴思兰. 菊花品种‘万代风光’再生及遗传转化体系的建立[J]. 植物学报, 2025, 60(4): 1-0. |
| [2] | 曹雪敏, 包颖, 张悦新, 李瑞杰, 苏健馨, 张蔚. 野蔷薇组培快繁和高效瞬时表达体系的建立[J]. 植物学报, 2025, 60(2): 235-245. |
| [3] | 樊蓓, 任敏, 王延峰, 党峰峰, 陈国梁, 程国亭, 杨金雨, 孙会茹. 番茄SlWRKY45转录因子在响应低温和干旱胁迫中的功能(长英文摘要)[J]. 植物学报, 2025, 60(2): 186-203. |
| [4] | 彭昀月, 罗永梅, 靳彤, 李佳颖, 陈玉峰. 减缓陆上集中式光伏及风电电场生态影响的早期选址规划方法与工具[J]. 生物多样性, 2025, 33(1): 24063-. |
| [5] | 刘玉泽, 王一菲, 任威蓁, 栗浩, 路斌, 路丙社, 于晓跃. 北美豆梨杂种幼胚挽救及再生体系的建立[J]. 植物学报, 2024, 59(5): 800-809. |
| [6] | 冯雯, 王玉国. 栽培薯蓣茎段离体再生体系的建立[J]. 植物学报, 2024, 59(5): 792-799. |
| [7] | 杨佳丽, 饶羽菲, 张润花, 周国林, 林处发, 何燕红, 宁国贵. 捕虫堇叶片高效再生体系建立[J]. 植物学报, 2024, 59(4): 626-634. |
| [8] | 赵来鹏, 王柏柯, 杨涛, 李宁, 杨海涛, 王娟, 闫会转. SlHVA22l基因调节番茄耐旱性[J]. 植物学报, 2024, 59(4): 558-573. |
| [9] | 曾浩, 李佩芳, 郭至辉, 刘春林, 阮颖. 银扇草再生体系的建立[J]. 植物学报, 2024, 59(3): 433-440. |
| [10] | 武晓云, 廖敏凌, 李雪茹, 舒梓淳, 辛佳潼, 张伯晗, 戴思兰. 毛华菊3种瓣型株系再生体系的建立[J]. 植物学报, 2024, 59(2): 245-256. |
| [11] | 谢纯刚, 刘哲, 章书声, 胡海涛. 手指柠檬茎段离体再生体系建立[J]. 植物学报, 2023, 58(6): 926-934. |
| [12] | 蔡淑钰, 刘建新, 王国夫, 吴丽元, 宋江平. 褪黑素促进镉胁迫下番茄种子萌发的调控机理[J]. 植物学报, 2023, 58(5): 720-732. |
| [13] | 刘小飞, 孙映波, 黄丽丽, 杨钰钗, 朱根发, 于波. 黑鹅绒海芋体细胞胚发生和植株再生[J]. 植物学报, 2023, 58(5): 750-759. |
| [14] | 廖敏凌, 蒲娅, 武晓云, 马朝峰, 王文奎, 戴思兰. 平潭野菊混合瓣型株系再生体系的建立[J]. 植物学报, 2023, 58(3): 449-460. |
| [15] | 任露露, 张有泽, 黄克林, 宛晓春, 张照亮, 朱木兰, 韦朝领. 茶树茎段不定芽高效发生体系的建立[J]. 植物学报, 2023, 58(2): 308-315. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||