

植物学报 ›› 2019, Vol. 54 ›› Issue (5): 634-641.DOI: 10.11983/CBB18193 cstr: 32102.14.CBB18193
收稿日期:2018-09-11
接受日期:2019-02-19
出版日期:2019-09-01
发布日期:2020-03-10
通讯作者:
冯莹
基金资助:
Ying Feng1,*( ),Lianwen Qian1,Qingliang Lin2
),Lianwen Qian1,Qingliang Lin2
Received:2018-09-11
Accepted:2019-02-19
Online:2019-09-01
Published:2020-03-10
Contact:
Ying Feng
摘要: 以青钱柳(Cyclocarya paliurus)叶片为研究材料, 采用单因素完全随机试验法比较不同激素(6-BA、GA3和NAA)浓度组合对叶片外植体褐化的影响; 在此基础上, 分别采用二因素、单因素完全随机试验法比较6-BA+NAA不同浓度组合、不同基本培养基对愈伤组织褐化的影响。结果表明, 改良MS+1.0 mg∙L -1 6-BA+1.0 mg∙L -1 GA3+0.3 mg∙L -1 NAA是抑制青钱柳叶片外植体褐化的最佳培养基, 其褐化率为0, 愈伤组织诱导率100%; 改良MS+0.5 mg∙L -1 6-BA+0.2 mg∙L -1 NAA是抑制愈伤组织褐化的最佳培养基, 其褐化率为0, 愈伤组织增殖倍数达4.80倍, 愈伤组织呈黄绿色或黄色, 颗粒状, 颗粒小而紧密、质硬且表面干燥。该方法有效解决了青钱柳叶片外植体和愈伤组织褐化问题, 为青钱柳组织培养褐化控制提供了一条简单高效的离体培养途径, 也为青钱柳叶片离体再生体系的建立奠定基础。
冯莹,钱莲文,林庆良. 不同激素对青钱柳外植体和愈伤组织褐化的影响. 植物学报, 2019, 54(5): 634-641.
Ying Feng,Lianwen Qian,Qingliang Lin. The Effect of Different Hormones on Explant Browning and Callus Browning in Cyclocarya paliurus. Chinese Bulletin of Botany, 2019, 54(5): 634-641.
| Treatment | 6-BA content (mg·L-1) | GA3 content (mg·L-1) | NAA content (mg·L-1) |
|---|---|---|---|
| 6-BA1 | 1.0 | 1.0 | 0.3 |
| 6-BA2 | 2.0 | 1.0 | 0.3 |
| 6-BA3 | 3.0 | 1.0 | 0.3 |
| GA31 | 1.0 | 0.0 | 0.3 |
| GA32 | 1.0 | 0.5 | 0.3 |
| GA33 | 1.0 | 1.0 | 0.3 |
| GA34 | 1.0 | 1.5 | 0.3 |
| NAA1 | 1.0 | 1.0 | 0.0 |
| NAA2 | 1.0 | 1.0 | 0.1 |
| NAA3 | 1.0 | 1.0 | 0.3 |
| NAA4 | 1.0 | 1.0 | 0.5 |
表1 6-BA+GA3+NAA激素浓度组合
Table 1 6-BA+GA3+NAA hormone combination
| Treatment | 6-BA content (mg·L-1) | GA3 content (mg·L-1) | NAA content (mg·L-1) |
|---|---|---|---|
| 6-BA1 | 1.0 | 1.0 | 0.3 |
| 6-BA2 | 2.0 | 1.0 | 0.3 |
| 6-BA3 | 3.0 | 1.0 | 0.3 |
| GA31 | 1.0 | 0.0 | 0.3 |
| GA32 | 1.0 | 0.5 | 0.3 |
| GA33 | 1.0 | 1.0 | 0.3 |
| GA34 | 1.0 | 1.5 | 0.3 |
| NAA1 | 1.0 | 1.0 | 0.0 |
| NAA2 | 1.0 | 1.0 | 0.1 |
| NAA3 | 1.0 | 1.0 | 0.3 |
| NAA4 | 1.0 | 1.0 | 0.5 |

图1 青钱柳叶片诱导出的愈伤组织类型 (A) I类型愈伤组织; (B) II类型愈伤组织; (C) III类型愈伤组织。Bars=1 cm
Figure 1 The type of callus induced from leaves of Cyclocarya paliurus (A) Callus of the type I; (B) Callus of the type II; (C) Callus of the type III. Bars=1 cm
| Medium | The rate of callus induction (%) | The rate of leaf browning (%) | Callus | |
|---|---|---|---|---|
| Type | Growth | |||
| 1.0 mg·L-1 6-BA+1.0 mg·L-1 GA3+0.3 mg·L-1 NAA | 100.00±0.00 a | 0.00±0.00 a | I, II | I (++), II (+) |
| 2.0 mg·L-1 6-BA+1.0 mg·L-1 GA3+0.3 mg·L-1 NAA | 95.24±8.25 a | 4.76±8.25 b | I, II | I (+++), II (++) |
| 3.0 mg·L-1 6-BA+1.0 mg·L-1 GA3+0.3 mg·L-1 NAA | 66.67±18.04 b | 33.33±18.04 b | I, III | I (++), III (+) |
表2 6-BA对青钱柳叶片外植体褐化的影响(平均值±标准差)
Table 2 The effect of 6-BA on leaf browning in Cyclocarya paliurus (means±SD)
| Medium | The rate of callus induction (%) | The rate of leaf browning (%) | Callus | |
|---|---|---|---|---|
| Type | Growth | |||
| 1.0 mg·L-1 6-BA+1.0 mg·L-1 GA3+0.3 mg·L-1 NAA | 100.00±0.00 a | 0.00±0.00 a | I, II | I (++), II (+) |
| 2.0 mg·L-1 6-BA+1.0 mg·L-1 GA3+0.3 mg·L-1 NAA | 95.24±8.25 a | 4.76±8.25 b | I, II | I (+++), II (++) |
| 3.0 mg·L-1 6-BA+1.0 mg·L-1 GA3+0.3 mg·L-1 NAA | 66.67±18.04 b | 33.33±18.04 b | I, III | I (++), III (+) |
| Medium | The rate of callus induction (%) | The rate of leaf browning (%) | Callus | |
|---|---|---|---|---|
| Type | Growth | |||
| 1.0 mg·L-1 6-BA+0.3 mg·L-1 NAA | 48.96±4.77 c | 51.04±4.77 a | I, III | I (++), III (+) |
| 0.5 mg·L-1 GA3+1.0 mg·L-1 6-BA+0.3 mg·L-1 NAA | 86.67±10.41 b | 13.33±10.41 b | I, II, III | I (++), II (+), III (-) |
| 1.0 mg·L-1 GA3+1.0 mg·L-1 6-BA+0.3 mg·L-1 NAA | 100.00±0.00 a | 0.00±0.00 c | I, II | I (++), II (+) |
| 1.5 mg·L-1 GA3+1.0 mg·L-1 6-BA+0.3 mg·L-1 NAA | 86.11±2.78 b | 13.89±2.78 b | I | I (++) |
表3 GA3对青钱柳叶片外植体褐化的影响(平均值±标准差)
Table 3 The effect of GA3 on leaf browning in Cyclocarya paliurus (means±SD)
| Medium | The rate of callus induction (%) | The rate of leaf browning (%) | Callus | |
|---|---|---|---|---|
| Type | Growth | |||
| 1.0 mg·L-1 6-BA+0.3 mg·L-1 NAA | 48.96±4.77 c | 51.04±4.77 a | I, III | I (++), III (+) |
| 0.5 mg·L-1 GA3+1.0 mg·L-1 6-BA+0.3 mg·L-1 NAA | 86.67±10.41 b | 13.33±10.41 b | I, II, III | I (++), II (+), III (-) |
| 1.0 mg·L-1 GA3+1.0 mg·L-1 6-BA+0.3 mg·L-1 NAA | 100.00±0.00 a | 0.00±0.00 c | I, II | I (++), II (+) |
| 1.5 mg·L-1 GA3+1.0 mg·L-1 6-BA+0.3 mg·L-1 NAA | 86.11±2.78 b | 13.89±2.78 b | I | I (++) |

图2 GA3对青钱柳叶片诱导愈伤组织的影响 (A) 在未添加GA3的诱导培养基中培养愈伤组织诱导效果; (B) 在添加GA3的诱导培养基中培养15天的愈伤组织; (C) 在添加GA3的诱导培养基中培养30天的愈伤组织。Bars=1 cm
Figure 2 The effect of GA3 on callus induction of leaves in Cyclocarya paliurus (A) Callus in the induction medium without GA3; (B) Callus cultured for 15 days in the induction medium with GA3; (C) Callus cultured for 30 days in the induction medium with GA3. Bars=1 cm
| Medium | The rate of callus induction (%) | The rate of leaf browning (%) | Callus | |
|---|---|---|---|---|
| Type | Growth | |||
| 1.0 mg·L-1 GA3+1.0 mg·L-1 6-BA | 23.15±11.25 c | 76.85±11.25 a | I | I (-) |
| 0.1 mg·L-1 NAA+1.0 mg·L-1 GA3+1.0 mg·L-1 6-BA | 71.39±7.01 b | 18.61±7.01 b | I, II | I (++), II (+) |
| 0.3 mg·L-1 NAA+1.0 mg·L-1 GA3+1.0 mg·L-1 6-BA | 100.00±0.00 a | 0.00±0.00 c | I, II | I (++), II (+) |
| 0.5 mg·L-1 NAA+1.0 mg·L-1 GA3+1.0 mg·L-1 6-BA | 96.99±0.20 a | 3.11±0.20 c | I, II | I (+), II (+) |
表4 NAA对青钱柳叶片外植体褐化的影响(平均值±标准差)
Table 4 The effect of NAA on leaf browning in Cyclocarya paliurus (means±SD)
| Medium | The rate of callus induction (%) | The rate of leaf browning (%) | Callus | |
|---|---|---|---|---|
| Type | Growth | |||
| 1.0 mg·L-1 GA3+1.0 mg·L-1 6-BA | 23.15±11.25 c | 76.85±11.25 a | I | I (-) |
| 0.1 mg·L-1 NAA+1.0 mg·L-1 GA3+1.0 mg·L-1 6-BA | 71.39±7.01 b | 18.61±7.01 b | I, II | I (++), II (+) |
| 0.3 mg·L-1 NAA+1.0 mg·L-1 GA3+1.0 mg·L-1 6-BA | 100.00±0.00 a | 0.00±0.00 c | I, II | I (++), II (+) |
| 0.5 mg·L-1 NAA+1.0 mg·L-1 GA3+1.0 mg·L-1 6-BA | 96.99±0.20 a | 3.11±0.20 c | I, II | I (+), II (+) |
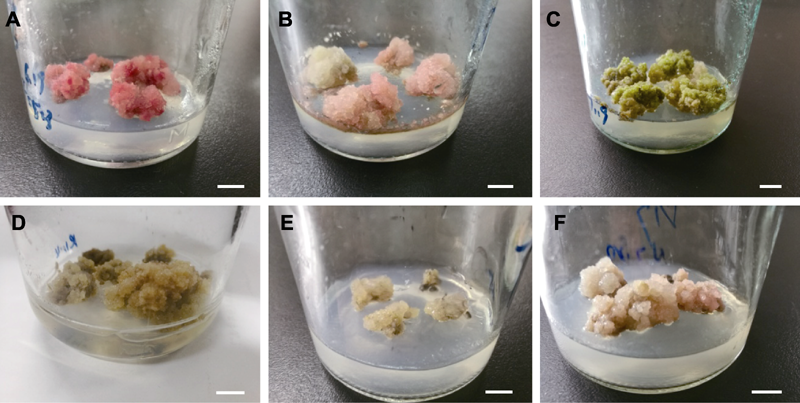
图3 青钱柳愈伤组织增殖类型 (A), (B) I类愈伤组织; (C), (D) II类愈伤组织; (E), (F) III类愈伤组织。Bars=1 cm
Figure 3 The type of callus propagation in Cyclocarya paliurus (A), (B) The callus of type I; (C), (D) The callus of type II; (E), (F) The callus of type III. Bars=1 cm
| Plant growth regulator (mg·L-1) | The time of callus propagation (time) | The rate of callus browning (%) | Callus | ||
|---|---|---|---|---|---|
| 6-BA | NAA | Type | Growth | ||
| 0.2 | 0.05 | 1.25 de | 0 e | II | II (+++) |
| 0.5 | 0.05 | 3.87 b | 0 e | I, II | I (+++), II (++) |
| 0.8 | 0.05 | 3.51 b | 0 e | I, II | I (++), II (+++) |
| 1.0 | 0.05 | 0.69 e | 0 e | I, III | I (++), III (+) |
| 0.2 | 0.2 | 0.75 e | 0 e | I, II, III | I (+), II (+), III (+) |
| 0.5 | 0.2 | 4.80 a | 0 e | I, II | I (++), II (+++) |
| 0.8 | 0.2 | 3.55 b | 0 e | I, II, III | I (++), II (+++), III (++++) |
| 1.0 | 0.2 | 1.30 de | 40.00 a | I, II | I (++), II (+) |
| 0.2 | 0.4 | 0.97 de | 33.33 ab | I, III | I (+), III (+) |
| 0.5 | 0.4 | 1.65 d | 28.33 bc | II, III | II (+), III (+) |
| 0.8 | 0.4 | 2.57 c | 20.00 d | II, III | II (++), III (+) |
| 1.0 | 0.4 | 1.75 d | 21.67 cd | II, III | II (+), III (+) |
表5 6-BA+NAA组合对青钱柳愈伤组织褐化的影响
Table 5 The effect of 6-BA+NAA on callus browning in Cyclocarya paliurus
| Plant growth regulator (mg·L-1) | The time of callus propagation (time) | The rate of callus browning (%) | Callus | ||
|---|---|---|---|---|---|
| 6-BA | NAA | Type | Growth | ||
| 0.2 | 0.05 | 1.25 de | 0 e | II | II (+++) |
| 0.5 | 0.05 | 3.87 b | 0 e | I, II | I (+++), II (++) |
| 0.8 | 0.05 | 3.51 b | 0 e | I, II | I (++), II (+++) |
| 1.0 | 0.05 | 0.69 e | 0 e | I, III | I (++), III (+) |
| 0.2 | 0.2 | 0.75 e | 0 e | I, II, III | I (+), II (+), III (+) |
| 0.5 | 0.2 | 4.80 a | 0 e | I, II | I (++), II (+++) |
| 0.8 | 0.2 | 3.55 b | 0 e | I, II, III | I (++), II (+++), III (++++) |
| 1.0 | 0.2 | 1.30 de | 40.00 a | I, II | I (++), II (+) |
| 0.2 | 0.4 | 0.97 de | 33.33 ab | I, III | I (+), III (+) |
| 0.5 | 0.4 | 1.65 d | 28.33 bc | II, III | II (+), III (+) |
| 0.8 | 0.4 | 2.57 c | 20.00 d | II, III | II (++), III (+) |
| 1.0 | 0.4 | 1.75 d | 21.67 cd | II, III | II (+), III (+) |
| Plant growth regulator | The time of callus propagation (time) | The rate of callus browning (%) |
|---|---|---|
| 0.2 mg·L-1 6-BA | 0.98±0.33 b | 11.11±17.64 b |
| 0.5 mg·L-1 6-BA | 3.44±1.47 a | 9.44±15.09 b |
| 0.8 mg·L-1 6-BA | 3.21±0.67 a | 6.67±10.00 b |
| 1.0 mg·L-1 6-BA | 1.25±0.55 b | 20.56±17.40 a |
| 0.05 mg·L-1 NAA | 2.33±1.49 a | 0.00±0.00 c |
| 0.2 mg·L-1 NAA | 2.59±1.75 a | 10.00±18.09 b |
| 0.4 mg·L-1 NAA | 1.73±0.74 b | 25.83±8.75 a |
表6 分别添加6-BA和NAA对青钱柳愈伤组织褐化的影响(平均值±标准差)
Table 6 The effect of 6-BA and NAA on callus browning in Cyclocarya paliurus, respectively (means±SD)
| Plant growth regulator | The time of callus propagation (time) | The rate of callus browning (%) |
|---|---|---|
| 0.2 mg·L-1 6-BA | 0.98±0.33 b | 11.11±17.64 b |
| 0.5 mg·L-1 6-BA | 3.44±1.47 a | 9.44±15.09 b |
| 0.8 mg·L-1 6-BA | 3.21±0.67 a | 6.67±10.00 b |
| 1.0 mg·L-1 6-BA | 1.25±0.55 b | 20.56±17.40 a |
| 0.05 mg·L-1 NAA | 2.33±1.49 a | 0.00±0.00 c |
| 0.2 mg·L-1 NAA | 2.59±1.75 a | 10.00±18.09 b |
| 0.4 mg·L-1 NAA | 1.73±0.74 b | 25.83±8.75 a |
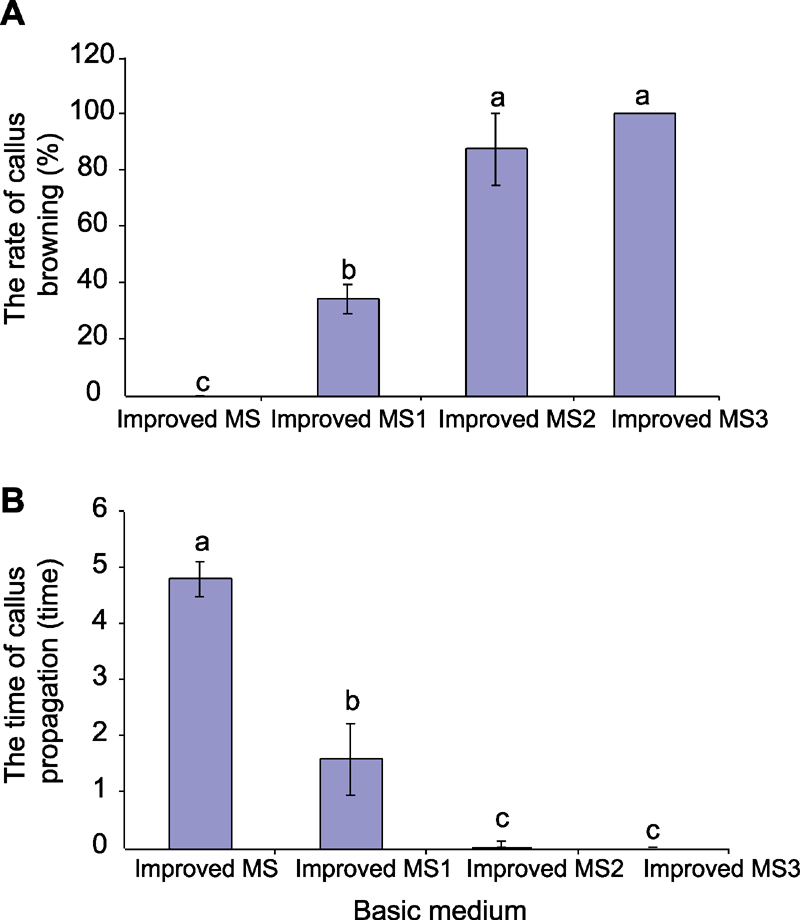
图4 基本培养基对青钱柳愈伤组织褐化 (A)和愈伤组织增殖(B)的影响(平均值±标准差) 不同小写字母表示差异显著(P<0.05)。
Figure 4 The effect of basic medium on callus browning (A) and callus propagation (B) in Cyclocarya paliurus (means±SD) Different lowercase letters indicate significant differences at P<0.05.

图5 青钱柳愈伤组织在不同基本培养基中的生长情况 (A) 改良MS基本培养基中愈伤组织生长情况; (B), (C) 改良MS1基本培养基中愈伤组织生长情况; (D), (E) 改良MS2基本培养基中愈伤组织生长情况; (F) 改良MS3基本培养基中愈伤组织生长情况。Bars=1 cm
Figure 5 Callus of Cyclocarya paliurus growth in the different basic medium (A) Callus growth in the improved MS basic medium; (B), (C) Callus growth in the improved MS1 basic medium; (D), (E) Callus growth in the improved MS2 basic medium; (F) Callus growth in the improved MS3 basic medium. Bars=1 cm
| 1 | 陈雪, 张金柱, 潘兵兵, 桑成瑾, 马雪, 杨涛, 车代弟 (2011). 月季愈伤组织的诱导及植株再生. 植物学报 46, 569-574. |
| 2 | 方升佐, 杨万霞 (2003). 青钱柳的开发利用与资源培育. 林业科技开发 17, 49-51. |
| 3 | 侯建华, 李正红, 马宏, 刘秀贤, 万友名 (2015). 地涌金莲组织培养中的褐化抑制. 林业科学研究 28, 217-221. |
| 4 | 郎玉涛, 罗晓芳 (2007). 牡丹愈伤组织的诱导及愈伤褐化抑制的研究. 河南林业科技 27, 4-6, 29. |
| 5 | 卢其能, 杨清 (2007). 激素等外源物质对马铃薯愈伤组织花色苷积累的影响. 西北植物学报 27, 2233-2239. |
| 6 | 鲁萌, 阮氏钏, 王纪, 方升佐 (2013). 青钱柳茎段腋芽的离体培养技术. 南京林业大学学报(自然科学版) 37(6), 6-10. |
| 7 | 任丽梅, 张洁, 赵立红, 王冬梅 (2008). 红叶石楠愈伤组织抗褐化研究以及悬浮细胞系的建立. 河北农业大学学报 31(5), 46-51. |
| 8 | 阮氏钏, 方升佐, 尚旭岚, 杨万霞 (2014). 青钱柳愈伤组织不定芽诱导技术. 南京林业大学学报(自然科学版) 38(2), 52-56. |
| 9 | 上官新晨, 郭春兰, 蒋艳, 沈勇根, 吴少福, 胡冬南 (2006). 培养基和植物激素对青钱柳茎段和叶片愈伤组织诱导的研究. 江西农业大学学报 28, 678-682. |
| 10 | 盛长忠, 王淑芳, 王宁宁, 王勇 (2001). 红豆杉愈伤组织培养中褐变现象的初探. 南开大学学报(自然科学版) 34(4), 120-122. |
| 11 | 舒任庚, 舒积成 (2007). 青钱柳中的酚类化学成分. 中草药 38, 507-508. |
| 12 | 唐利球, 唐君海, 陆祖正, 周婧 (2005). 金钱树愈伤组织的诱导及其褐化的防止. 广西热带农业 ( 3), 12-13. |
| 13 | 王纪, 谢寅峰, 方升佐 (2012). 青钱柳愈伤组织诱导与增殖的初步研究. 安徽农业科学 40, 1309-1312. |
| 14 | 吴群英, 徐庆, 李丽亚, 梁荣感, 龚受基 (2008). 青钱柳不同外植体组织培养及褐变防止的研究. 时珍国医国药 19, 1872-1874. |
| 15 | 肖莉杰, 王丽艳, 闵丽, 方淑梅, 韩毅强, 张红梅 (2011). 玉米成熟胚愈伤组织诱导及褐化控制研究. 玉米科学 19(4), 37-42. |
| 16 | 谢寅峰, 张志敏, 尚旭岚, 杨万霞, 王纪, 方升佐 (2011). 青钱柳茎段腋芽萌发和丛生芽增殖. 林业科学 47, 50-55. |
| 17 | 谢寅峰, 张志敏, 张颖颖, 李颖, 尚旭岚, 方升佐 (2015). 3种抗氧化剂对青钱柳愈伤组织褐化的影响. 安徽农业大学学报 42, 493-498. |
| 18 | 谢寅峰, 张志敏, 张颖颖, 孙朦, 尚旭岚, 方升佐 (2012). 青钱柳愈伤组织增殖. 东北林业大学学报 40(6), 16-18. |
| 19 | 杨文婷, 匡倩 (2016). 红豆杉组织培养的防褐变措施研究. 北方园艺 ( 17), 111-114. |
| 20 | 张文泉, 邓洁 (2016). 青钱柳叶片诱导愈伤组织研究. 内蒙古农业大学学报(自然科学版) 37(2), 28-33. |
| 21 | 赵伶俐, 葛红, 范崇辉, 印芳, 李秋香, 周玉杰 (2006). 不同光照强度对蝴蝶兰组培中外植体褐化的影响. 北方园艺 ( 4), 160-161. |
| 22 | 周凤, 于卉, 葛占宇, 周芝辉, 邓燕燕, 付永彩 (2010). 微量元素浓度对3个籼稻品种愈伤组织褐化和分化的影响. 农业生物技术学报 18, 702-706. |
| 23 | Creasy LL (1968). The increase in phenylalanine ammonia- lyase activity in strawberry leaf disks and its correlation with flavonoid synthesis. Phytochemistry 7, 441-446. |
| 24 | Fang SZ, Wang JY, Wei ZY, Zhu ZX (2006). Methods to break seed dormancy in Cyclocarya paliurus(Batal) Iljinskaja. Sci Hortic 110, 305-309. |
| 25 | Kumar S, Mangal M, Dhawan AK, Singh N (2013). Callus induction and plant regeneration from leaf explants of jojoba [Simmondsia chinensis(Link) Schneider]. India J Biotechnol 12, 544-547. |
| [1] | 王贝贝, 吴苏, 王苗苗, 胡锦涛. 日光诱导叶绿素荧光不同组分在作物总初级生产力估算中的贡献比例: 多时间尺度分析[J]. 植物生态学报, 2025, 49(4): 562-572. |
| [2] | 刘柯言, 韩璐, 宋午椰, 张初蕊, 胡旭, 许行, 陈立欣. 基于日光诱导叶绿素荧光探测干旱对黄土高原植被光合稳定性的影响[J]. 植物生态学报, 2025, 49(3): 415-431. |
| [3] | 郭政, 邵香君, 鲁海雯, 侯丹, 孔思梦, 李翔宇, 刘华倩, 林新春. 马来甜龙竹多倍体高效诱导及鉴定[J]. 植物学报, 2025, 60(2): 246-255. |
| [4] | 宋想, 王璐瑶, 富博晓, 李双达, 魏媛媛, 洪艳, 戴思兰. 高等植物启动子元件鉴定与合成研究进展[J]. 植物学报, 2024, 59(5): 691-708. |
| [5] | 李宇琛, 赵海霞, 姜希萍, 黄馨田, 刘亚玲, 吴振映, 赵彦, 付春祥. 根癌农杆菌介导的蒙古冰草稳定遗传转化体系建立[J]. 植物学报, 2024, 59(4): 600-612. |
| [6] | 田旭平, 岳康杰, 王佳丽, 刘慧欣, 史子尹, 亢红伟. 毛建草愈伤组织诱导及植株再生[J]. 植物学报, 2024, 59(4): 613-625. |
| [7] | 赵来鹏, 王柏柯, 杨涛, 李宁, 杨海涛, 王娟, 闫会转. SlHVA22l基因调节番茄耐旱性[J]. 植物学报, 2024, 59(4): 558-573. |
| [8] | 廖人玉, 王佳伟. 从损伤到重生——REF1小肽如何激发植物的内在再生潜能[J]. 植物学报, 2024, 59(3): 347-350. |
| [9] | 康敏, 张美莹, 齐秀双, 佟宁宁, 李旸, 舒庆艳, 刘政安, 吕长平, 彭丽平. 伊藤杂种‘和谐’组培快繁体系的建立[J]. 植物学报, 2024, 59(3): 441-451. |
| [10] | 曾浩, 李佩芳, 郭至辉, 刘春林, 阮颖. 银扇草再生体系的建立[J]. 植物学报, 2024, 59(3): 433-440. |
| [11] | 张尚文, 黄诗宇, 杨天为, 李婷, 张向军, 高曼熔. 基于正交实验的赤苍藤组培快繁体系建立[J]. 植物学报, 2024, 59(1): 99-109. |
| [12] | 刘小飞, 孙映波, 黄丽丽, 杨钰钗, 朱根发, 于波. 黑鹅绒海芋体细胞胚发生和植株再生[J]. 植物学报, 2023, 58(5): 750-759. |
| [13] | 张金燕, 寸竹, 双升普, 洪杰, 孟珍贵, 陈军文. 阴生植物三七稳态和动态光合特性对氮水平的响应[J]. 植物生态学报, 2023, 47(3): 331-347. |
| [14] | 刘叶飞, 赵海霞, 姜希萍, 邱锐, 周昕越, 赵彦, 付春祥. 野大麦高效组培快繁及农杆菌介导的愈伤侵染体系建立[J]. 植物学报, 2023, 58(3): 440-448. |
| [15] | 任培鑫, 李鹏, 彭长辉, 周晓路, 杨铭霞. 洞庭湖流域植被光合物候的时空变化及其对气候变化的响应[J]. 植物生态学报, 2023, 47(3): 319-330. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||