

植物学报 ›› 2018, Vol. 53 ›› Issue (4): 441-444.DOI: 10.11983/CBB18087 cstr: 32102.14.CBB18087
收稿日期:2018-04-04
接受日期:2018-04-16
出版日期:2018-07-01
发布日期:2018-05-04
通讯作者:
邓兴旺
作者简介:† 共同第一作者。
He Guangming, Deng Xingwang*( )
)
Received:2018-04-04
Accepted:2018-04-16
Online:2018-07-01
Published:2018-05-04
Contact:
Deng Xingwang
About author:† These authors contributed equally to this paper
摘要: 程序性细胞死亡(PCD)是生物体受遗传调控的自主细胞死亡现象, 在植物生长发育和抵抗环境胁迫中起重要作用。PCD的发生可受线粒体中活性氧(ROS)诱导。中国科学院遗传与发育生物学研究所李家洋研究组早期的研究发现了1个拟南芥(Arabidopsis thaliana)细胞死亡突变体mod1, 并暗示植物细胞中存在叶绿体与线粒体之间的信号交流调控PCD, 但其中的具体作用机制尚不清楚。最近, 他们通过大规模筛选mod1突变体的抑制突变体, 克隆了3个新的抑制基因plNAD- MDH、DiT1和mMDH1。此3个基因分别编码质体定位的NAD依赖的苹果酸脱氢酶、叶绿体被膜定位的二羧酸转运蛋白1和线粒体定位的苹果酸脱氢酶1, 突变后都可抑制mod1中ROS的积累及PCD的发生。通过对这些基因进行深入的功能分析, 他们论证了苹果酸从叶绿体到线粒体的转运对线粒体中ROS的产生及随后PCD的诱导起重要作用。该研究拓展了我们对植物细胞中细胞器间交流的认识, 为我们深入理解植物PCD发生机制提供了新线索, 是该领域的一项突破性进展。
何光明, 邓兴旺. 死亡信号传递: 叶绿体与线粒体间信号交流调控植物程序性细胞死亡. 植物学报, 2018, 53(4): 441-444.
He Guangming, Deng Xingwang. Death Signal Transduction: Chloroplast-to-Mitochondrion Communication Regulates Programmed Cell Death in Plants. Chinese Bulletin of Botany, 2018, 53(4): 441-444.
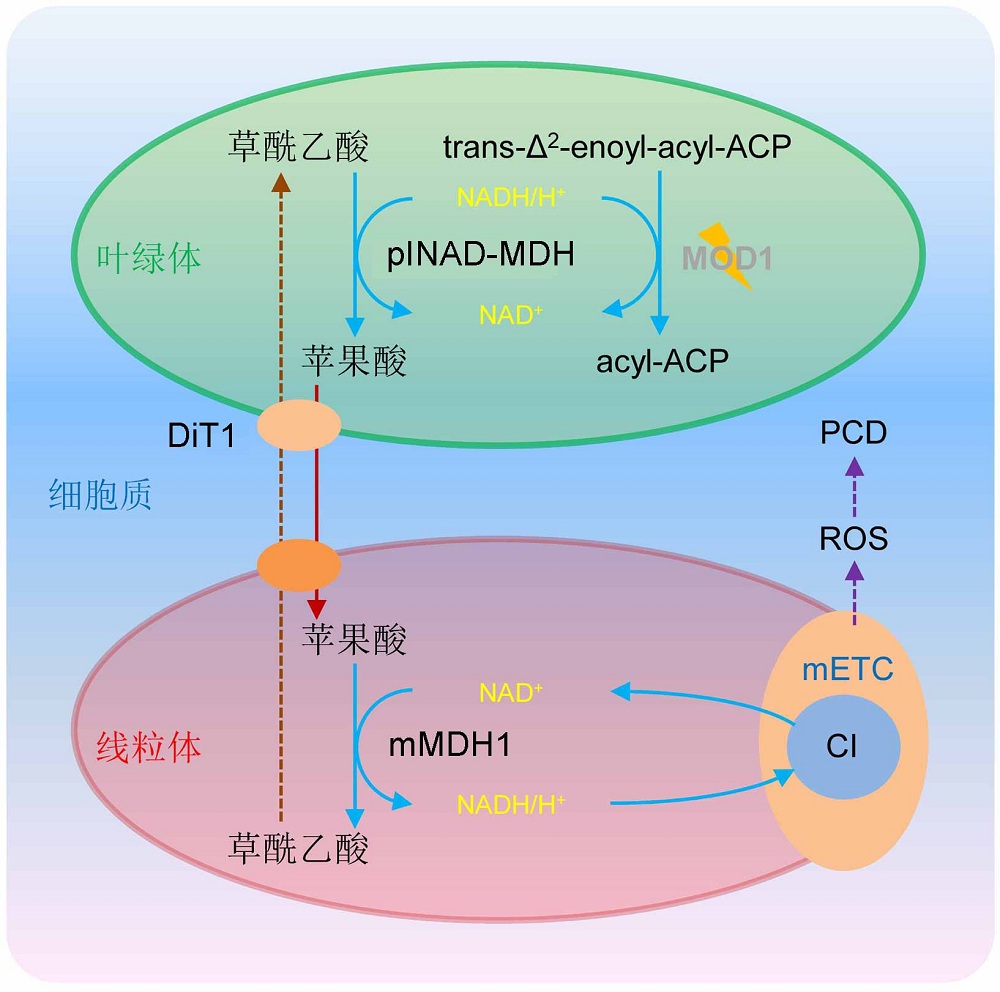
图1 叶绿体与线粒体间信号交流调控植物程序性细胞死亡(PCD)的工作模型(改自Zhao et al., 2018)植物MOD1基因编码烯酰基酰基载体蛋白还原酶, 该酶以NADH作为共同底物参与催化叶绿体中脂肪酸的合成。在mod1突变体中, MOD1的功能缺失或表达量降低导致NADH/H+在叶绿体中大量积累; 过量的NADH/H+使叶绿体中的草酰乙酸在plNAD-MDH的作用下被还原为苹果酸; 携带还原力的苹果酸通过定位于叶绿体内膜上的DiT1转运蛋白转运到细胞质中, 并进一步通过定位于线粒体膜上的一种未知转运蛋白转移到线粒体; 在线粒体中, mMDH1将携带还原力的苹果酸脱氢转化为草酰乙酸, 同时生成NADH/H+。线粒体中积累的NADH/H+为线粒体膜上的mETC复合体I (CI)提供电子, 产生活性氧(ROS), 最终导致mod1突变体细胞发生PCD。
Figure 1 A proposed model explaining the programmed cell death in plants regulated by chloroplast-to-mitochondrion communication (modified from Zhao et al., 2018)In plants, MOD1 encodes an enoyl-acyl carrier protein (ACP) reductase, which is involved in catalyzing the de novo biosynthesis of fatty acids in plastids using NADH as cosubstrate. The deficiency of MOD1 in mod1 mutant leads to an increased level of NADH/H+ in the chloroplast, which drives oxaloacetate to be converted to malate by plNAD-MDH. Malate carrying the reducing equivalents is transported out of the chloroplast into the cytosol by DiT1, which is localized in the chloroplast inner envelope membrane, and then is trans- ported into the mitochondrion by an unidentified transporter localized in the mitochondrion membrane. In the mitochondrion, malate is converted to oxaloacetate by mMDH1, and simultaneously NADH/H+ is generated to provide electrons for mETC complex I (CI) to induce the ROS formation and initiate the PCD process in the mod1 cells.
| 1 | Beers EP (1997). Programmed cell death during plant growth and development.Cell Death Differ 4, 649-661. |
| 2 | Berkemeyer M, Scheibe R, Ocheretina O (1998). A novel, non-redox-regulated NAD-dependent malate dehydrogenase from chloroplasts of Arabidopsis thaliana L. J Biol Chem 273, 27927-27933. |
| 3 | Coll NS, Epple P, Dangl JL (2011). Programmed cell death in the plant immune system.Cell Death Differ 18, 1247-1256. |
| 4 | Dickman M, Williams B, Li Y, de Figueiredo P, Wolpert T (2017). Reassessing apoptosis in plants.Nat Plants 3, 773-779. |
| 5 | Gorlach A, Bertram K, Hudecova S, Krizanova O (2015). Calcium and ROS: a mutual interplay.Redox Biol 6, 260-271. |
| 6 | Mou Z, He Y, Dai Y, Liu X, Li J (2000). Deficiency in fatty acid synthase leads to premature cell death and dramatic alterations in plant morphology.Plant Cell 12, 405-418. |
| 7 | Schuldiner M, Guo W (2015). Editorial overview: cell organe- lles: organelle communication: new means and new views. Curr Opin Cell Biol 35, v-vi. |
| 8 | Taniguchi M, Taniguchi Y, Kawasaki M, Takeda S, Kato T, Sato S, Tabata S, Miyake H, Sugiyama T (2002). Iden- tifying and characterizing plastidic 2-oxoglutarate/malate and dicarboxylate transporters in Arabidopsis thaliana. Plant Cell Physiol 43, 706-717. |
| 9 | Tomaz T, Bagard M, Pracharoenwattana I, Lindén P, Lee CP, Carroll AJ, Ströher E, Smith SM, Gardeström P, Millar AH (2010). Mitochondrial malate dehydrogenase lowers leaf respiration and alters photorespiration and plant growth in Arabidopsis. Plant Physiol 154, 1143-1157 . |
| 10 | Van Aken O, Van Breusegem F (2015). Licensed to kill: mitochondria, chloroplasts, and cell death.Trends Plant Sci 20, 754-766. |
| 11 | Van Breusegem F, Dat JF (2006). Reactive oxygen species in plant cell death.Plant Physiol 141, 384-390. |
| 12 | Wu J, Sun Y, Zhao Y, Zhang J, Luo L, Li M, Wang J, Yu H, Liu G, Yang L, Xiong G, Zhou JM, Zuo J, Wang Y, Li J (2015). Deficient plastidic fatty acid synthesis triggers cell death by modulating mitochondrial reactive oxygen species.Cell Res 25, 621-633. |
| 13 | Zhao YN, Luo LL, Xu JS, Xin PY, Guo HY, Wu J, Bai L, Wang GD, Chu JF, Zuo JR, Yu H, Huang X, Li JY (2018). Malate transported from chloroplast to mitochondrion triggers production of ROS and PCD in Arabidopsis thaliana. Cell Res 28, 448-461. |
| [1] | 谢涛, 章一帆, 刘云辉, 游慧玉, 夏季奔奔, 马蓉, 张春妮, 华学军. 植物线粒体铁硫簇合成系统及其调控的研究进展[J]. 植物学报, 2025, 60(4): 1-0. |
| [2] | 王传永, 庄典, 宋正达, 翟恒华, 李乃伟, 张凡. 黑果腺肋花楸叶绿体全基因组的结构和比较分析及系统进化推断[J]. 植物学报, 2025, 60(4): 1-0. |
| [3] | 林珍, 向家宝, 蔡何佳奕, 高贝, 杨金涛, 李俊毅, 周青松, 黄晓磊, 邓鋆. 七种半翅目昆虫线粒体基因组数据[J]. 生物多样性, 2025, 33(2): 24434-. |
| [4] | 殷斯, 杨依婷, 卢瑞玲, 念蕊, 郝转, 高永. 滇魔芋中国种群的谱系地理研究[J]. 植物生态学报, 2025, 49(2): 308-319. |
| [5] | 邓洪, 钟占友, 寇春妮, 朱书礼, 李跃飞, 夏雨果, 武智, 李捷, 陈蔚涛. 基于线粒体全基因组揭示斑鳠的种群遗传结构与演化历史[J]. 生物多样性, 2025, 33(1): 24241-. |
| [6] | 于晓琳, 李西雅, 夏冰玉洁, 李昊, 谭保才, 王勇. PPR蛋白参与细胞器RNA C→U编辑机制研究进展[J]. 植物学报, 2024, 59(6): 903-911. |
| [7] | 黄佳慧, 杨惠敏, 陈欣雨, 朱超宇, 江亚楠, 胡程翔, 连锦瑾, 芦涛, 路梅, 张维林, 饶玉春. 水稻突变体pe-1对弱光胁迫的响应机制[J]. 植物学报, 2024, 59(4): 574-584. |
| [8] | 张悦婧, 桑鹤天, 王涵琦, 石珍珍, 李丽, 王馨, 孙坤, 张继, 冯汉青. 植物对非生物胁迫系统性反应中信号传递的研究进展[J]. 植物学报, 2024, 59(1): 122-133. |
| [9] | 褚振州, 古丽巴哈尔·依斯拉木, 屈泽众, 田新民. 同域分布的3种木蓼属植物叶绿体基因组比较[J]. 植物学报, 2023, 58(3): 417-432. |
| [10] | 包金波, 丁志杰, 苗浩宇, 李雪丽, 任书贤, 焦若岩, 李浩, 邓茜茜, 李英姿, 田新民. 石栗叶绿体基因组研究[J]. 植物学报, 2023, 58(2): 248-260. |
| [11] | 卢聪聪, 刘倩, 黄晓磊. 三种蚜虫的线粒体基因组数据[J]. 生物多样性, 2022, 30(7): 22204-. |
| [12] | 周玉萍, 颜嘉豪, 田长恩. 保卫细胞中ABA信号调控机制研究进展[J]. 植物学报, 2022, 57(5): 684-696. |
| [13] | 刘晓龙, 季平, 杨洪涛, 丁永电, 付佳玲, 梁江霞, 余聪聪. 脱落酸对水稻抽穗开花期高温胁迫的诱抗效应[J]. 植物学报, 2022, 57(5): 596-610. |
| [14] | 李晨, 刘建廷, 樊永信, 赵雪惠, 肖伟, 陈修德, 付喜玲, 李玲, 李冬梅. UV-B对设施桃叶片光合功能及叶绿体超微结构的影响[J]. 植物学报, 2022, 57(4): 434-443. |
| [15] | 胡海涛, 钱婷婷, 杨玲. 基于H2DCFDA荧光探针的植物活性氧检测方法[J]. 植物学报, 2022, 57(3): 320-326. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||