基于CRISPR/Cas9的基因编辑技术研究进展及其在植物中的应用
何晓玲, 刘鹏程, 马伯军, 陈析丰
植物学报
2022, 57 ( 4):
508-531.
DOI: 10.11983/CBB22020
CRISPR/Cas9技术是利用RNA靶向引导Cas9核酸酶对基因组中的目标基因进行编辑的生物技术。近年来, 该技术的多种新型基因编辑器更新迅猛, 编辑效果愈加精细和高效, 在作物定向分子设计育种中展现出巨大的应用前景。该文对CRISPR/Cas9及其相关编辑器的技术原理、编辑效果和应用情况进行综述, 并探讨了该技术在应用中面临的问题、应对措施和发展前景, 旨在为相关领域的科研工作者提供参考。
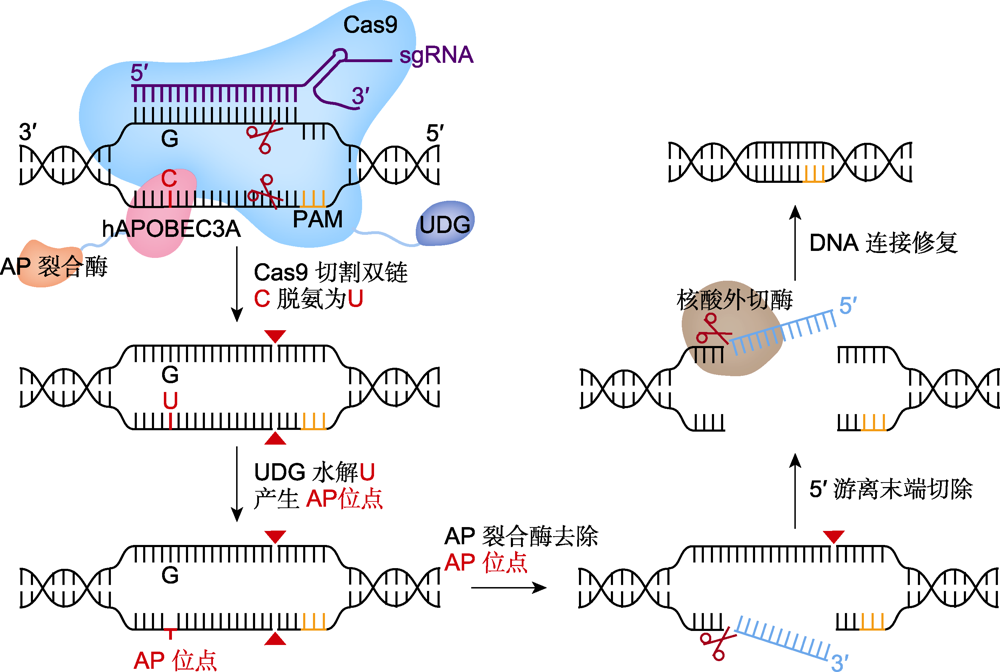
View image in article
图4
多核苷酸靶向删除系统(AFID)的工作原理
Cas9切割双链产生双链断裂(DSB), 尿嘧啶-DNA-糖基化酶(UDG)将C脱氨生成的U水解为AP位点, 并借助AP裂合酶(橙红色)和核酸外切酶(棕色), 实现靶点C到DSB切口之间的多核苷酸删除。PAM: 原间隔序列邻近基序
正文中引用本图/表的段落
虽然PE能实现几十bp片段的精确删除, 但其删除的片段范围较小, 且编辑效率有待提高。同样, 在目标DNA序列的两侧设计2个靶点, 借助NHEJ介导的修复实现CRISPR/Cas9片段删除的效率也很低, 但是有报道表明以微同源介导的末端连接(microhomology-mediated end joining, MMEJ)修复方式可增加大片段DNA缺失的发生率(谢先荣等, 2021)。Wang等(2020)基于胞嘧啶脱氨与碱基切除修复原理, 成功研发出新型片段删除编辑器AFID, 其主要由胞嘧啶脱氨酶hAPOBEC3A、尿嘧啶-DNA-糖基化酶(UDG)、AP裂合酶与Cas9组成。AFID系统工作时, 一条sgRNA引导Cas9在靶位点PAM附近产生DSB, 同时hAPOBEC3A酶催化sgRNA非互补ssDNA上活性窗口内的C脱氨成U, UDG识别该处U:G的错配并将U切除产生AP位点, 进而AP裂合酶会去除AP位点, 使sgRNA非互补ssDNA从5′端AP位点到3′端DSB位点之间产生>3 bp的多核苷酸删除。在sgRNA与互补ssDNA解离后, 随之暴露出的游离5′端在细胞DNA修复过程中被切除成为平末端, 再通过连接酶连接DSB双链, 最终导致靶位点的双链DNA片段删除(图4)。目前, AFID已有4个版本(AFID-1、2、3和eAFID-3), 在水稻和小麦基因组中均可实现精准、可预测的片段删除, 其中AFID-3介导的删除效率高达33.1%。在此基础上, Wang等(2020)又通过截短hAPOBEC3A获得新的A3Bctd脱氨酶变体, 其编辑窗口更窄且脱氨活性更高, 由A3Bctd与AFID-3组合成的eAFID-3编辑器, 其效率是AFID-3的1.5倍。此外, Jiang等(2022)基于PE开发了一种精确删除大片段DNA的技术PEDAR (PE-Cas9-based deletion and repair), 用Cas9替换nCas9H840A蛋白, 并增加一条额外的pegRNA, 其携带与另一条pegRNA模板互补的核苷酸序列, 2条pegRNA在DNA序列两侧的2个位点进行DSB切割, 2处切割位点之间的片段被删除, 而逆转录酶沿切口3′末端合成黏性延伸序列, 诱导细胞通过黏性末端互补进行DNA修复, 从而完成精确可操控的大片段删除(1 000-10 000 bp范围内)。
本文的其它图/表
-
 表1
各类碱基编辑器的特点
表1
各类碱基编辑器的特点
-
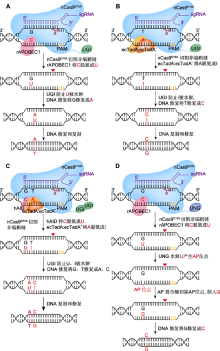 图1
单(CBE、ABE、GBE)、双(A&C-BEmax)碱基编辑器工作原理
图1
单(CBE、ABE、GBE)、双(A&C-BEmax)碱基编辑器工作原理
(A) BE3介导的C>T替换(在nCas9D10A (蓝色)、胞苷脱氨酶rAPOBEC1 (红色)和尿嘧啶糖基化酶抑制剂(UGI) (绿色)的作用下, 系统BE3将活性窗口中的C脱氨成U, 诱导细胞启动DNA修复实现C到T的替换; 红色三角形表示切口处); (B) ABE7.10介导的A>G替换(在腺苷脱氨酶ecTadA:ecTadA* (黄色和橙色)的作用下, 系统ABE7.10将活性窗口中的A脱氨成I, 并在DNA修复后实现A到G的替换); (C) A&C-BEmax介导的C>T与A>G共替换(在胞嘧啶脱氨酶hAID (红色)、ecTadA:ecTadA*和2个UGI的作用下, 系统A&C-BEmax诱导DNA修复, 实现C到T、A到G的同时替换); (D) GBE介导的C>G颠换(在尿嘧啶-N-糖基化酶(UNG) (深蓝)的作用下, UNG将C脱氨生成的U水解为AP位点, 并在DNA修复后实现C到G的颠换)。PAM: 原间隔序列邻近基序
-
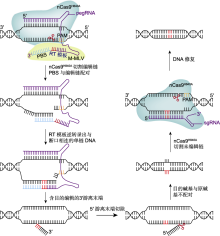 图2
先导编辑器(PE)的工作原理
图2
先导编辑器(PE)的工作原理
在nCas9H840A (绿)和逆转录酶M-MLV (黄)的作用下, 系统PE将碱基序列连接到靶位点, 借助DNA修复实现任意碱基的转换以及小片段的插入或删除。PAM: 原间隔序列邻近基序; PBS: 引物结合位点
-
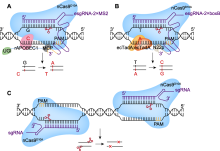 图3
多重编辑系统(SWISS)的工作原理
图3
多重编辑系统(SWISS)的工作原理
(A), (B) SWISS系统使用不同的scRNAs (MS2和boxB), 招募融合了相应蛋白(MCP和N22p)的rAPOBEC1或ecTadA:ecTadA*, 实现同时在不同位点的胞嘧啶碱基编辑(CBE)和腺嘌呤碱基编辑(ABE); (C) 使用1对sgRNA在第3个靶点产生DNA双链断裂(DSB), 诱导细胞进行同源定向修复(HDR), 产生随机突变。PAM: 原间隔序列邻近基序; UGI: 尿嘧啶糖基化酶抑制剂
-
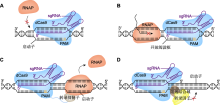 图5
CRISPR干扰系统的工作原理
图5
CRISPR干扰系统的工作原理
(A) dCas9阻止RNA聚合酶(RNAP)结合基因启动子, sgRNA介导dCas9结合目的基因启动子, 使RNAP (红色)无法与该基因启动子结合并进行转录; (B) dCas9阻断RNAP的转录延伸, sgRNA介导dCas9结合目的基因开放阅读框(ORF), 使RNAP无法继续转录延伸; (C) 转录抑制子阻止RNAP结合基因启动子, dCas9与转录抑制子(灰色)融合, 抑制子会阻止RNAP与目的基因启动子的结合; (D) 阻遏结合域(RBD)阻止目的基因的转录激活, dCas9与RBD (棕色)融合, RBD阻断转录因子(TFs)与目的基因的结合, 并与TFs结合形成强阻遏物抑制基因的转录表达。PAM: 原间隔序列邻近基序
-
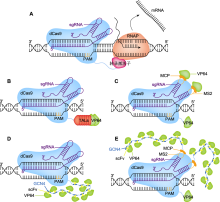 图6
CRISPR激活系统的工作原理
图6
CRISPR激活系统的工作原理
(A) 转录激活子激活目的基因转录, dCas9与转录激活子(洋红色)融合, 招募RNA聚合酶(RNAP)并激活目的基因的转录; (B)-(E) 不同CRISPRa系统示意图, 包括TALs (橙红色)、VP64 (绿色)、MS2 (浅黄色)、MCP (深黄色)、GCN4 (湛蓝色)和scFv (明黄色)。PAM: 原间隔序列邻近基序
-
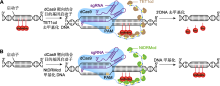 图7
基因组修饰系统去甲基化和甲基化的工作原理
图7
基因组修饰系统去甲基化和甲基化的工作原理
(A) DNA去甲基化修饰, dCas9-SunTag系统招募人脱甲基酶TET1cd (棕色), 在目的基因的启动子区使DNA去甲基化, Me表示甲基化; (B) DNA甲基化修饰, dCas9-SunTag系统招募烟草DRM甲基转移酶催化结构域NtDRMcd (绿色), 在目的基因启动子区使DNA甲基化。PAM: 原间隔序列邻近基序
-
 表2
碱基编辑器在作物中的应用
表2
碱基编辑器在作物中的应用
|
