
|
|
||
|
基于CRISPR/Cas9的基因编辑技术研究进展及其在植物中的应用
植物学报
2022, 57 (4):
508-531.
DOI: 10.11983/CBB22020
CRISPR/Cas9技术是利用RNA靶向引导Cas9核酸酶对基因组中的目标基因进行编辑的生物技术。近年来, 该技术的多种新型基因编辑器更新迅猛, 编辑效果愈加精细和高效, 在作物定向分子设计育种中展现出巨大的应用前景。该文对CRISPR/Cas9及其相关编辑器的技术原理、编辑效果和应用情况进行综述, 并探讨了该技术在应用中面临的问题、应对措施和发展前景, 旨在为相关领域的科研工作者提供参考。 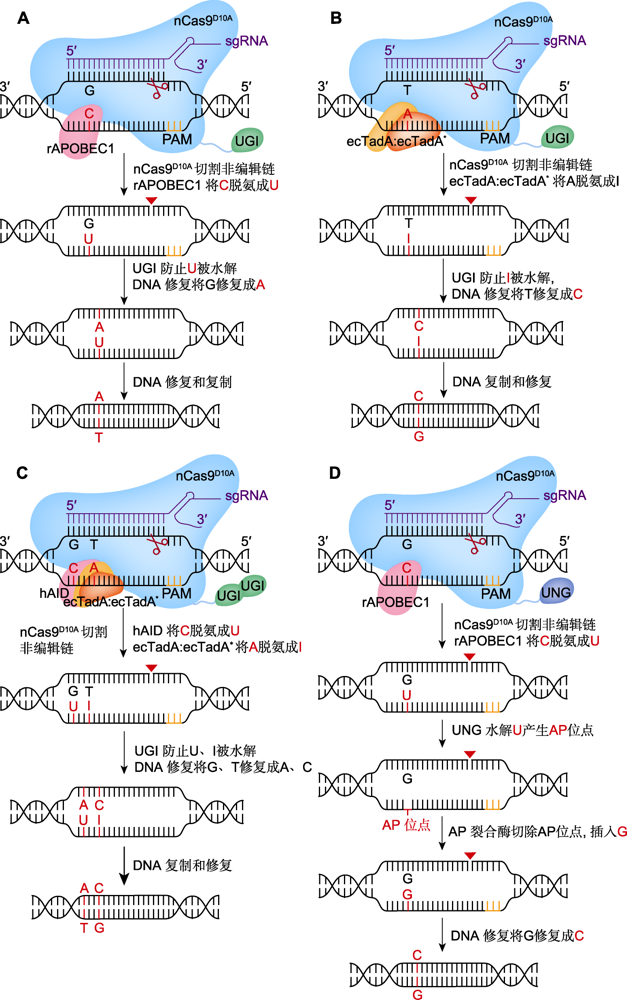 View image in article
图1
单(CBE、ABE、GBE)、双(A&C-BEmax)碱基编辑器工作原理
(A) BE3介导的C>T替换(在nCas9D10A (蓝色)、胞苷脱氨酶rAPOBEC1 (红色)和尿嘧啶糖基化酶抑制剂(UGI) (绿色)的作用下, 系统BE3将活性窗口中的C脱氨成U, 诱导细胞启动DNA修复实现C到T的替换; 红色三角形表示切口处); (B) ABE7.10介导的A>G替换(在腺苷脱氨酶ecTadA:ecTadA* (黄色和橙色)的作用下, 系统ABE7.10将活性窗口中的A脱氨成I, 并在DNA修复后实现A到G的替换); (C) A&C-BEmax介导的C>T与A>G共替换(在胞嘧啶脱氨酶hAID (红色)、ecTadA:ecTadA*和2个UGI的作用下, 系统A&C-BEmax诱导DNA修复, 实现C到T、A到G的同时替换); (D) GBE介导的C>G颠换(在尿嘧啶-N-糖基化酶(UNG) (深蓝)的作用下, UNG将C脱氨生成的U水解为AP位点, 并在DNA修复后实现C到G的颠换)。PAM: 原间隔序列邻近基序
正文中引用本图/表的段落
CBE是研发的第1类单碱基编辑器。首先, 为了避免Cas9产生DSB而造成的随机突变, 研究者通过将Cas9蛋白序列中第10位氨基酸Asp替换为Ala (简称D10A), 使得RuvC结构域无法切割DNA, 而保留了HNH结构域的核酸酶功能, 获得了一种只切割sgRNA互补ssDNA的nCas9D10A蛋白。然后, 在nCas9D10A的N端融合大鼠的胞嘧啶脱氨酶rAPOBEC1, 在C端融合大鼠的尿嘧啶糖基化酶抑制剂UGI, 研发了一种在动物细胞中能将胞嘧啶(C)编辑成胸腺嘧啶(T)的碱基编辑器BE3 (Komor et al., 2016)。其工作原理是nCas9D10A在sgRNA引导下, 在基因组靶位点处切割sgRNA互补ssDNA, 同时rAPOBEC1对sgRNA非互补ssDNA上编辑活性窗口(C4-C8)中胞苷(C)脱氨成尿苷(U), 并利用UGI防止U被尿嘧啶-N-糖基化酶UNG水解, 再借助细胞自身对DNA的修复, 以sgRNA非互补ssDNA为模板, 将U:G错配修复成U:A, 进而在DNA复制后产生T:A, 实现C:G至T:A替换, 简写为C>T替换, 其互补链则发生相应的G>A替换(图1A)。为了使CBE应用于植物的基因编辑, Zong等(2017)在BE3编辑器构架基础上, 根据植物蛋白编码的偏好性对rAPOBEC1:nCas9D10A: UGI融合蛋白的密码子进行优化, 并采用玉米(Zea mays)的组成型启动子ZmUbi-1驱动表达, 成功开发出适用于植物的CBE编辑器nCas9-PBE, 在水稻(Oryza sativa)、小麦(Triticum aestivum)和玉米中实现C>T碱基替换, 效率达43.5%。然而, rAPOBEC1对TC基序中的C具有偏好性, 对GC基序中的C编辑效率则很低。通过将rAPOBEC1换成七鳃鳗的胞嘧啶脱氨酶PmCDA1 (Nishida et al., 2016)或人的胞嘧啶脱氨酶hAID (Ma et al., 2016), 可使CBE获得较好的GC碱基编辑能力, 从而弥补了这一缺陷。为了促进CBE在植物中C>T的编辑效果, Ren等(2021a)系统评估了rAPOBEC1、hAID、PmCDA1、hAPOBEC3A (A3A)、A3AY130F、eA3A和eA3AY130F六种胞嘧啶脱氨酶融合的CBE在水稻原生质体中的编辑效率, 发现融合A3AY130F (A3AY130F-CBE_V01)的编辑效率最佳(达37.9%); 并通过增加UGI数目改良得到A3AY130F- CBE_V04, 在不改变编辑效率及活性窗口(C4-C15)的情况下, 使Indel的发生率显著降低。Xu等(2021)利用PmCDA1同源物LjCDA1L-4, 对其密码子优化后与UGI和T2A (Thosea asigna virus 2A)-UGI融合到nCas9D10A的C端, 开发出新型的植物CBE工具eCDAL, 该编辑器可在水稻中实现高频的C>T替换, 且活性窗口拓宽至C1-C12。
鉴于CBE的成功案例, 理论上采用腺苷脱氨酶替换CBE的胞嘧啶脱氨酶, 就能将腺苷(A)脱氨成肌苷(I), 将I:T错配修复成I:C, 进而在DNA复制后产生G:C, 实现A:T至G:C的碱基替换(A>G), 获得腺嘌呤编辑器ABE。然而, Gaudelli等(2017)将大肠杆菌ecTadA、小鼠rADA25和人ADAT226等腺苷脱氨酶分别与nCas9D10A:UGI融合表达后, 发现各类重组蛋白的A>G转换效率与对照组并无显著性差异, 说明利用以上腺苷脱氨酶并不能实现ABE。于是, Gaudelli等(2017)对大肠杆菌的ecTadA进行诱变, 获得了一种突变蛋白ecTadA*, 并人工构建了ecTadA:ecTadA*二聚体腺苷脱氨酶, 再与nCas9D10A:UGI融合后, 成功获得了ABE7.10, 在动物细胞的编辑活性窗口(A4-A7)内能进行高效的A>G替换, 其互补链则发生了相应的T>C替换(图1B)。随后, 研究者通过对ABE7.10的进一步优化, 也顺利开发出适用于植物的ABE, 如PABE (Li et al., 2018a)和ABE-P2 (Hua et al., 2018), 在水稻中的A>G碱基替换率分别达59.1%与61.3%。Wei等(2021)在ecTadA*变体TadA8e中引入V106W突变, 基于TadA8eV106W开发出新型编辑器rABE8e, 在水稻多数靶点的编辑效率接近100%。Tan等(2022)将ssDNA结合结构域DBD (DNA-binding domain)和TadA8e分别与多种SpCas9变体融合, 开发了一套植物编辑器PhieABEs (hyABE8e- NG、hyABE8e-SpG和hyABE8e-SpRY), 其中, hyABE8e-SpRY (含变体SpRY)表现最佳, 能在水稻多个靶点实现100%的编辑, 活性窗口为A1-A13, 且不受PAM限制, 在测试靶点中未产生sgRNA依赖的脱靶效应。
无论是CBE, 还是ABE单碱基编辑器, 只能实现嘧啶之间或嘌呤之间的碱基转换, 而不能进行嘧啶与嘌呤之间的颠换。Zhao等(2021)将nCas9D10A与AID、UNG融合表达, 研发出一种能在大肠杆菌中实现C>A颠换的碱基编辑器GBE, 在sgRNA的引导下AID能将sgRNA非互补链上编辑活性窗口中的C脱氨为U, 随后被UNG水解产生AP位点, 而nCas9D10A则在sgRNA互补链上产生切口, 使细胞在启动DNA损伤修复时, 由于无法以sgRNA互补链为模板重新合成C, 而产生C>A颠换。将GBE的AID用大鼠rAPOBEC1替代后, 可对哺乳动物细胞编辑活性窗口内的C进行C>G颠换(图1D) (Zhao et al., 2021)。而同样能实现C>G颠换的碱基编辑器CGBEs (Chen et al., 2021), 由rAPOBEC1、nCas9D10A和X射线修复交叉互补蛋白1 (XRCC1)组成, 在细胞UNG水解U产生AP位点后, XRCC1协助G优先插入该位点, CGBE的编辑活性窗口是C5-C6位。GBE碱基颠换技术巧妙地利用UNG和细胞自身的DNA修复途径, 实现C向另3种碱基(A、G和T)的转换, 为基因编辑开辟了一条新的发展道路。
在ABE与CBE相继被报道后, 研究者又尝试将两者共转化到细胞中, 在同一靶点上进行胞嘧啶替换与腺嘌呤替换的同时编辑, 却发现共编辑的效率极低, 推测可能是由于CBE的胞嘧啶脱氨酶与ssDNA的亲和力要高于ABE的腺嘌呤脱氨酶, 使得CBE竞争性地在靶点处优先编辑, 而一旦编辑完成, sgRNA则不能与靶序列完美匹配, 从而影响ABE的正常工作(Li et al., 2020b; Xie et al., 2020)。Zhang等(2020)通过将胞嘧啶脱氨酶hAID和腺嘌呤脱氨酶ecTadA: ecTadA*同时融合在nCas9D10A的N端, 并将2个UGI串联在nCas9D10A的C端, 将2个NLS分别与hAID和UGI相连, 最后开发出可用于动物细胞的CBE-ABE双碱基编辑器A&C-BEmax (图1C)。其工作原理与单碱基编辑器相似, 融合表达的hAID和ecTadA: ecTadA*可以同时将活性窗口中的胞苷或腺苷脱氨为尿苷与肌苷, 并通过细胞的自身修复与DNA复制, 实现同一靶点上的C>T与A>G替换, 共编辑效率高达30%, 且A>G编辑活性窗口(A4-A7)保持不变, 而C>T编辑活性窗口扩展到C2-C17位, 比CBE的编辑范围更广(Zhang et al., 2020)。除了A&C-BEmax外, 还出现了其它类型的双碱基编辑器, 如Target-ACE (Sakata et al., 2019)、SPACE (Grünewald et al., 2020)和ACBE (Xie et al., 2020), 它们是将胞嘧啶脱氨酶PmCDA1与腺嘌呤脱氨酶ecTadA*分别融入nCas9D10A的C端和N端, 而不是同时融入其N端。这4种双碱基编辑器虽然都能有效介导A、C共编辑, 但同样是在哺乳动物细胞中进行, A&C-BEmax展现出更高的C>T编辑活性和A、C共编辑效率。为了开发适合植物的高效双碱基编辑器, Li等(2020a)通过将人胞嘧啶脱氨酶hAPOBEC3A与ecTadA:ecTadA*同时融合在nCas9D10A的N端, 成功研发出STEMEs编辑器, 在水稻中C>T与A>G的共编辑效率可达15.5%。Xu等(2021)基于CBE编辑器eCDAL的框架, 将TadA8e融入nCas9D10A的N端, 构建了植物双碱基编辑器pDuBE1, 该系统在水稻中实现了将近50%的A、C共替换效率, 且A>G活性窗口扩展至A2-A9。
本文的其它图/表
|