P515的测量原理、方法和应用
张春艳, 庞肖杰
植物学报
2021, 56 ( 5):
594-604.
DOI: 10.11983/CBB21052
光谱技术已广泛应用于光合研究领域, 如光吸收信号P515和P700氧化还原动力学以及叶绿素荧光等, 可快速、准确地检测植物的光合活性。P515信号广泛存在于高等植物和藻类中, 是类囊体膜上的色素分子吸收光能后, 其吸收光谱发生位移造成。利用光诱导的P515快速和慢速动力学, 可检测PSI和PSII反应中心的比值、ATP合酶的质子传导性、围绕PSI的环式电子传递速率、质子动力势及其组分, 还可通过同步检测叶绿素荧光和P515信号研究光保护机制。该文总结了P515的主要测量原理、方法及其应用, 旨在为深入研究光合作用机理提供技术支持。
View image in article
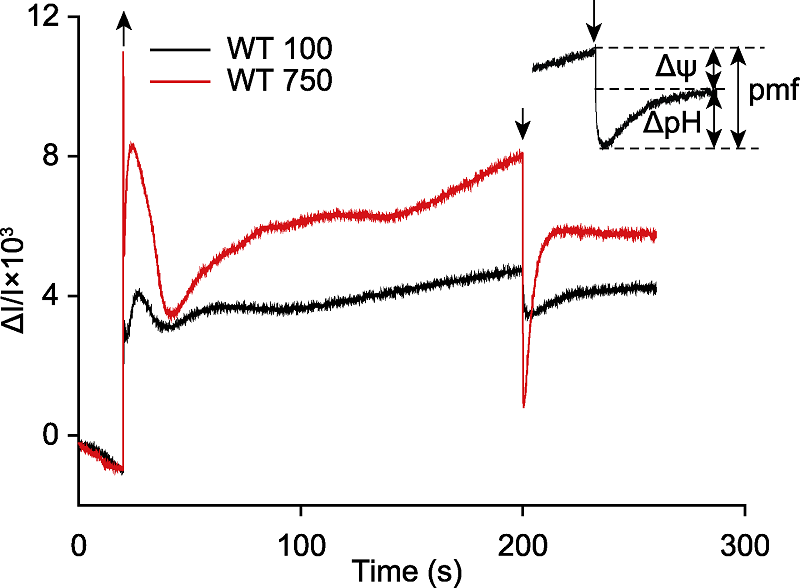
图4
拟南芥质子动力势(pmf)及其组分(ΔΨ和ΔpH)的测定
拟南芥离体叶片在光强为100 μmol·m-2·s-1 (WT 100, 黑)和750 μmol·m-2·s-1 (WT 750, 红)的活化光(635 nm)下照光3分钟, 照光期间提供稳定的CO2 (380 μmol·mol-1)、湿度(60%大气湿度)和温度(23°C)。黑暗时间60秒, 曲线为3次重复的平均值。测量前, 拟南芥叶片暗适应至少3小时。向上箭头表示活化光打开, 向下箭头表示活化光关闭。
正文中引用本图/表的段落
P515分钟级的慢速动力学比较复杂, 既反映质子动力势的生成, 也反映玉米黄素的生成。质子动力势(proton motive force, pmf)驱动ATP合酶产生ATP, 而pmf的组分——ΔpH会诱导光保护机制, 将过剩的光能以热能的形式耗散, 保护PSII免受光损伤(Niyogi et al., 1998; de Bianchi et al., 2010; Checchetto et al., 2013, 2016), 还可通过降低电子在Cytb6f复合物的传递速率, 保护PSI免受光抑制(Sonoike, 2011; Yamori et al., 2011)。跨膜电势(ΔΨ)也可调节PSII的光损伤。研究发现, 高水平的ΔΨ不仅降低NPQ的诱导效率(Duan et al., 2016)、增加PSII的光敏感性(Davis et al., 2016), 还导致PSII反应中心发生电荷重组, 促使单线态氧水平升高, 造成严重的光损伤(Bennoun, 1994)。我们的研究结果显示, 拟南芥在100 μmol·m-2·s-1的光强下, pmf为1.3, ΔpH约占56%, 而当光强达到750 μmol·m-2·s-1时, pmf增至7.2, ΔpH所占比例增至68%, ΔΨ减少至32% (图4), 说明ΔpH可能在光保护中起更关键的作用。
本文的其它图/表
-
 图1
饱和闪光诱导的P515快速动力学
图1
饱和闪光诱导的P515快速动力学
(A) 饱和闪光诱导的P515快速动力学示意图, 包括快速上升阶段(橙)、缓慢上升阶段(蓝)和缓慢下降阶段(绿), 箭头表示1次单周转饱和闪光(ST); (B) 饱和闪光诱导莱茵衣藻在520-550 nm的快速吸收变化(单周转饱和闪光波长635 nm, 光强200000 μmol·m-2·s-1, 持续时间5 μs), 莱茵衣藻野生型(WT) (浓度约25 μg·mL-1)加入(红)和不加入(黑) 10 µmol·L-1二氯苯基二甲脲(DCMU)和1 mmol·L-1羟胺(HA), 测量前莱茵衣藻暗适应20分钟; (C) 预照光对P515快速动力学的影响, 莱茵衣藻野生型在暗适应20分钟(黑)以及在光下持续照光2分钟(光强40 μmol·m-2·s-1), 黑暗1分钟(红)后的P515快速动力学。
-
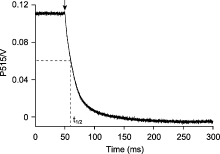 图2
测量拟南芥叶绿体ATP合酶的质子传导性
图2
测量拟南芥叶绿体ATP合酶的质子传导性
拟南芥离体叶片在光强为500 μmol·m-2·s-1的活化光(635 nm)下照光10分钟, 照光期间提供稳定的CO2 (380 μmol·mol-1)、湿度(60%大气湿度)和温度(23°C)。检测黑暗250 ms的P515衰减动力学, 重复100次后取平均值。ATP合酶的质子传导率为P515衰减动力学曲线半衰期(t1/2)的倒数, 即94.3·s-1。箭头表示活化光关闭。
-
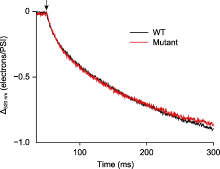 图3
测量莱茵衣藻围绕PSI的环式电子传递速率
图3
测量莱茵衣藻围绕PSI的环式电子传递速率
莱茵衣藻野生型(WT)和PGR5突变体(Mutant)在光强为80 μmol·m-2·s-1的活化光(635 nm)下照光5分钟, 关光后检测围绕PSI的环式电子传递速率, 黑暗持续时间为250 ms。测量前, 藻细胞(浓度约25 μg·mL-1)加入10 µmol·L-1二氯苯基二甲脲(DCMU)、1 mmol·L-1羟胺(HA)和20%的聚蔗糖, 暗适应20分钟。箭头表示活化光关闭。
-
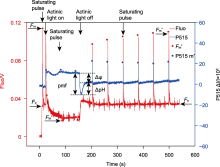 图5
同步测量莱茵衣藻P515信号和叶绿素荧光
图5
同步测量莱茵衣藻P515信号和叶绿素荧光
将莱茵衣藻野生型(浓度约30 μg·mL-1)暗适应20分钟, 放入荧光仪的测量室, 分别打开P515/535模块和叶绿素荧光模块的测量光, 测定初始荧光产量(Fo)。打开饱和闪光(635 nm, 6000 μmol·m-2·s-1, 持续时间250 ms), 测定黑暗状态下的最大荧光产量(Fm)。之后打开活化光(635 nm, 1500 μmol·m-2·s-1), 持续照光140秒, 期间每隔60秒施加1次饱和闪光, 测定光下最大荧光产量(Fm′)。活化光关闭后测定质子动力势(pmf)及其组分(ΔΨ和ΔpH), 与此同时每隔60秒施加1次饱和闪光, 检测黑暗状态下的荧光产量是否恢复到最大荧光产量(Fm)。Fo: 初始荧光产量; Fm: 最大荧光产量; Fm′: 光下最大荧光产量; Fs: 稳态荧光产量; Actinic light: 活化光; Saturating pulse: 饱和闪光; pmf: 质子动力势; ΔΨ: 跨膜电势; ΔpH: 跨膜质子梯度
|
