
|
|
||
|
P515的测量原理、方法和应用
植物学报
2021, 56 (5):
594-604.
DOI: 10.11983/CBB21052
光谱技术已广泛应用于光合研究领域, 如光吸收信号P515和P700氧化还原动力学以及叶绿素荧光等, 可快速、准确地检测植物的光合活性。P515信号广泛存在于高等植物和藻类中, 是类囊体膜上的色素分子吸收光能后, 其吸收光谱发生位移造成。利用光诱导的P515快速和慢速动力学, 可检测PSI和PSII反应中心的比值、ATP合酶的质子传导性、围绕PSI的环式电子传递速率、质子动力势及其组分, 还可通过同步检测叶绿素荧光和P515信号研究光保护机制。该文总结了P515的主要测量原理、方法及其应用, 旨在为深入研究光合作用机理提供技术支持。 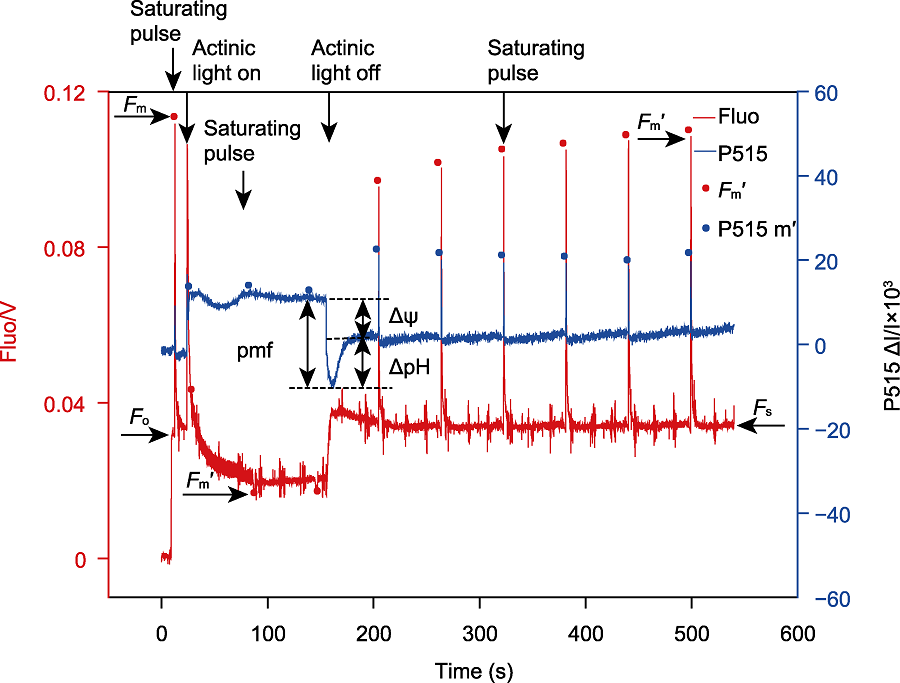 View image in article
图5
同步测量莱茵衣藻P515信号和叶绿素荧光
将莱茵衣藻野生型(浓度约30 μg·mL-1)暗适应20分钟, 放入荧光仪的测量室, 分别打开P515/535模块和叶绿素荧光模块的测量光, 测定初始荧光产量(Fo)。打开饱和闪光(635 nm, 6000 μmol·m-2·s-1, 持续时间250 ms), 测定黑暗状态下的最大荧光产量(Fm)。之后打开活化光(635 nm, 1500 μmol·m-2·s-1), 持续照光140秒, 期间每隔60秒施加1次饱和闪光, 测定光下最大荧光产量(Fm′)。活化光关闭后测定质子动力势(pmf)及其组分(ΔΨ和ΔpH), 与此同时每隔60秒施加1次饱和闪光, 检测黑暗状态下的荧光产量是否恢复到最大荧光产量(Fm)。Fo: 初始荧光产量; Fm: 最大荧光产量; Fm′: 光下最大荧光产量; Fs: 稳态荧光产量; Actinic light: 活化光; Saturating pulse: 饱和闪光; pmf: 质子动力势; ΔΨ: 跨膜电势; ΔpH: 跨膜质子梯度
正文中引用本图/表的段落
植物体内存在多种能量耗散机制, 如叶绿素荧光淬灭和热耗散。这些能量耗散机制可能均受类囊体腔酸化的调控(付振书等, 2004), 同步检测活体样品在正常/高光胁迫条件下的P515信号与叶绿素荧光, 可得到实时准确的同步变化数据, 有利于分析各能量耗散机制之间的关系, 深入研究光保护机理。莱茵衣藻是研究光合作用的模式生物, 用强活化光(1 500 μmol·m-2·s-1)处理莱茵衣藻时, 会导致大部分光合反应中心关闭, 光化学量子产量降低, 对光合膜有害的过剩激发能量累积。此外, 光合电子传递将质子从类囊体基质不断转移到类囊体囊腔, 从而使类囊体囊腔不断酸化, 逐渐建立pmf, 与此同时激活非光化学猝灭(NPQ) (Demmig-Adams et al., 2012)。在莱茵衣藻中, NPQ依赖于一种色素结合蛋白-光捕获蛋白(LHCSR), 该蛋白具有pH敏感性。LHCSR的C端结构域暴露在类囊体囊腔侧, 随着类囊体囊腔的不断酸化, NPQ被激活, 从而耗散过剩的激发能, 启动光保护机制(Liguori et al., 2013)。随着强活化光的持续照光, 类囊体囊腔内外离子浓度逐渐平衡, pmf达到最大值。活化光关闭后, 类囊体腔内积累的质子通过ATP合酶快速释放到基质, 囊腔酸化程度降低, NPQ逐渐衰减至最低水平, 表现为P515信号先迅速下降至最低点, 然后不断恢复至暗基线, 而叶绿素荧光产量Fm′不断恢复至最大荧光产量(Fm) (图5)。由于P515信号比较灵敏, 受外界环境影响较大, 测量时可能会出现错误的信号, 分析数据时需要更加仔细。
本文的其它图/表
|