禾本科三倍体: 形成、鉴定与利用
严旭, 左艳春, 王红林, 李杨, 李影正, 寇晶, 唐祈林, 周晓康, 杜周和
植物学报
2021, 56 ( 3):
372-387.
DOI: 10.11983/CBB20166
禾本科三倍体的形成途径包括2n配子融合、倍性间杂交、多精受精和胚乳培养。其中, 2n配子融合和倍性间杂交分别为自然界和人工合成三倍体的主要途径。该文介绍了形态学观测、染色体分析、流式细胞术和分子标记等倍性鉴定方法在禾本科三倍体中的应用及其优缺点。目前, 三倍体在禾谷类作物中无直接应用价值, 但可作为通往多倍体、非整倍体和转移异源基因的遗传桥梁。多年生禾本科三倍体(特别是异源三倍体)在饲草或能源作物中已得到广泛应用, 在该类型禾本科作物中均可直接尝试三倍体育种。多倍体的三倍体育种和无融合生殖三倍体育种可作为未来禾本科三倍体的研究方向。三倍性胚乳培养可以一步合成三倍体, 多精受精可以实现遗传上3个不同基因组的一步融合, 在三倍体研究中应予以重视。鉴于2n配子融合、多精受精的稀有特性和倍性间杂交、胚乳培养频繁的染色体变异, 高通量三倍体鉴定技术的发展将是三倍体研究实现突破的关键。
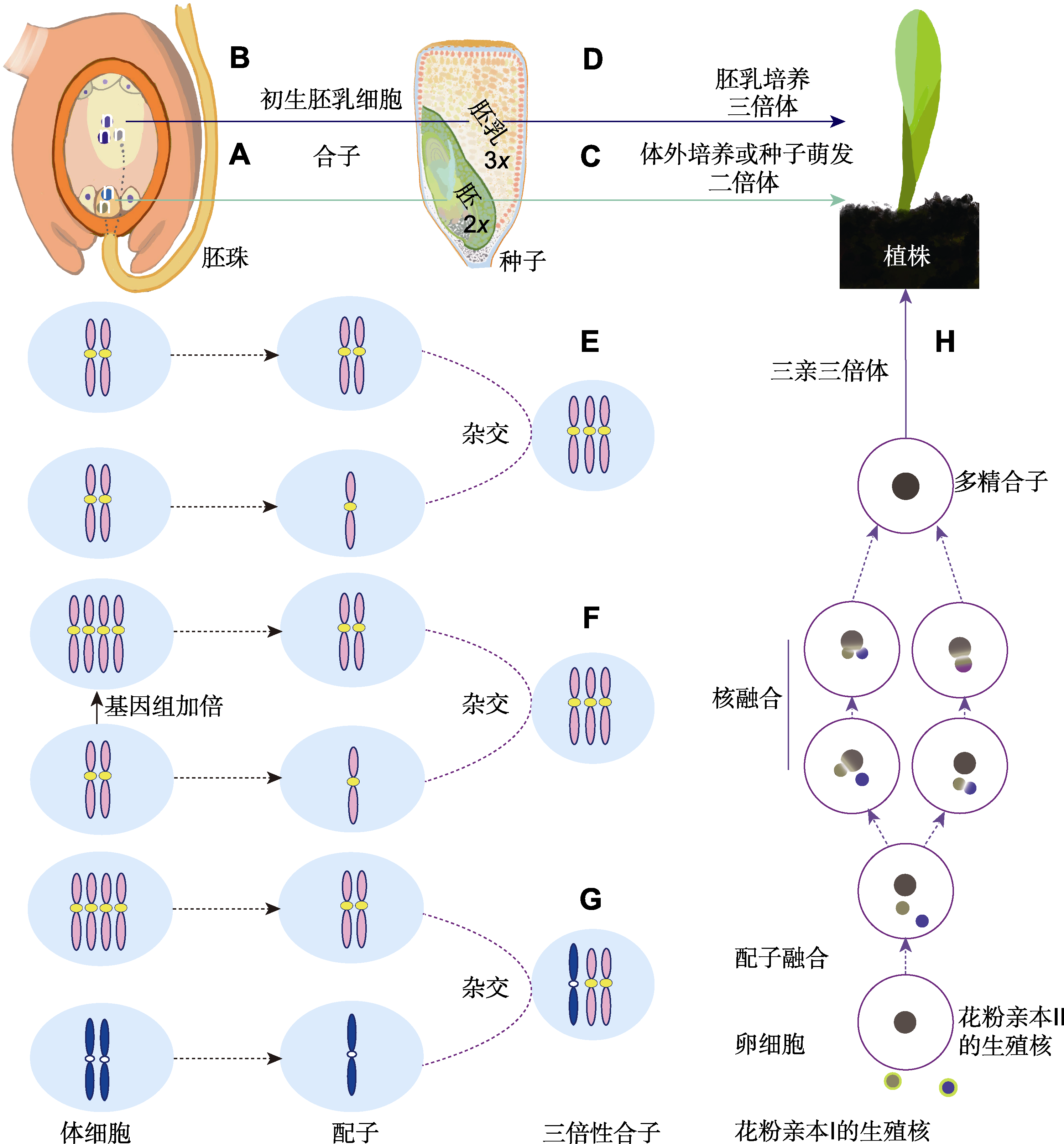
View image in article
图1
禾本科三倍体的形成途径
(A) 精细胞与卵细胞受精产生二倍性合子后发育成二倍体胚; (B) 精细胞与中央细胞受精产生三倍性初生胚乳细胞后发育成胚乳; (C) 通过离体培养胚或种子萌发发育成二倍体; (D) 通过胚乳组织培养形成三倍体; (E) 通过2n+n生殖方式形成三倍体; (F) 通过二倍体加倍后形成的同源四倍体(2n=4x=AAAA)与二倍体(2n=2x=AA)杂交合成同源三倍体; (G) 通过四倍体(2n=4x=AAAA)与二倍体(2n=2x=BB)杂交合成异源三倍体; (H) 通过多精受精形成三倍体
正文中引用本图/表的段落
禾本科通过花粉管伸长将雄配子体内的2个精细胞运送至胚囊; 1个精细胞与卵细胞融合形成合子, 合子是下一孢子体世代的祖细胞, 发育成胚(胚为植物幼态) (图1A); 1个精细胞与中央细胞融合形成初生胚乳细胞, 发育成胚乳(胚乳为胚的发育及种子萌发提供营养, 随后退化并消失) (图1B)。二倍体正常减数分裂产生单倍性的雌、雄配子通过n+n型生殖方式形成二倍体合子, 维持后代基因组的二倍性(图1A, C)。二倍体异常减数分裂产生的2n配子(与体细胞染色体数目相同)与单倍性配子(n)通过2n+n型生殖方式形成三倍体合子(图1E)。
人工合成三倍体常由4x/2x或2x/4x产生(Thomas and Chaturvedi, 2008) (图1F, G)。例如, 通过秋水仙碱加倍假俭草(Eremochloa ophiuroides, 2n=2x=18)种子形成的4x与2x杂交获得同源三倍体(Schwartz et al., 2013)。鸭茅2x/4x获得同源三倍体(钟声, 2006)。水稻与小粒野生稻(O. minuta, 2n=4x=48)杂交获得异源三倍体(张智奇等, 1994)。精细胞正常发育的二倍体常作为父本, 而四倍体(特别是人工合成四倍体)通常育性降低作母本。例如, 水稻4x/2x杂交结实率(0.42%-1.64%)高于其反交组合(0.20%-0.85%), 倍性间杂交同源三倍体成活率(0.07%)极低, 杂交后借助胚拯救可提升三倍体植株的成活率(0.78%) (黄群策和孙敬三, 1999)。在谷子(Setaria italica, 2n= 2x=18) 4x/2x的2 100个杂交后代中得到5株三倍体(发生率为0.24%), 反交未能获得三倍体(王润奇等, 1994)。特别地, 当前生产中应用的禾本科三倍体几乎全部源自倍性间杂交(表1)。此外, 高粱(Sorghum bicolor, 2n=2x=20)单倍体自交产生的三倍体可能源于减数分裂I期和II期中胞质不分裂产生2x配子与减数分裂I期不分裂、减数分裂II期正常分裂的x配子结合(Erichsen and Ross, 1963); 四倍体种间杂交F1代中1个基因组丢失也可形成三倍体(于卓等, 2004)。
卵细胞融合2个精细胞(n+n+n)形成三倍体合子(图1H), 称多精受精(polyspermy)。多精受精发生困难。为了阻止多精融合的风险, 动物通过多精障碍(polyspermy block)确保合子的二倍性: (1) 单精合子在精卵质膜融合阶段通过卵膜周围电位立即触发的正向移位或通过Ca2+依赖性皮质颗粒的胞吐作用在受精卵周围形成1个受精膜以阻止多余的精细胞入卵; (2) 生理多精(physiological polyspermy)在多精卵子中仅选择性融合1个精核, 剩余的精核退化或消失; (3) 多精合子致死或早期胚胎致死, 在动物中源自多个精子的额外中心体可产生多个微管组织中心(microtubule-organizing centers, MOCs), MOCs将引发异常的核分裂和细胞分裂, 导致合子或胚胎早期致死(Nakel et al., 2017)。被子植物拟南芥则通过FERONIA受体激酶确保合子的二倍性, 防止多余花粉管到达胚囊; 胚珠通过助细胞中的丝状器分泌诱导蛋白AtLURE1s吸引花粉管进入胚珠, 当1个花粉管穿过胚珠珠孔端的其中1个助细胞时, 丝状器上FERONIA受体激酶表达, 并与丝状器中去甲酯化果胶结合进而诱导产生NO; NO对AtLURE1s进行亚硝基化修饰后抑制AtLURE1s的分泌并造成其失活, 抑制其与受体的相互作用, 使其对后来花粉管的吸引能力急剧下降, 从而避免多管现象(polytubey), 最终阻止多精受精(Duan et al., 2020)。由于植物细胞缺乏中心体, 并且不将它们用作核分裂过程中染色体分离的纺锤体; 一旦多余花粉管到达胚珠, 在被子植物中形成的多精合子可能不会死亡。多精受精的鉴定困难, 利用传统的根尖压片技术无法区分三倍体由何种途径(n+n+n或2n+n)产生。因此, 有关兰花(Hagerup, 1947)、玉米(Rhoades, 1936)、高粱(Erichsen and Ross, 1963)和小麦(Suarez et al., 1992)的多精受精现象一直停留在理论推测, 缺乏直接的生物学证据。
近几年, 研究证实多精受精三倍体在水稻(Oryza sativa)和拟南芥中可以发生。Toda等(2016)及Toda和Okamoto (2016)使用处在泛素启动子控制下表达组蛋白H2B-GFP的精细胞作为观测对象, 利用水稻体外受精体系, 连续2次电融合, 成功合成了水稻多精合子; 2种多精受精途径(2个精核先后与卵核融合、2个精核融合后再与卵核融合)均被观测到(图1H); 多精合子的双极纺锤体行为正常, 当分化为原胚后经组织培养形成三倍体植株。Nakel等(2017)构建了高通量多精受精检测工具HIPOD, 该工具由mGAL4- VP16/pUAS25构成。花粉亲本1包含RPS5a启动子控制下的异源转录因子mGAL4-VP16, 但不含除草剂抗性的bar基因; 花粉亲本2仅包含bar基因, 无转录激活子, bar基因处于沉默状态。由单一花粉亲本产生的幼苗对除草剂敏感并在除草剂处理后死亡, 仅由花粉亲本1和2共存产生的2种构建体的植株才能避免除草剂的危害。拟南芥胚珠中偶尔会存在2个花粉管进入的现象, 这为多精受精创造了可能(Beale et al., 2012)。通过1个卵细胞与2个精细胞完成多精受精, 只需一步即可形成含有3个亲本的异源三倍体(Nakel et al., 2017)。多精合子发生的概率极低, 在拟南芥中发生率为0.012% (Nakel et al., 2017), 这导致多精受精鉴定和利用困难。从演化和育种的角度看, 植物多精受精诱导多倍体的意义在于3个遗传上不同基因组的一步融合。
在二倍体禾本科植物中, 2个极核(n+n)与精细胞(n)融合形成三倍性初级胚乳细胞(primary endosperm cell) (图1B), 随后发育为三倍体胚乳。若胚乳细胞具全能性, 可直接通过组织培养获得三倍体(图1D)。据报道, Lampe和Mills于1933年将玉米未成熟胚乳置于含有马铃薯和玉米提取物的培养基中, 观测到胚周围有少量胚乳细胞增殖(Thomas and Chaturvedi, 2008)。随后, 在玉米(La Rue, 1949)、多年生黑麦草(Lolium perenne) (Norstog, 1956)和多花黑麦草(L. multiflorum, 2n=2x=14) (Norstog et al., 1969)未成熟胚乳的离体培养中, 获得了可连续增殖的愈伤组织。Johri和Bhojwani (1965)将檀香科植物Exocarpus cupressiformis由成熟胚乳直接分化出三倍体茎芽。Nakano等(1975)从水稻未成熟胚乳中分化出植株, 证实了水稻胚乳细胞的全能性。之后, 在水稻中又重现了这一结果(Bajaj et al., 1980)。截至目前, 大麦(孙敬三和朱至清, 1981)、小麦(赵世绪等, 1984)、黑麦(Secale cereale, 2n=2x=14) (赵世绪等, 1984)、小麦-黑麦杂种(王敬驹等, 1982)、高粱(田立忠和徐爱菊, 2000)和毛竹(Phllostachys edulis, 2n=4x=48) (袁金玲等, 2015)等禾本科植物均通过胚乳培养分化出植株。
二倍体由2x/4x (或4x/2x)途径(图1F)获得三倍体需要跨越多重障碍。(1) 二倍体加倍为四倍体; (2) 四倍体能生殖生长且雌、雄配子至少一种部分可育; (3) 四倍体与二倍体花期相遇且杂交结实; (4) 三倍体种子萌芽、幼苗幸存。故此途径通常成功率低且周期较长。通过对已有胚乳培养成功案例的回顾, 经胚乳培养在特定物种可以获得三倍体, 并可缩短三倍体合成周期。因此, 当2x/4x (或4x/2x)途径合成三倍体无效时, 胚乳培养提供了一种可供尝试的新方法。
卵细胞融合2个精细胞(n+n+n)形成三倍体合子(图1H), 称多精受精(polyspermy).多精受精发生困难.为了阻止多精融合的风险, 动物通过多精障碍(polyspermy block)确保合子的二倍性: (1) 单精合子在精卵质膜融合阶段通过卵膜周围电位立即触发的正向移位或通过Ca2+依赖性皮质颗粒的胞吐作用在受精卵周围形成1个受精膜以阻止多余的精细胞入卵; (2) 生理多精(physiological polyspermy)在多精卵子中仅选择性融合1个精核, 剩余的精核退化或消失; (3) 多精合子致死或早期胚胎致死, 在动物中源自多个精子的额外中心体可产生多个微管组织中心(microtubule-organizing centers, MOCs), MOCs将引发异常的核分裂和细胞分裂, 导致合子或胚胎早期致死(Nakel et al., 2017).被子植物拟南芥则通过FERONIA受体激酶确保合子的二倍性, 防止多余花粉管到达胚囊; 胚珠通过助细胞中的丝状器分泌诱导蛋白AtLURE1s吸引花粉管进入胚珠, 当1个花粉管穿过胚珠珠孔端的其中1个助细胞时, 丝状器上FERONIA受体激酶表达, 并与丝状器中去甲酯化果胶结合进而诱导产生NO; NO对AtLURE1s进行亚硝基化修饰后抑制AtLURE1s的分泌并造成其失活, 抑制其与受体的相互作用, 使其对后来花粉管的吸引能力急剧下降, 从而避免多管现象(polytubey), 最终阻止多精受精(Duan et al., 2020).由于植物细胞缺乏中心体, 并且不将它们用作核分裂过程中染色体分离的纺锤体; 一旦多余花粉管到达胚珠, 在被子植物中形成的多精合子可能不会死亡.多精受精的鉴定困难, 利用传统的根尖压片技术无法区分三倍体由何种途径(n+n+n或2n+n)产生.因此, 有关兰花(Hagerup, 1947)、玉米(Rhoades, 1936)、高粱(Erichsen and Ross, 1963)和小麦(Suarez et al., 1992)的多精受精现象一直停留在理论推测, 缺乏直接的生物学证据. ...
卵细胞融合2个精细胞(n+n+n)形成三倍体合子(图1H), 称多精受精(polyspermy).多精受精发生困难.为了阻止多精融合的风险, 动物通过多精障碍(polyspermy block)确保合子的二倍性: (1) 单精合子在精卵质膜融合阶段通过卵膜周围电位立即触发的正向移位或通过Ca2+依赖性皮质颗粒的胞吐作用在受精卵周围形成1个受精膜以阻止多余的精细胞入卵; (2) 生理多精(physiological polyspermy)在多精卵子中仅选择性融合1个精核, 剩余的精核退化或消失; (3) 多精合子致死或早期胚胎致死, 在动物中源自多个精子的额外中心体可产生多个微管组织中心(microtubule-organizing centers, MOCs), MOCs将引发异常的核分裂和细胞分裂, 导致合子或胚胎早期致死(Nakel et al., 2017).被子植物拟南芥则通过FERONIA受体激酶确保合子的二倍性, 防止多余花粉管到达胚囊; 胚珠通过助细胞中的丝状器分泌诱导蛋白AtLURE1s吸引花粉管进入胚珠, 当1个花粉管穿过胚珠珠孔端的其中1个助细胞时, 丝状器上FERONIA受体激酶表达, 并与丝状器中去甲酯化果胶结合进而诱导产生NO; NO对AtLURE1s进行亚硝基化修饰后抑制AtLURE1s的分泌并造成其失活, 抑制其与受体的相互作用, 使其对后来花粉管的吸引能力急剧下降, 从而避免多管现象(polytubey), 最终阻止多精受精(Duan et al., 2020).由于植物细胞缺乏中心体, 并且不将它们用作核分裂过程中染色体分离的纺锤体; 一旦多余花粉管到达胚珠, 在被子植物中形成的多精合子可能不会死亡.多精受精的鉴定困难, 利用传统的根尖压片技术无法区分三倍体由何种途径(n+n+n或2n+n)产生.因此, 有关兰花(Hagerup, 1947)、玉米(Rhoades, 1936)、高粱(Erichsen and Ross, 1963)和小麦(Suarez et al., 1992)的多精受精现象一直停留在理论推测, 缺乏直接的生物学证据. ...
卵细胞融合2个精细胞(n+n+n)形成三倍体合子(图1H), 称多精受精(polyspermy).多精受精发生困难.为了阻止多精融合的风险, 动物通过多精障碍(polyspermy block)确保合子的二倍性: (1) 单精合子在精卵质膜融合阶段通过卵膜周围电位立即触发的正向移位或通过Ca2+依赖性皮质颗粒的胞吐作用在受精卵周围形成1个受精膜以阻止多余的精细胞入卵; (2) 生理多精(physiological polyspermy)在多精卵子中仅选择性融合1个精核, 剩余的精核退化或消失; (3) 多精合子致死或早期胚胎致死, 在动物中源自多个精子的额外中心体可产生多个微管组织中心(microtubule-organizing centers, MOCs), MOCs将引发异常的核分裂和细胞分裂, 导致合子或胚胎早期致死(Nakel et al., 2017).被子植物拟南芥则通过FERONIA受体激酶确保合子的二倍性, 防止多余花粉管到达胚囊; 胚珠通过助细胞中的丝状器分泌诱导蛋白AtLURE1s吸引花粉管进入胚珠, 当1个花粉管穿过胚珠珠孔端的其中1个助细胞时, 丝状器上FERONIA受体激酶表达, 并与丝状器中去甲酯化果胶结合进而诱导产生NO; NO对AtLURE1s进行亚硝基化修饰后抑制AtLURE1s的分泌并造成其失活, 抑制其与受体的相互作用, 使其对后来花粉管的吸引能力急剧下降, 从而避免多管现象(polytubey), 最终阻止多精受精(Duan et al., 2020).由于植物细胞缺乏中心体, 并且不将它们用作核分裂过程中染色体分离的纺锤体; 一旦多余花粉管到达胚珠, 在被子植物中形成的多精合子可能不会死亡.多精受精的鉴定困难, 利用传统的根尖压片技术无法区分三倍体由何种途径(n+n+n或2n+n)产生.因此, 有关兰花(Hagerup, 1947)、玉米(Rhoades, 1936)、高粱(Erichsen and Ross, 1963)和小麦(Suarez et al., 1992)的多精受精现象一直停留在理论推测, 缺乏直接的生物学证据. ...
卵细胞融合2个精细胞(n+n+n)形成三倍体合子(图1H), 称多精受精(polyspermy).多精受精发生困难.为了阻止多精融合的风险, 动物通过多精障碍(polyspermy block)确保合子的二倍性: (1) 单精合子在精卵质膜融合阶段通过卵膜周围电位立即触发的正向移位或通过Ca2+依赖性皮质颗粒的胞吐作用在受精卵周围形成1个受精膜以阻止多余的精细胞入卵; (2) 生理多精(physiological polyspermy)在多精卵子中仅选择性融合1个精核, 剩余的精核退化或消失; (3) 多精合子致死或早期胚胎致死, 在动物中源自多个精子的额外中心体可产生多个微管组织中心(microtubule-organizing centers, MOCs), MOCs将引发异常的核分裂和细胞分裂, 导致合子或胚胎早期致死(Nakel et al., 2017).被子植物拟南芥则通过FERONIA受体激酶确保合子的二倍性, 防止多余花粉管到达胚囊; 胚珠通过助细胞中的丝状器分泌诱导蛋白AtLURE1s吸引花粉管进入胚珠, 当1个花粉管穿过胚珠珠孔端的其中1个助细胞时, 丝状器上FERONIA受体激酶表达, 并与丝状器中去甲酯化果胶结合进而诱导产生NO; NO对AtLURE1s进行亚硝基化修饰后抑制AtLURE1s的分泌并造成其失活, 抑制其与受体的相互作用, 使其对后来花粉管的吸引能力急剧下降, 从而避免多管现象(polytubey), 最终阻止多精受精(Duan et al., 2020).由于植物细胞缺乏中心体, 并且不将它们用作核分裂过程中染色体分离的纺锤体; 一旦多余花粉管到达胚珠, 在被子植物中形成的多精合子可能不会死亡.多精受精的鉴定困难, 利用传统的根尖压片技术无法区分三倍体由何种途径(n+n+n或2n+n)产生.因此, 有关兰花(Hagerup, 1947)、玉米(Rhoades, 1936)、高粱(Erichsen and Ross, 1963)和小麦(Suarez et al., 1992)的多精受精现象一直停留在理论推测, 缺乏直接的生物学证据. ...
卵细胞融合2个精细胞(n+n+n)形成三倍体合子(图1H), 称多精受精(polyspermy).多精受精发生困难.为了阻止多精融合的风险, 动物通过多精障碍(polyspermy block)确保合子的二倍性: (1) 单精合子在精卵质膜融合阶段通过卵膜周围电位立即触发的正向移位或通过Ca2+依赖性皮质颗粒的胞吐作用在受精卵周围形成1个受精膜以阻止多余的精细胞入卵; (2) 生理多精(physiological polyspermy)在多精卵子中仅选择性融合1个精核, 剩余的精核退化或消失; (3) 多精合子致死或早期胚胎致死, 在动物中源自多个精子的额外中心体可产生多个微管组织中心(microtubule-organizing centers, MOCs), MOCs将引发异常的核分裂和细胞分裂, 导致合子或胚胎早期致死(Nakel et al., 2017).被子植物拟南芥则通过FERONIA受体激酶确保合子的二倍性, 防止多余花粉管到达胚囊; 胚珠通过助细胞中的丝状器分泌诱导蛋白AtLURE1s吸引花粉管进入胚珠, 当1个花粉管穿过胚珠珠孔端的其中1个助细胞时, 丝状器上FERONIA受体激酶表达, 并与丝状器中去甲酯化果胶结合进而诱导产生NO; NO对AtLURE1s进行亚硝基化修饰后抑制AtLURE1s的分泌并造成其失活, 抑制其与受体的相互作用, 使其对后来花粉管的吸引能力急剧下降, 从而避免多管现象(polytubey), 最终阻止多精受精(Duan et al., 2020).由于植物细胞缺乏中心体, 并且不将它们用作核分裂过程中染色体分离的纺锤体; 一旦多余花粉管到达胚珠, 在被子植物中形成的多精合子可能不会死亡.多精受精的鉴定困难, 利用传统的根尖压片技术无法区分三倍体由何种途径(n+n+n或2n+n)产生.因此, 有关兰花(Hagerup, 1947)、玉米(Rhoades, 1936)、高粱(Erichsen and Ross, 1963)和小麦(Suarez et al., 1992)的多精受精现象一直停留在理论推测, 缺乏直接的生物学证据. ... 大麦胚乳植株的诱导及其倍性 1 1981 ... 在二倍体禾本科植物中, 2个极核(n+n)与精细胞(n)融合形成三倍性初级胚乳细胞(primary endosperm cell) (图1B), 随后发育为三倍体胚乳.若胚乳细胞具全能性, 可直接通过组织培养获得三倍体(图1D).据报道, Lampe和Mills于1933年将玉米未成熟胚乳置于含有马铃薯和玉米提取物的培养基中, 观测到胚周围有少量胚乳细胞增殖(Thomas and Chaturvedi, 2008).随后, 在玉米(La Rue, 1949)、多年生黑麦草(Lolium perenne) (Norstog, 1956)和多花黑麦草(L. multiflorum, 2n=2x=14) (Norstog et al., 1969)未成熟胚乳的离体培养中, 获得了可连续增殖的愈伤组织.Johri和Bhojwani (1965)将檀香科植物Exocarpus cupressiformis由成熟胚乳直接分化出三倍体茎芽.Nakano等(1975)从水稻未成熟胚乳中分化出植株, 证实了水稻胚乳细胞的全能性.之后, 在水稻中又重现了这一结果(Bajaj et al., 1980).截至目前, 大麦(孙敬三和朱至清, 1981)、小麦(赵世绪等, 1984)、黑麦(Secale cereale, 2n=2x=14) (赵世绪等, 1984)、小麦-黑麦杂种(王敬驹等, 1982)、高粱(田立忠和徐爱菊, 2000)和毛竹(Phllostachys edulis, 2n=4x=48) (袁金玲等, 2015)等禾本科植物均通过胚乳培养分化出植株. ... 高粱(Sorghum bicolor (L.) Moench)未成熟胚乳培养的研究 1 2000 ... 在二倍体禾本科植物中, 2个极核(n+n)与精细胞(n)融合形成三倍性初级胚乳细胞(primary endosperm cell) (图1B), 随后发育为三倍体胚乳.若胚乳细胞具全能性, 可直接通过组织培养获得三倍体(图1D).据报道, Lampe和Mills于1933年将玉米未成熟胚乳置于含有马铃薯和玉米提取物的培养基中, 观测到胚周围有少量胚乳细胞增殖(Thomas and Chaturvedi, 2008).随后, 在玉米(La Rue, 1949)、多年生黑麦草(Lolium perenne) (Norstog, 1956)和多花黑麦草(L. multiflorum, 2n=2x=14) (Norstog et al., 1969)未成熟胚乳的离体培养中, 获得了可连续增殖的愈伤组织.Johri和Bhojwani (1965)将檀香科植物Exocarpus cupressiformis由成熟胚乳直接分化出三倍体茎芽.Nakano等(1975)从水稻未成熟胚乳中分化出植株, 证实了水稻胚乳细胞的全能性.之后, 在水稻中又重现了这一结果(Bajaj et al., 1980).截至目前, 大麦(孙敬三和朱至清, 1981)、小麦(赵世绪等, 1984)、黑麦(Secale cereale, 2n=2x=14) (赵世绪等, 1984)、小麦-黑麦杂种(王敬驹等, 1982)、高粱(田立忠和徐爱菊, 2000)和毛竹(Phllostachys edulis, 2n=4x=48) (袁金玲等, 2015)等禾本科植物均通过胚乳培养分化出植株. ... 小黑麦杂种胚乳的离体培养研究 3 1982 ... 在二倍体禾本科植物中, 2个极核(n+n)与精细胞(n)融合形成三倍性初级胚乳细胞(primary endosperm cell) (图1B), 随后发育为三倍体胚乳.若胚乳细胞具全能性, 可直接通过组织培养获得三倍体(图1D).据报道, Lampe和Mills于1933年将玉米未成熟胚乳置于含有马铃薯和玉米提取物的培养基中, 观测到胚周围有少量胚乳细胞增殖(Thomas and Chaturvedi, 2008).随后, 在玉米(La Rue, 1949)、多年生黑麦草(Lolium perenne) (Norstog, 1956)和多花黑麦草(L. multiflorum, 2n=2x=14) (Norstog et al., 1969)未成熟胚乳的离体培养中, 获得了可连续增殖的愈伤组织.Johri和Bhojwani (1965)将檀香科植物Exocarpus cupressiformis由成熟胚乳直接分化出三倍体茎芽.Nakano等(1975)从水稻未成熟胚乳中分化出植株, 证实了水稻胚乳细胞的全能性.之后, 在水稻中又重现了这一结果(Bajaj et al., 1980).截至目前, 大麦(孙敬三和朱至清, 1981)、小麦(赵世绪等, 1984)、黑麦(Secale cereale, 2n=2x=14) (赵世绪等, 1984)、小麦-黑麦杂种(王敬驹等, 1982)、高粱(田立忠和徐爱菊, 2000)和毛竹(Phllostachys edulis, 2n=4x=48) (袁金玲等, 2015)等禾本科植物均通过胚乳培养分化出植株. ...
卵细胞融合2个精细胞(n+n+n)形成三倍体合子(图1H), 称多精受精(polyspermy).多精受精发生困难.为了阻止多精融合的风险, 动物通过多精障碍(polyspermy block)确保合子的二倍性: (1) 单精合子在精卵质膜融合阶段通过卵膜周围电位立即触发的正向移位或通过Ca2+依赖性皮质颗粒的胞吐作用在受精卵周围形成1个受精膜以阻止多余的精细胞入卵; (2) 生理多精(physiological polyspermy)在多精卵子中仅选择性融合1个精核, 剩余的精核退化或消失; (3) 多精合子致死或早期胚胎致死, 在动物中源自多个精子的额外中心体可产生多个微管组织中心(microtubule-organizing centers, MOCs), MOCs将引发异常的核分裂和细胞分裂, 导致合子或胚胎早期致死(Nakel et al., 2017).被子植物拟南芥则通过FERONIA受体激酶确保合子的二倍性, 防止多余花粉管到达胚囊; 胚珠通过助细胞中的丝状器分泌诱导蛋白AtLURE1s吸引花粉管进入胚珠, 当1个花粉管穿过胚珠珠孔端的其中1个助细胞时, 丝状器上FERONIA受体激酶表达, 并与丝状器中去甲酯化果胶结合进而诱导产生NO; NO对AtLURE1s进行亚硝基化修饰后抑制AtLURE1s的分泌并造成其失活, 抑制其与受体的相互作用, 使其对后来花粉管的吸引能力急剧下降, 从而避免多管现象(polytubey), 最终阻止多精受精(Duan et al., 2020).由于植物细胞缺乏中心体, 并且不将它们用作核分裂过程中染色体分离的纺锤体; 一旦多余花粉管到达胚珠, 在被子植物中形成的多精合子可能不会死亡.多精受精的鉴定困难, 利用传统的根尖压片技术无法区分三倍体由何种途径(n+n+n或2n+n)产生.因此, 有关兰花(Hagerup, 1947)、玉米(Rhoades, 1936)、高粱(Erichsen and Ross, 1963)和小麦(Suarez et al., 1992)的多精受精现象一直停留在理论推测, 缺乏直接的生物学证据. ...
卵细胞融合2个精细胞(n+n+n)形成三倍体合子(图1H), 称多精受精(polyspermy).多精受精发生困难.为了阻止多精融合的风险, 动物通过多精障碍(polyspermy block)确保合子的二倍性: (1) 单精合子在精卵质膜融合阶段通过卵膜周围电位立即触发的正向移位或通过Ca2+依赖性皮质颗粒的胞吐作用在受精卵周围形成1个受精膜以阻止多余的精细胞入卵; (2) 生理多精(physiological polyspermy)在多精卵子中仅选择性融合1个精核, 剩余的精核退化或消失; (3) 多精合子致死或早期胚胎致死, 在动物中源自多个精子的额外中心体可产生多个微管组织中心(microtubule-organizing centers, MOCs), MOCs将引发异常的核分裂和细胞分裂, 导致合子或胚胎早期致死(Nakel et al., 2017).被子植物拟南芥则通过FERONIA受体激酶确保合子的二倍性, 防止多余花粉管到达胚囊; 胚珠通过助细胞中的丝状器分泌诱导蛋白AtLURE1s吸引花粉管进入胚珠, 当1个花粉管穿过胚珠珠孔端的其中1个助细胞时, 丝状器上FERONIA受体激酶表达, 并与丝状器中去甲酯化果胶结合进而诱导产生NO; NO对AtLURE1s进行亚硝基化修饰后抑制AtLURE1s的分泌并造成其失活, 抑制其与受体的相互作用, 使其对后来花粉管的吸引能力急剧下降, 从而避免多管现象(polytubey), 最终阻止多精受精(Duan et al., 2020).由于植物细胞缺乏中心体, 并且不将它们用作核分裂过程中染色体分离的纺锤体; 一旦多余花粉管到达胚珠, 在被子植物中形成的多精合子可能不会死亡.多精受精的鉴定困难, 利用传统的根尖压片技术无法区分三倍体由何种途径(n+n+n或2n+n)产生.因此, 有关兰花(Hagerup, 1947)、玉米(Rhoades, 1936)、高粱(Erichsen and Ross, 1963)和小麦(Suarez et al., 1992)的多精受精现象一直停留在理论推测, 缺乏直接的生物学证据. ... Pathways, mechanisms, and rates of polyploid formation in flowering plants 2 1998 ... 目前, 通过观测小孢子发生在植物中已发现5种2n配子形成机制(Loginova and Silkova, 2017) (图2).减数分裂II期姐妹染色单体分离形成的FDR (first division restitution)型2n配子(图2C)在很大程度上保留了亲本的杂合性, 而减数分裂II期姐妹染色单体不分离形成的SDR (second division restitution)型2n配子(图2D)高度纯合.因此, 在转移亲本杂合性方面FDR型比SDR型更为有利(Younis et al., 2014).Harlan和De Wet (1975)认为所有植物都以某种频率产生2n配子, 但物种间发生频率不同.二倍体水稻(Oryza sativa, 2n=2x=24)多胚苗能自发地产生三倍体(张静等, 2002).在二倍体看麦娘(Alopecurus bulbosus, 2n=2x=14)自然群体中, 二倍体、三倍体与四倍体并存(Sieber and Murray, 1979).在22个二倍体大麦(Hordeum vulgare, 2n=2x=14)品种中, 三倍体植株的发生率为0.01%-0.29% (Sandfaer, 1975).在黄花茅(Anthoxanthum alpinum, 2n=2x=10)中2n配子的发生率为6.3% (Bretagnolle, 2001).对十字花科24个物种60个群体的研究表明, 尽管2n配子先前被认为相对罕见、但普遍发生(通常个体的雄配子2n发生率<2%), 并且在特定个体中较高, 这些极少数产生高频率2n配子的个体可能在多倍体的形成中发挥关键作用(Kreiner et al., 2017).在同一植物中, 雌雄2n配子的发生率也不一致(Ramsey and Schemske, 1998).鸭茅(Dactylis glomerata, 2n=2x=14) 2n雌配子发生率为0.49%, 而2n雄配子发生率为0.98% (Maceira et al.,1992).鉴于2n配子发生率低, 在2x/2x下通过单向有性多倍化(unilateral sexual polyploidization, 2x+x)形成三倍体的频率远高于通过双向有性多倍化(bilateral sexual polyploidization, 2x+2x)形成四倍体的频率.例如, 在黄花茅中2n配子形成三倍体的发生率为0.2%, 但未见四倍体发生(Bretagnolle, 2001). ...
卵细胞融合2个精细胞(n+n+n)形成三倍体合子(图1H), 称多精受精(polyspermy).多精受精发生困难.为了阻止多精融合的风险, 动物通过多精障碍(polyspermy block)确保合子的二倍性: (1) 单精合子在精卵质膜融合阶段通过卵膜周围电位立即触发的正向移位或通过Ca2+依赖性皮质颗粒的胞吐作用在受精卵周围形成1个受精膜以阻止多余的精细胞入卵; (2) 生理多精(physiological polyspermy)在多精卵子中仅选择性融合1个精核, 剩余的精核退化或消失; (3) 多精合子致死或早期胚胎致死, 在动物中源自多个精子的额外中心体可产生多个微管组织中心(microtubule-organizing centers, MOCs), MOCs将引发异常的核分裂和细胞分裂, 导致合子或胚胎早期致死(Nakel et al., 2017).被子植物拟南芥则通过FERONIA受体激酶确保合子的二倍性, 防止多余花粉管到达胚囊; 胚珠通过助细胞中的丝状器分泌诱导蛋白AtLURE1s吸引花粉管进入胚珠, 当1个花粉管穿过胚珠珠孔端的其中1个助细胞时, 丝状器上FERONIA受体激酶表达, 并与丝状器中去甲酯化果胶结合进而诱导产生NO; NO对AtLURE1s进行亚硝基化修饰后抑制AtLURE1s的分泌并造成其失活, 抑制其与受体的相互作用, 使其对后来花粉管的吸引能力急剧下降, 从而避免多管现象(polytubey), 最终阻止多精受精(Duan et al., 2020).由于植物细胞缺乏中心体, 并且不将它们用作核分裂过程中染色体分离的纺锤体; 一旦多余花粉管到达胚珠, 在被子植物中形成的多精合子可能不会死亡.多精受精的鉴定困难, 利用传统的根尖压片技术无法区分三倍体由何种途径(n+n+n或2n+n)产生.因此, 有关兰花(Hagerup, 1947)、玉米(Rhoades, 1936)、高粱(Erichsen and Ross, 1963)和小麦(Suarez et al., 1992)的多精受精现象一直停留在理论推测, 缺乏直接的生物学证据. ...
本文的其它图/表
-
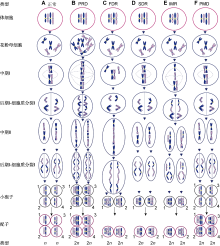 图2
2n配子的形成机制
图2
2n配子的形成机制
(A) 与体细胞相比正常配子的染色体数目减半; (B) 通过胞质融合或多核体形成的四倍体花粉母细胞产生PRD型2n配子, 如鸭茅(Falistocco et al., 1995); (C) 在减数分裂I期同源染色体无配对和分裂形成的FDR型2n配子将保留除重组片段外的所有亲本基因, 如雀稗(Filho et al., 2014)和多年生黑麦草(Chen et al., 1997); (D) 在减数分裂II期因分裂缺失形成的SDR型2n配子将保留除重组片段外比正常配子多1套染色体副本的2n配子, 如多年生黑麦草(Chen et al., 1997); (E) 在减数分裂I期部分染色体以姐妹染色单体分离, 其余以二价体分离, 随后在减数分裂II期分裂缺失形成IMR型2n配子, 如百合(Lim et al., 2001); (F) 减数分裂正常而进入配子体发育阶段时基因组加倍形成PMD型2n配子, 如马铃薯(Bastiaanssen et al., 1998)
-
 表1
禾本科三倍体品种
表1
禾本科三倍体品种
-
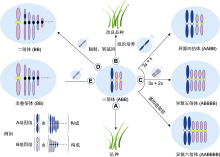 图3
禾本科三倍体的利用
图3
禾本科三倍体的利用
(A) 三倍体作为品种直接利用; (B) 通过辐射、转基因或组织培养等技术改良三倍体品种; (C) 作为通往更高倍性的“三倍体桥”; (D) 转移异源基因; (E) 通过3x/2x合成非整倍体
|

