

植物学报 ›› 2019, Vol. 54 ›› Issue (4): 515-521.DOI: 10.11983/CBB18257 cstr: 32102.14.CBB18257
徐悦1,曹英萍2,王玉2,付春祥2,*( ),戴绍军1,3,*(
),戴绍军1,3,*( )
)
收稿日期:2018-11-30
接受日期:2019-04-08
出版日期:2019-07-01
发布日期:2020-01-08
通讯作者:
付春祥,戴绍军
基金资助:
Yue Xu1,Yingping Cao2,Yu Wang2,Chunxiang Fu2,*( ),Shaojun Dai1,3,*(
),Shaojun Dai1,3,*( )
)
Received:2018-11-30
Accepted:2019-04-08
Online:2019-07-01
Published:2020-01-08
Contact:
Chunxiang Fu,Shaojun Dai
摘要: 发根农杆菌(Agrobacterium rhizogenes)侵染植物后可诱导植物产生毛状根。菠菜(Spinacia oleracea)是常见的食用蔬菜, 目前尚未见菠菜毛状根的研究报道。经筛选得到适合诱导菠菜毛状根的发根农杆菌菌株LBA9402, LBA9402侵染菠菜外植体茎后, 毛状根的诱导率最高可达16%。菠菜毛状根呈白色, 具有丰富的根毛, 能在无外源激素的固体培养基上快速增殖生长。通过诱导菠菜毛状根产生愈伤组织并进行分化, 获得了菠菜毛状根的再生植株, 再生率为8%。此外, LBA9402可将含有Ri质粒的T-DNA和携带外源GFP基因的Ti质粒T-DNA共同导入外植体中。PCR检测和荧光显微观察结果显示, rolB及GFP基因在菠菜毛状根基因组中稳定表达, 共转化频率为50%。
徐悦,曹英萍,王玉,付春祥,戴绍军. 发根农杆菌介导的菠菜毛状根遗传转化体系的建立. 植物学报, 2019, 54(4): 515-521.
Yue Xu,Yingping Cao,Yu Wang,Chunxiang Fu,Shaojun Dai. Agrobacterium rhizogenes-mediated Transformation System of Spinacia oleracea. Chinese Bulletin of Botany, 2019, 54(4): 515-521.
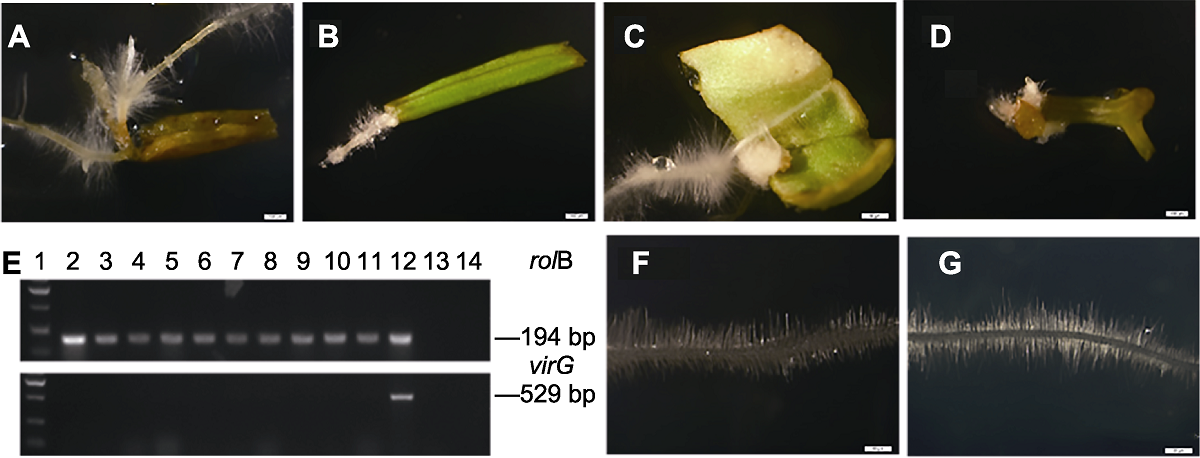
图3 菠菜毛状根诱导及其形态特点 (A) 发根农杆菌(LBA9402)侵染之后在1个位点产生多条毛状根; (B) 叶柄维管束部位产生的毛状根; (C) 菠菜叶脉部位产生的毛状根; (D) 茎的维管束部位产生的毛状根; (E) PCR分析毛状根中rolB (上)和VirG (下)基因(1: 2 kb DNA marker; 2-11: 不同毛状根再生植株; 12: LBA9402; 13: 非转化对照根; 14: 去离子水); (F) LBA9402诱导产生的毛状根; (G) 野生型根。(A)-(D), (F), (G) Bars=20 μm
Figure 3 The induction and morphological characteristics of spinach hairy roots (A) After Agrobacterium rhizogenes LBA9402 infection, multiple hairy roots were produced at one site; (B) The induction of hairy roots around the vascular bundle of the petiole; (C) The induction of hairy roots in veins; (D) The induction of hairy roots around the vascular bundle of stem; (E) Genomic PCR analysis of rolB (up) and virG (down) genes in hairy roots (Lane 1: 2 kb DNA marker; Lane 2-11: Different hairy roots plantlets; Lane 12: LBA9402; Lane 13: Untransformed roots; Lane 14: Mili Q water); (F) The hairy root induced by LBA9402; (G) The wild type root. (A)-(D), (F), (G) Bars=20 μm
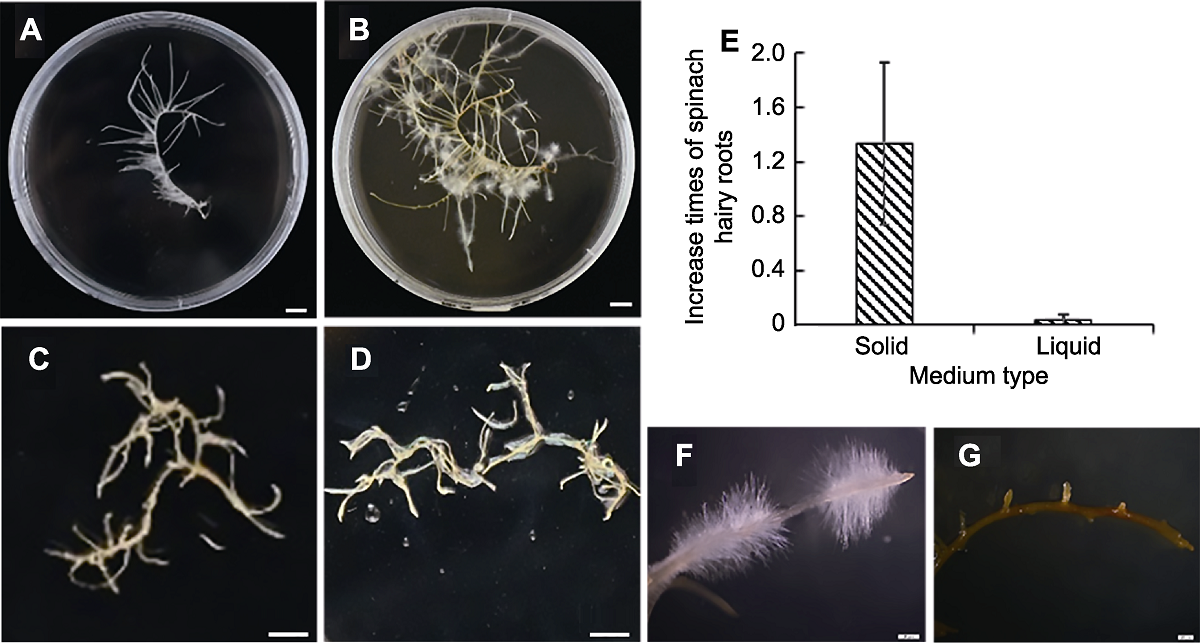
图4 在液体和固体培养基上培养的菠菜毛状根的形态特征 (A) 接种于固体培养基0天的毛状根; (B), (F) 接种于固体培养基14天的毛状根; (C) 接种于液体培养基0天的毛状根; (D), (G) 接种于液体培养基14天的毛状根; (E) 毛状根鲜重在2种培养基中的增长倍数。(A)-(D) Bars=8 cm; (F), (G) Bars=20 μm
Figure 4 The morphological characterization of spinach hairy roots grown on solid medium and in liquid medium (A) Hairy roots grown on solid medium in 0 day after inoculation; (B), (F) Hairy roots grown on solid medium in 14 days after inoculation; (C) Hairy roots grown in liquid medium in 0 day after inoculation; (D), (G) Hairy roots grown in liquid medium in 14 days after inoculation; (E) Increase times of spinach hairy roots fresh weight on solid medium and in liquid medium, respectively. (A)-(D) Bars=8 cm; (F), (G) Bars=20 μm

图5 菠菜毛状根再生体系 (A) 毛状根在愈伤诱导培养基上产生愈伤组织; (B) 毛状根诱导的愈伤组织在分化培养基中生长并产生不定芽; (C) 毛状根经由愈伤组织诱导分化产生再生植株; (D) 野生型种子萌发的植株; (E) PCR检测rolB (上)和VirG (下)基因(1: 2 kb DNA marker; 2-4: 不同毛状根再生株系; 5: LBA9402; 6: 野生型; 7: 去离子水)。(A)-(D) Bars=4 cm
Figure 5 Regeneration system of spinach hairy roots (A) Calli produced from hairy roots on callus induction medium; (B) Calli induced from hairy roots and produced adventitious buds on the regeneration medium; (C) The plantlets regenerated from the calli produced from hairy roots; (D) The wild type plantlets; (E) Genomic PCR analysis of rolB (up) and virG (down) genes in the plantlets regenerated from the calli produced from hairy roots (Lane 1: 2 kb DNA marker; Lane 2-4: Different hairy roots plantlets regenerated from the calli produced; Lane 5: LBA9402; Lane 6: The wild type plantlets; Lane 7: Mili Q water). (A)-(D) Bars=4 cm
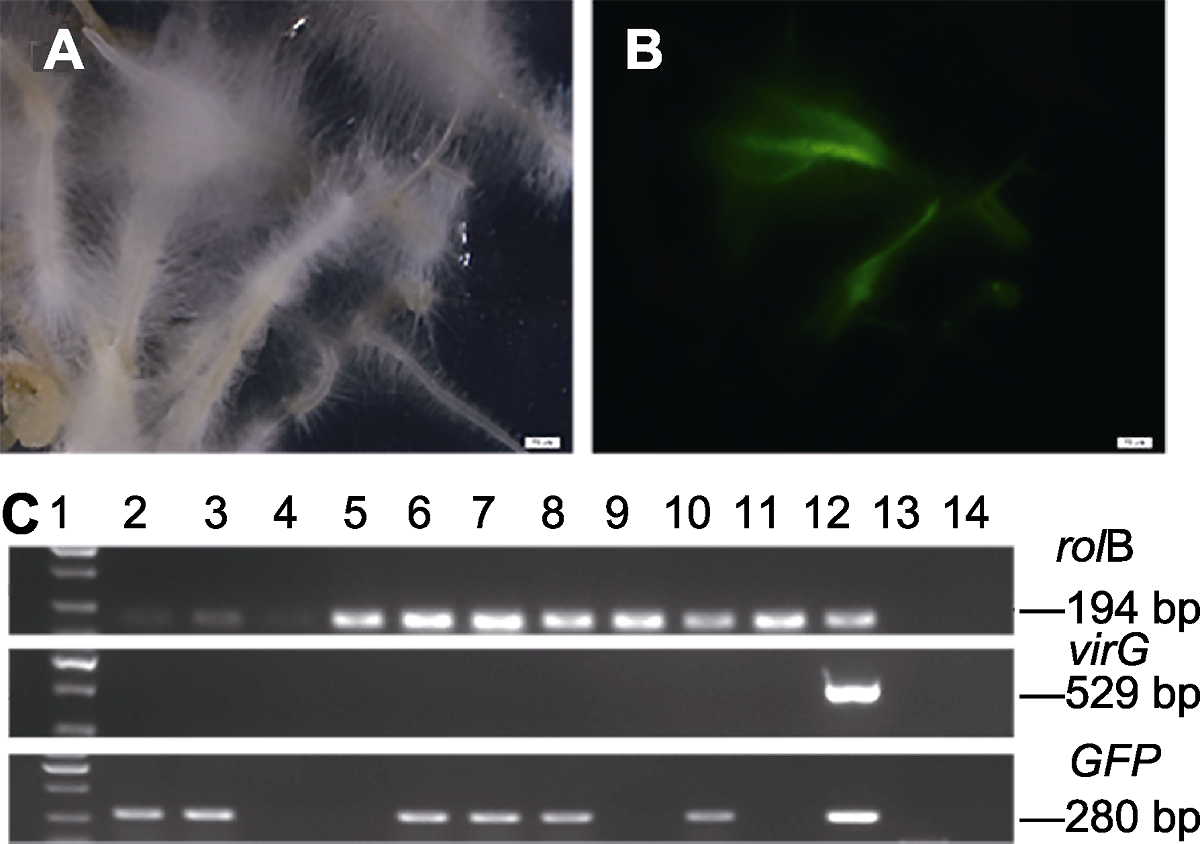
图6 菠菜毛状根rolB基因和GFP基因的PCR检测和荧光观察 (A) 在自然光下的转基因毛状根; (B) 在蓝色激发光下观察的转基因毛状根; (C) PCR检测转rolB (上)、VirG (中)和GFP (下)基因(1: 2 kb DNA marker; 2-11: 不同转基因毛状根株系; 12: LBA9402; 13: 野生型根; 14: 去离子水)。(A), (B) Bars=20 μm
Figure 6 PCR analysis and GFP green fluorescence assay of the rolB gene and GFP gene in spinach transgenic hairy roots (A) Transgenic hairy root under the natural light; (B) Transgenic hairy root under the blue exciting light; (C) Genomic PCR analysis of rolB (up) and virG (middle) and GFP (down) genes in transgenic hairy roots (Lane 1: 2 kb DNA marker; Lane 2-11: Different of transgenic hairy roots lines; Lane 12: LBA9402 (GFP); Lane 13: The wild type root; Lane 14: Milli Q water). (A), (B) Bars=20 μm
| [1] | 付春祥 ( 2006). 雪莲细胞培养物中黄酮类物质代谢调控及其生物活性成分分析. 博士论文. 北京: 中国科学院植物研究所. pp. 28-45. |
| [2] | 付春祥, 金治平, 杨睿, 吴风燕, 赵德修 ( 2004). 新疆雪莲毛状根的诱导及其植株再生体系的建立. 生物工程学报 20, 366-371. |
| [3] | 耿晓霞 ( 2009). 菠菜叶绿体表达载体构建及遗传转化. 硕士论文. 济南: 山东大学. pp. 57-59. |
| [4] | 胡凤, 杨万年 ( 2013). 大豆组培苗水培生根与培养基生根比较研究. 大豆科学 32, 333-335. |
| [5] | 晋四清 ( 2013). 菠菜露地越冬杂交制种技术. 乡村科技 ( 10), 20. |
| [6] | 钱伟, 张合龙, 刘伟, 徐兆生 ( 2014). 菠菜遗传育种研究进展. 中国蔬菜 1(3), 5-13. |
| [7] | 任如意, 薛巨坤, 国会艳, 魏继承 ( 2017). 北玄参毛状根诱导及其植株再生. 植物学报 52, 783-787. |
| [8] | 施和平, 王蓓, 杨树楠, 郭亚鹏 ( 2016). 五寸石竹毛状根诱导及其植株再生. 植物学报 51, 363-368. |
| [9] | 孙晶, 徐洁森, 赵立子, 魏建和, 杨洪一, 隋春 ( 2013). 北柴胡毛状根诱导及其植株再生体系的建立. 药学学报 48, 1491-1497. |
| [10] | 孙敏, 汪洪, 王颖, 伍春莲 ( 2002). 长春花转化毛状根诱导及培养条件的优化. 西南师范大学学报(自然科学版) 27, 549-552. |
| [11] | 王晓武, 杜永臣 ( 2007). 蔬菜作物分子育种研究现状与趋势. 中国农业科技导报 9(2), 14-18. |
| [12] | 闻玉莉, 杨世海 ( 2010). 罗勒毛状根的诱导及培养. 安徽农业科学 38, 1727-1730. |
| [13] | Akhgari A, Yrjönen T, Laakso I, Vuorela H, Oksman- Caldentey KM, Rischer H ( 2015). Establishment of transgenic Rhazya stricta hairy roots to modulate terpenoid indole alkaloid production. Plant Cell Rep 34, 1939-1952. |
| [14] | Hu Z, Du M ( 2006). Hairy root and its application in plant genetic engineering. J Integr Plant Biol 48, 121-127. |
| [15] | Porter JR, Flores H ( 1991). Host range and implication of plant infection by Agrobacterium rhizogenes. CRC Crit Rev Plant Sci 10, 387-421. |
| [16] | Ron M, Kajala K, Pauluzzi G ( 2014). Hairy root transformation using Agrobacterium rhizogenes as a tool for exploring cell type-specific gene expression and function using tomato as a model. Plant Physiol 166, 455-469. |
| [17] | Sharafi A, Hashemi Sohi H, Mousavi A, Azadi P, Razavi K, Ntui VO ( 2013). A reliable and efficient protocol for inducing hairy roots in Papaver bracteatum. Plant Cell Tissue Organ Cult 113, 1-9. |
| [18] | Veena V, Taylor GG ( 2007). Agrobacterium rhizogenes: recent developments and promising applications. In Vitro Cell Dev Biol Plant 43, 384-403. |
| [19] | Xu C, Jiao C, Sun H, Cai X, Wang X, Ge C, Zheng Y, Liu W, Sun X, Xu Y, Deng J, Zhang Z, Huang S, Dai S, Mou B, Wang Q, Fei Z, Wang Q ( 2017). Draft genome of spinach and transcriptome diversity of 120 Spinacia accessions. Nat Commun 8, 15275. |
| [20] | Zhang HX, Zeevaart JAD ( 1999). An efficient Agrobacterium tumefaciens-mediated transformation and regeneration system for cotyledons of spinach( Spinacia oleracea L.). Plant Cell Rep 18, 640-645. |
| [21] | Zhao Q, Chen W, Bian J, Xie H, Li Y, Xu C, Ma J, Guo S, Chen J, Cai X, Wang X, Wang Q, She Y, Chen S ( 2018). Proteomics and phosphoproteomics of heat stress-responsive mechanisms in spinach. Front Plant Sci 9, 800. |
| [1] | 杨莉, 曲茜彤, 陈子航, 邹婷婷, 王全华, 王小丽. 菠菜AT-hook基因家族鉴定与表达谱分析[J]. 植物学报, 2025, 60(3): 377-392. |
| [2] | 曾文丹, 严华兵, 吴正丹, 尚小红, 曹升, 陆柳英, 肖亮, 施平丽, 程冬, 龙紫媛, 李婕宇. 发根农杆菌介导的野葛毛状根遗传转化体系[J]. 植物学报, 2025, 60(3): 425-434. |
| [3] | 陈佳欣, 梅浩, 黄彩翔, 梁宗原, 全依桐, 李东鹏, 布威麦尔耶姆·赛麦提, 李欣欣, 廖红. 利用转基因毛状根高效培育大豆嵌合植株的方法[J]. 植物学报, 2024, 59(1): 89-98. |
| [4] | 任如意, 薛巨坤, 国会艳, 魏继承. 北玄参毛状根诱导及其植株再生[J]. 植物学报, 2017, 52(6): 783-787. |
| [5] | 王大鹏, 唐嘉泽, 邵明成, 张文彪, 王华芳. 胡杨组织培养叶片及插穗毛状根发生[J]. 植物学报, 2017, 52(2): 210-217. |
| [6] | 樊大勇, 付增娟, 谢宗强, 李荣贵, 张淑敏. 调制式荧光影像新技术: 叶片内部最大光化学量子效率及其异质性的活体测定[J]. 植物生态学报, 2016, 40(9): 942-951. |
| [7] | 施西子, 郭亚鹏, 施和平. 多效唑(PP333)对美洲商陆毛状根生长和商陆皂苷甲产生的影响[J]. 植物学报, 2016, 51(6): 801-806. |
| [8] | 施和平, 王蓓, 杨树楠, 郭亚鹏. 五寸石竹毛状根诱导及其植株再生[J]. 植物学报, 2016, 51(3): 363-368. |
| [9] | 郭晋雅 董宇亮 杨净 徐杰 尹汗萍 曾秋莲. 植物乙醇酸氧化酶分离纯化方法的改进[J]. 植物学报, 2006, 23(6): 703-707. |
| [10] | 王英娟 步怀宇 李多伟 贾敬芬. 烟草毛状根诱导及其茄尼醇含量初探[J]. 植物学报, 2006, 23(4): 334-340. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||