基因编辑技术在玉米中的研究进展
张强, 赵振宇, 李平华
植物学报
2024, 59 ( 6):
978-998.
DOI: 10.11983/CBB24080
基因编辑技术已成为现代农业育种领域的重要工具。玉米(Zea mays)是全球最重要的粮食作物之一, 基因编辑技术在玉米中的应用显示出巨大的潜力。该文综述了基因编辑技术在玉米研究中的应用进展, 重点介绍了CRISPR/Cas等系统在玉米基因组编辑中的最新成果。首先, 介绍了基因编辑技术的基本原理和类型, 特别是CRISPR/Cas系统的工作机制及其在玉米中的应用优势。其次, 总结了基因编辑技术在玉米育种中的研究进展, 涵盖从基础的基因组编辑到复杂的多基因编辑, 旨在改良玉米的产量、品质和抗逆性等关键性状。最后, 文章列举了我国在玉米基因编辑方面的杰出工作, 并讨论了基因编辑技术应用于玉米育种中存在的问题, 同时展望了未来发展方向。
| 应用 | 靶标基因 | 基因功能 | 性状改良 | 参考文献 | | 单倍体诱导 | ZmPLA1 | 编码特异性磷脂酶 | 单倍体诱导 | Dong et al., 2018 | | ZmDMP | 单倍体诱导 | 单倍体诱导 | Liu et al., 2017 | | CENH3 | 单倍体诱导 | 单倍体诱导 | Wang et al., 2021a | | 雄性不育 | MS45 | 编码异胡豆苷合成酶类似蛋白 | 花粉发育异常, 雄性不育 | Svitashev et al., 2015 | | MS8 | 编码β-1,3-半乳糖基转移酶 | 花粉发育异常, 雄性不育 | Chen et al., 2018 | | ZmABCG2和ZmFAR1 | 角质层减少和蜡质含量增加 | 花粉发育异常, 雄性不育 | Jiang et al., 2021 | | ZmTMS5 | 编码RNase Z蛋白 | 温敏雄性不育植株 | Li et al., 2017b | | Dcl5 | 产生多样化的24 nt phasiRNAs | 温敏雄性不育植株 | Teng et al., 2020 | | 株型 | CLE7和FCP1 | 控制分生组织大小 | 果穗行数和籽粒产量增加,
果穗变大, 叶夹角减小 | Liu et al., 2021 | | ZmLg1 | 编码调控SBP结构域蛋白 | 叶夹角减小, 种植密度增大 | Li et al., 2017a | | SAMBA | 影响有丝分裂期推进复合体 | 节间缩短, 上部叶片缩小、直
立, 叶片整体缩小 | Gong et al., 2022 | | ZmRAVL1 | 影响油菜素内酯信号通路 | 叶夹角变小 | 刘杰和严建兵, 2019 | | 激素 | GA20ox3 | 赤霉素合成 | 半矮生 | Zhang et al., 2020a | | ZmACO2 | 乙烯合成 | 促进花序和花发育, 增加穗重 | Ning et al., 2021 | | ZmCEP1 | 肽激素合成 | 降低植株和穗高度、穗长、籽
粒大小和百粒重 | Xu et al., 2021 | | CKX | 细胞分裂素氧化酶合成 | 细胞分裂和植物器官的形成 | 刘超等, 2020 | | 果穗 | Zm079、Zm080和Zm081 | 调控百粒重 | 增加穗重、穗长和穗粗 | 穆路遥, 2022 | | 光合作用 | Zmcst1 | 影响气孔开放和光合作用 | 叶片提前衰老 | Wang et al., 2019a | | qkw9 | 光合作用减弱 | 为籽粒充实提供的母体光合产
物减少 | Huang et al., 2020 | | ZmSWEET13 | 光合作用受损 | 叶片中可溶性糖和淀粉含量
增加 | Bezrutczyk et al., 2018 | | ANT1 | 光合作用受损 | 相互遮荫 | Liu et al., 2020 | | Zmpif3、Zmpif4和Zmpif5 | 调控光信号和光形态发生 | 减弱植株对遮荫环境的响应 | Wu et al., 2019 | 香味
| ZmBADH2a和mBADH2b | 控制2-乙酰基-1-吡咯烷酮合成 | 挥发物含量增加, 香气增加 | Wang et al., 2021b; 张翔等, 2021; 王彦晓, 2021 | | 甜味 | Zmsh2 | 编码AGPase酶 | 甜玉米 | Dong et al., 2019; 祁显涛, 2019 | | 糯性 | SH2和WX | 编码AGPase酶和GBSS酶 | 甜玉米和糯玉米 | Gao et al., 2020; Qi et al., 2020 | | 抗倒伏 | ZmWx1 | 编码GBSS酶 | 纤维素和木质素含量增加 | Li et al., 2020 | | stiff1 | 控制纤维素和木质素含量 | 秸秆强度增加 | Zhang et al., 2020b | | qpa1 | 半矮化 | 株高和穗位降低, 茎粗增加, 叶片更直立 | Wei et al., 2018 | | ZmPHYCs | 减弱避荫综合症 | 降低植株高度和穗位高度 | Li et al., 2020 | | 干旱 | ARGOS8 | 乙烯响应负调控因子 | 提高耐旱能力 | Shi et al., 2017 | | ZmHDT103 | 编码乙酰化酶 | 提高耐旱能力 | Wang et al., 2024 | | ZmSRL5 | 编码CALSP蛋白 | 提高耐旱能力 | Pan et al., 2020 | | 抗除草剂 | ZmEPSPS | 抑制叶绿体中5-烯醇丙酮酰莽
草酸-3-磷酸合酶的作用 | 抗除草剂 | Kaul et al., 2024 | | ALS2 | 编码乙酰乳酸合成酶 | 抗除草剂 | Svitashev et al., 2015, 2016; Li et al., 2020; Jiang et al., 2020 | | 病原侵染 | ZmLox3 | 编码脂肪氧化酶 | 抗黑粉菌 | Pathi et al., 2020 | | ZmGDlα | 编码RabGDP解离抑制因子 | 抗粗缩病 | Liu et al., 2022 | | ZmCOI1a和ZmJAZ15 | 茉莉酸合成 | 抗茎腐病 | Ma et al., 2021 | | ZmFBL41 | E3泛素连接酶复合体的成员之一 | 抗纹枯病 | 李伟滔等, 2019 |
View table in article
表2
基因编辑技术在玉米改良中的应用
正文中引用本图/表的段落
基因编辑技术的发展为玉米育种带来了划时代的变革。通过精准地编辑玉米基因组, 能够培育出产量更高、抗逆性更强且营养更丰富的玉米新品种(何晓玲等, 2022)。基因编辑技术不仅极大地缩短了玉米的育种周期, 降低了研发成本, 而且能够在维持玉米遗传优势的基础上, 精确地改良其特定性状。基因编辑技术的应用为玉米产业的可持续发展注入了新活力, 为全球粮食安全提供了有力保障。下文将系统总结CRISPR/Cas9技术在玉米多个关键领域的应用, 包括增加产量、优化品质、增强生物与非生物胁迫抗性以及在不育系创制和单倍体诱导等方面的应用进展(表2)。
在自然条件下, 大多数植物(如玉米)表现为二倍体, 即每个细胞含有2套染色体。为培育出遗传上纯合的系谱, 研究人员通过多代连续自交以确保后代基因的纯合性。而单倍体诱导技术提供了一种更为高效的方法。该技术通过特定的双单倍体(DH)途径, 诱导植物产生仅含1套染色体的细胞, 进而发育成单倍体植株。随后, 利用染色体加倍技术, 将单倍体植株转化为遗传稳定的二倍体植株, 极大地缩短了培育纯合谱系的时间(Ren et al., 2017)。基于CRISPR/Cas9技术对玉米中的花粉特异性磷脂酶基因ZmPLA1进行精确编辑, Dong等(2018)成功开发出高效的孤雌生殖单倍体诱导体系; 他们还融入一个组织特异性表达的双荧光蛋白标记系统, 显著优化了单倍体的鉴别和筛选流程, 极大地提高了筛选效率, 并为作物改良中双单倍体育种技术的应用确立了新标准。Stock6 (可诱导产生单倍体的玉米突变体)作为玉米单倍体诱导育种的关键工具, 可通过杂交诱发孤雌生殖, 即使花粉与雌蕊接触, 也不形成正常的双倍体合子, 而是直接形成单倍体种子, 随后通过化学处理或温度震荡等手段进行染色体加倍, 进而形成遗传上纯合的双单倍体植株。Liu等(2017)利用CRISPR/Cas9技术对玉米ZmPLA1基因第1外显子进行精确编辑, 导致特定的缺失突变。编辑后的突变体平均单倍体诱导率约为2%, 与Stock6的诱导效率相似。该研究团队进一步采用CRISPR/Cas9技术敲除ZmDMP基因后, 观察到该基因缺失单倍体诱导率提高5-6倍。这是首次在非Stock6背景下观察到的独立单倍体诱导现象, 展现出基因编辑技术在提高单倍体诱导率方面的巨大应用潜力。通过将CRISPR/Cas9基因编辑技术与传统单倍体诱导策略相结合, 创制了单倍体诱导编辑(haploid-induction editing, HI-Edit)策略(Kelliher et al., 2019)和单倍体诱导介导的基因组编辑(haploid inducer-mediated genome editing, IMGE)策略(Wang et al., 2019a)。利用单倍体诱导技术可以高效生成单倍体植株, 随后通过CRISPR/Cas9或其它基因编辑技术进行目标基因的精确修改。HI-Edit策略的独特之处在于, 允许在不引入外源DNA的条件下对基因进行精准改良, 因此显著降低了对转基因技术的依赖。通过这种策略, 可在2个世代内成功培育出特定性状的纯合株系。此外, 该策略有效克服了玉米遗传转化过程中的基因型限制, 为玉米育种提供了更广泛的适用范围。在真核生物中, 着丝粒是染色体准确分离与遗传信息传递不可或缺的区域, 而特异的着丝粒组蛋白CH3 (CENH3)在识别和维持着丝粒染色质结构方面扮演着关键角色。Wang等(2021a)通过CRISPR/Cas9技术对玉米CENH3基因进行编辑, 成功创制了一个由单碱基缺失引起编辑提前终止的突变体。该突变体与野生型进行杂交后, 自交时纯合的突变体具有高度致死性, 无法通过配子传递, 而杂合子与野生型进行正反交配, 后代为单倍体或非整倍体。这表明CENH3突变可通过一次杂交转移到其它品系中, 为构建高效且简化的玉米单倍体诱导系统提供了可能。
玉米植株的形态特征如密植耐受性、茎秆强度、植株高度、叶片夹角和穗位高度, 对于玉米光合效率和空间资源利用具有决定性作用, 并直接影响产量。因此, 在玉米育种和农业生产实践中, 株型优化是提高产量和作物适应性的关键因素。在玉米发育初期, 特别是在9至10叶期, 位于叶腋的分生组织(AM)转变为花序分生组织(IM), 继而在IM上发育出多行小穗分生组织(SPM)。而分生组织的生长和发育主要受CLAVATA- WUSCHEL信号途径中CLE肽信号调控, 此途径是果穗行数及粒重增加的关键(Schoof et al., 2000)。Liu等(2021)利用CRISPR/Cas9基因编辑技术, 对玉米中CLV3的同源基因CLE7和FCP1的启动子区进行特定的缺失编辑, 发现突变体中分生组织显著增大, 从而间接提高玉米产量相关性状, 如穗大小、粒数及百粒重。叶夹角是影响玉米密植的关键因子, 优化叶夹角不仅能提高光利用效率, 还可改善作物群体的空气流通, 最终提高群体光合效率。Li等(2017a)利用CRISPR/Cas9对玉米ZmLg1基因进行编辑, 该基因编码一种含SBP (squamosa promoter-binding protein)结构域的蛋白, 负责调控叶夹角。通过对ZmLg1基因第1外显子进行编辑, T0代植株展现出高达51.5%-91.2%的基因编辑效率, 并使叶夹角明显变小至对照组的50%, 且突变特征稳定遗传。田间试验表明, 这些突变体通过增加种植密度展现出增产潜力。SAMBA作为植物特异性调节因子, 是影响拟南芥有丝分裂期推进复合体(APC/C)的关键因子, 负责控制细胞周期的顺利进行。研究发现, SAMBA与APC/C在玉米中同样存在相互作用, 通过对玉米中2个SAMBA基因敲除突变体的观察, 发现一系列生长缺陷, 包括节间缩短、上部叶片缩小和直立以及叶片整体缩小(Gong et al., 2022)。玉米中功能基因brd1和ZmRAVL1通过油菜素内酯信号通路调控叶夹角。UPA2定位于ZmRAVL1上游, 具有与DRL1蛋白结合的能力。LG1蛋白参与调控玉米叶夹角, 能激活ZmRAVL1的表达。DRL1与LG1直接相互作用, 抑制LG1对ZmRAVL1的激活。相较于玉米, 其祖先种大刍草(Zea mays subsp. parviglumis)的UPA2位点与DRL1蛋白结合能力更强, 导致ZmRAVL1表达显著受抑制, 进而下调其下游基因brd1的表达, 降低叶环区内源BR水平, 使叶夹角变小。将大刍草UPA2等位基因导入玉米或对玉米中的ZmRAVL1进行编辑, 在密植条件下均可显著提高玉米的产量(刘杰和严建兵, 2019)。
植物激素在玉米整个生命周期中扮演重要角色。赤霉素、生长素、细胞分裂素、乙烯、脱落酸、茉莉酸和水杨酸等植物激素通过复杂的相互作用和信号转导网络, 构成一个高度精密的调控系统。“绿色革命”基因赤霉素氧化酶基因GA20ox对于促进半矮表型的形成起重要作用, 不仅提高作物产量, 同时增强了植株的抗倒伏能力。Zhang等(2020a)利用CRISPR/Cas9技术编辑玉米GA20ox3基因后, 突变体中GA12和GA53的含量升高, 而其它GA前体的含量显著降低, 成功培育出半矮型玉米, 并在T2代植株中筛选出无转基因矮秆玉米。在玉米生长发育中, 细胞分裂素氧化酶(cytokinin oxidase, CKX)起关键作用, 其通过降解细胞分裂素调节植物激素水平。刘超等(2020)从玉米B73的基因组数据中成功鉴定出3个穗发育关键基因。使用e-crisp设计特异性sgRNA后, 采用密码子优化的CRISPR/Cas9系统, 成功构建了CKX基因的植物表达载体p3301-U6P-sgRNA-Ubi-Cas9, 为创制基因敲除玉米突变体奠定了基础。Ning等(2021)对数量性状基因座qEL7进行鉴定, 发现该基因座控制玉米的果穗长、花朵数和生育力等。qEL7编码的1-氨基环丙烷-1-羧酸氧化酶2 (ACO2)是乙烯生物合成过程中的关键酶, 在发育中的花序特定区域呈现特异性表达。通过编辑ZmACO2基因验证了qEL7的功能, 发现该编辑减少了发育中果穗的乙烯产生, 促进花序和花的发育, 从而提高产量。C末端编码肽(CEPs)是一类重要的肽激素, 其在拟南芥和水稻中通过细胞间通信调节植物生长和非生物胁迫响应, 而其在玉米中的作用仍知之甚少。Xu等(2021)探讨了玉米ZmCEP1的时空表达模式, 发现其可能调节生长素(auxin)等植物激素的运输和分布, 进而影响籽粒细胞的分裂和扩张, 为玉米籽粒改良提供了新的靶点和思路。
气孔运动通过调节CO2的可用性影响植物的光合速率, 这一过程受到光合产物的反馈调节。然而, 在单子叶作物中, 该调节回路的遗传组分和机制尚待进一步阐明。Wang等(2019b)基于图位克隆CST1并通过CRISPR/Cas9系统, 发现导致CST1蛋白E81K突变的是一种属于Clade I SWEET (Sugars Will Eventually be Exported Transporters)家族的基因突变。CST1编码一个在附属细胞中表达的功能性葡萄糖转运蛋白。E81K突变破坏了CST1蛋白的寡聚化能力及其葡萄糖转运活性, 导致气孔开度减小、碳饥饿以及叶片提前衰老。此外, 一个含有DYW基序的五肽重复蛋白(pentatricopeptide repeat protein, PPR)参与叶绿体NADH脱氢酶复合体ndhB亚基C到U的编辑。Huang等(2020)利用CRISPR/Cas9技术对qkw9基因进行敲除, 在qkw9的空白背景下, ndhB的C到U编辑被抑制, 光合作用减弱。作物产量的形成依赖于从叶片到种子的蔗糖高效分配。ZmSWEET13旁系同源体(Zmsweet13a、Zmsweet13b和Zmsweet13c)是叶片中表达量最高的基因之一。Bezrutczyk等(2018)通过基因编辑进行三重敲除, 突变体表现严重的生长受阻, 光合机构受损, 叶片积累大量可溶性糖和淀粉, 且RNA-seq数据揭示突变体中与光合作用和碳水化合物代谢相关的基因发生转录失调。ANT (AINTEGUMENTA)是一种AP2转录因子, 在植物生长和花器官形成中起重要作用。Liu等(2020)利用CRISPR/Cas9技术生成1个单密码子缺失突变体和2个ANT1同源基因移码突变体。这2个移码突变体与野生型(WT)相比, 表现出植物光合效率和生长速率降低及叶面积变小。在高密度种植条件下, 玉米植株之间相互遮挡, 导致底部叶片光照强度降低, 进而影响红光与远红光的比例, 最终降低产量。为解释该现象的分子机制, Wu等(2019)利用CRISPR/Cas9技术对玉米中参与光信号传递和光依赖形态建成的PIF基因家族成员Zmpif3、Zmpif4和Zmpif5进行敲除, 发现在黑暗条件下生长的突变体幼苗的中胚轴伸长被严重抑制, 且对模拟遮荫处理的响应减弱。
2-乙酰基-1-吡咯烷酮(2AP)是从芳香型水稻中鉴定出的200多种挥发性物质中的关键风味化合物。除水稻外, 多种植物中都存在天然的芳香物质, 通常表现出较低的甜菜碱醛脱氢酶2 (BADH2)活性。Wang等(2021b)对玉米BADH2同源基因ZmBADH2a和ZmBADH2b进行CRISPR/Cas敲除, 生成ZmBADH2a和ZmBADH2b双基因突变体。在双突变体中, 无论是新鲜籽粒还是干燥成熟种子, 其2AP含量均升高。此外, 张翔等(2021)利用CRISPR/Cas9技术在玉米4号染色体ZmBADH2-1和1号染色体ZmBADH2-2进行精确敲除, 双基因突变体籽粒中的2AP含量与芳香型水稻相似, 由此创制出具有类似香米香气的新型玉米种质。王彦晓(2021)选取包括郑58、糯型玉米N355、XCW175及LN005M等在内的多种普通及特殊玉米品种进行研究, 利用构建的3种CRISPR/Cas系统载体对BADH2基因进行编辑, 并通过农杆菌介导法将这些载体导入玉米幼胚中, 培育出多个带有香气的玉米自交系新品种。
茎秆倒伏性由茎秆强度决定, 且是限制高密度种植条件下玉米产量的关键因素。然而, 玉米茎秆强度的分子遗传基础复杂, 导致改良方法效率低。在玉米茎秆发育中, STIFF1基因扮演关键角色。Zhang等(2020b)采用CRISPR/Cas9技术编辑STIFF1基因的特定等位基因, 进一步提高了玉米茎秆的纤维素和木质素含量。sd1和Rht1等半矮化基因在水稻和小麦中的应用促发第一次“绿色革命”。在玉米中, 尚未发现能有效降低株高但不降低产量性状的半矮化基因。利用CRISPR/Cas技术, Wei等(2018)精确鉴定到编码P-糖蛋白的Brachytic2基因(qpa1)的新等位基因。并在qpa1基因的最后一个外显子中引入241 bp缺失, 突变体表现为不降低产量但显著降低株高和穗位以及增加茎粗。在光照条件下, 玉米PHYC2蛋白定位于细胞核和细胞质, 且能够与自身或PHYBs相互作用。异源表达ZmPHYCs能够补偿拟南芥phyC-2突变体在持续红光条件下的表型。Li等(2020)利用CRISPR/ Cas9技术创建了ZmPHYC1和ZmPHYC2双基因敲除突变体, 在长日照条件下该突变体表现出中等程度的早花表型, 而过表达ZmPHYC2植株表现出株高和穗位中度降低。
在自然条件下, 大多数植物(如玉米)表现为二倍体, 即每个细胞含有2套染色体.为培育出遗传上纯合的系谱, 研究人员通过多代连续自交以确保后代基因的纯合性.而单倍体诱导技术提供了一种更为高效的方法.该技术通过特定的双单倍体(DH)途径, 诱导植物产生仅含1套染色体的细胞, 进而发育成单倍体植株.随后, 利用染色体加倍技术, 将单倍体植株转化为遗传稳定的二倍体植株, 极大地缩短了培育纯合谱系的时间(Ren et al., 2017).基于CRISPR/Cas9技术对玉米中的花粉特异性磷脂酶基因ZmPLA1进行精确编辑, Dong等(2018)成功开发出高效的孤雌生殖单倍体诱导体系; 他们还融入一个组织特异性表达的双荧光蛋白标记系统, 显著优化了单倍体的鉴别和筛选流程, 极大地提高了筛选效率, 并为作物改良中双单倍体育种技术的应用确立了新标准.Stock6 (可诱导产生单倍体的玉米突变体)作为玉米单倍体诱导育种的关键工具, 可通过杂交诱发孤雌生殖, 即使花粉与雌蕊接触, 也不形成正常的双倍体合子, 而是直接形成单倍体种子, 随后通过化学处理或温度震荡等手段进行染色体加倍, 进而形成遗传上纯合的双单倍体植株.Liu等(2017)利用CRISPR/Cas9技术对玉米ZmPLA1基因第1外显子进行精确编辑, 导致特定的缺失突变.编辑后的突变体平均单倍体诱导率约为2%, 与Stock6的诱导效率相似.该研究团队进一步采用CRISPR/Cas9技术敲除ZmDMP基因后, 观察到该基因缺失单倍体诱导率提高5-6倍.这是首次在非Stock6背景下观察到的独立单倍体诱导现象, 展现出基因编辑技术在提高单倍体诱导率方面的巨大应用潜力.通过将CRISPR/Cas9基因编辑技术与传统单倍体诱导策略相结合, 创制了单倍体诱导编辑(haploid-induction editing, HI-Edit)策略(Kelliher et al., 2019)和单倍体诱导介导的基因组编辑(haploid inducer-mediated genome editing, IMGE)策略(Wang et al., 2019a).利用单倍体诱导技术可以高效生成单倍体植株, 随后通过CRISPR/Cas9或其它基因编辑技术进行目标基因的精确修改.HI-Edit策略的独特之处在于, 允许在不引入外源DNA的条件下对基因进行精准改良, 因此显著降低了对转基因技术的依赖.通过这种策略, 可在2个世代内成功培育出特定性状的纯合株系.此外, 该策略有效克服了玉米遗传转化过程中的基因型限制, 为玉米育种提供了更广泛的适用范围.在真核生物中, 着丝粒是染色体准确分离与遗传信息传递不可或缺的区域, 而特异的着丝粒组蛋白CH3 (CENH3)在识别和维持着丝粒染色质结构方面扮演着关键角色.Wang等(2021a)通过CRISPR/Cas9技术对玉米CENH3基因进行编辑, 成功创制了一个由单碱基缺失引起编辑提前终止的突变体.该突变体与野生型进行杂交后, 自交时纯合的突变体具有高度致死性, 无法通过配子传递, 而杂合子与野生型进行正反交配, 后代为单倍体或非整倍体.这表明CENH3突变可通过一次杂交转移到其它品系中, 为构建高效且简化的玉米单倍体诱导系统提供了可能. ...
在自然条件下, 大多数植物(如玉米)表现为二倍体, 即每个细胞含有2套染色体.为培育出遗传上纯合的系谱, 研究人员通过多代连续自交以确保后代基因的纯合性.而单倍体诱导技术提供了一种更为高效的方法.该技术通过特定的双单倍体(DH)途径, 诱导植物产生仅含1套染色体的细胞, 进而发育成单倍体植株.随后, 利用染色体加倍技术, 将单倍体植株转化为遗传稳定的二倍体植株, 极大地缩短了培育纯合谱系的时间(Ren et al., 2017).基于CRISPR/Cas9技术对玉米中的花粉特异性磷脂酶基因ZmPLA1进行精确编辑, Dong等(2018)成功开发出高效的孤雌生殖单倍体诱导体系; 他们还融入一个组织特异性表达的双荧光蛋白标记系统, 显著优化了单倍体的鉴别和筛选流程, 极大地提高了筛选效率, 并为作物改良中双单倍体育种技术的应用确立了新标准.Stock6 (可诱导产生单倍体的玉米突变体)作为玉米单倍体诱导育种的关键工具, 可通过杂交诱发孤雌生殖, 即使花粉与雌蕊接触, 也不形成正常的双倍体合子, 而是直接形成单倍体种子, 随后通过化学处理或温度震荡等手段进行染色体加倍, 进而形成遗传上纯合的双单倍体植株.Liu等(2017)利用CRISPR/Cas9技术对玉米ZmPLA1基因第1外显子进行精确编辑, 导致特定的缺失突变.编辑后的突变体平均单倍体诱导率约为2%, 与Stock6的诱导效率相似.该研究团队进一步采用CRISPR/Cas9技术敲除ZmDMP基因后, 观察到该基因缺失单倍体诱导率提高5-6倍.这是首次在非Stock6背景下观察到的独立单倍体诱导现象, 展现出基因编辑技术在提高单倍体诱导率方面的巨大应用潜力.通过将CRISPR/Cas9基因编辑技术与传统单倍体诱导策略相结合, 创制了单倍体诱导编辑(haploid-induction editing, HI-Edit)策略(Kelliher et al., 2019)和单倍体诱导介导的基因组编辑(haploid inducer-mediated genome editing, IMGE)策略(Wang et al., 2019a).利用单倍体诱导技术可以高效生成单倍体植株, 随后通过CRISPR/Cas9或其它基因编辑技术进行目标基因的精确修改.HI-Edit策略的独特之处在于, 允许在不引入外源DNA的条件下对基因进行精准改良, 因此显著降低了对转基因技术的依赖.通过这种策略, 可在2个世代内成功培育出特定性状的纯合株系.此外, 该策略有效克服了玉米遗传转化过程中的基因型限制, 为玉米育种提供了更广泛的适用范围.在真核生物中, 着丝粒是染色体准确分离与遗传信息传递不可或缺的区域, 而特异的着丝粒组蛋白CH3 (CENH3)在识别和维持着丝粒染色质结构方面扮演着关键角色.Wang等(2021a)通过CRISPR/Cas9技术对玉米CENH3基因进行编辑, 成功创制了一个由单碱基缺失引起编辑提前终止的突变体.该突变体与野生型进行杂交后, 自交时纯合的突变体具有高度致死性, 无法通过配子传递, 而杂合子与野生型进行正反交配, 后代为单倍体或非整倍体.这表明CENH3突变可通过一次杂交转移到其它品系中, 为构建高效且简化的玉米单倍体诱导系统提供了可能. ...
在自然条件下, 大多数植物(如玉米)表现为二倍体, 即每个细胞含有2套染色体.为培育出遗传上纯合的系谱, 研究人员通过多代连续自交以确保后代基因的纯合性.而单倍体诱导技术提供了一种更为高效的方法.该技术通过特定的双单倍体(DH)途径, 诱导植物产生仅含1套染色体的细胞, 进而发育成单倍体植株.随后, 利用染色体加倍技术, 将单倍体植株转化为遗传稳定的二倍体植株, 极大地缩短了培育纯合谱系的时间(Ren et al., 2017).基于CRISPR/Cas9技术对玉米中的花粉特异性磷脂酶基因ZmPLA1进行精确编辑, Dong等(2018)成功开发出高效的孤雌生殖单倍体诱导体系; 他们还融入一个组织特异性表达的双荧光蛋白标记系统, 显著优化了单倍体的鉴别和筛选流程, 极大地提高了筛选效率, 并为作物改良中双单倍体育种技术的应用确立了新标准.Stock6 (可诱导产生单倍体的玉米突变体)作为玉米单倍体诱导育种的关键工具, 可通过杂交诱发孤雌生殖, 即使花粉与雌蕊接触, 也不形成正常的双倍体合子, 而是直接形成单倍体种子, 随后通过化学处理或温度震荡等手段进行染色体加倍, 进而形成遗传上纯合的双单倍体植株.Liu等(2017)利用CRISPR/Cas9技术对玉米ZmPLA1基因第1外显子进行精确编辑, 导致特定的缺失突变.编辑后的突变体平均单倍体诱导率约为2%, 与Stock6的诱导效率相似.该研究团队进一步采用CRISPR/Cas9技术敲除ZmDMP基因后, 观察到该基因缺失单倍体诱导率提高5-6倍.这是首次在非Stock6背景下观察到的独立单倍体诱导现象, 展现出基因编辑技术在提高单倍体诱导率方面的巨大应用潜力.通过将CRISPR/Cas9基因编辑技术与传统单倍体诱导策略相结合, 创制了单倍体诱导编辑(haploid-induction editing, HI-Edit)策略(Kelliher et al., 2019)和单倍体诱导介导的基因组编辑(haploid inducer-mediated genome editing, IMGE)策略(Wang et al., 2019a).利用单倍体诱导技术可以高效生成单倍体植株, 随后通过CRISPR/Cas9或其它基因编辑技术进行目标基因的精确修改.HI-Edit策略的独特之处在于, 允许在不引入外源DNA的条件下对基因进行精准改良, 因此显著降低了对转基因技术的依赖.通过这种策略, 可在2个世代内成功培育出特定性状的纯合株系.此外, 该策略有效克服了玉米遗传转化过程中的基因型限制, 为玉米育种提供了更广泛的适用范围.在真核生物中, 着丝粒是染色体准确分离与遗传信息传递不可或缺的区域, 而特异的着丝粒组蛋白CH3 (CENH3)在识别和维持着丝粒染色质结构方面扮演着关键角色.Wang等(2021a)通过CRISPR/Cas9技术对玉米CENH3基因进行编辑, 成功创制了一个由单碱基缺失引起编辑提前终止的突变体.该突变体与野生型进行杂交后, 自交时纯合的突变体具有高度致死性, 无法通过配子传递, 而杂合子与野生型进行正反交配, 后代为单倍体或非整倍体.这表明CENH3突变可通过一次杂交转移到其它品系中, 为构建高效且简化的玉米单倍体诱导系统提供了可能. ...
在自然条件下, 大多数植物(如玉米)表现为二倍体, 即每个细胞含有2套染色体.为培育出遗传上纯合的系谱, 研究人员通过多代连续自交以确保后代基因的纯合性.而单倍体诱导技术提供了一种更为高效的方法.该技术通过特定的双单倍体(DH)途径, 诱导植物产生仅含1套染色体的细胞, 进而发育成单倍体植株.随后, 利用染色体加倍技术, 将单倍体植株转化为遗传稳定的二倍体植株, 极大地缩短了培育纯合谱系的时间(Ren et al., 2017).基于CRISPR/Cas9技术对玉米中的花粉特异性磷脂酶基因ZmPLA1进行精确编辑, Dong等(2018)成功开发出高效的孤雌生殖单倍体诱导体系; 他们还融入一个组织特异性表达的双荧光蛋白标记系统, 显著优化了单倍体的鉴别和筛选流程, 极大地提高了筛选效率, 并为作物改良中双单倍体育种技术的应用确立了新标准.Stock6 (可诱导产生单倍体的玉米突变体)作为玉米单倍体诱导育种的关键工具, 可通过杂交诱发孤雌生殖, 即使花粉与雌蕊接触, 也不形成正常的双倍体合子, 而是直接形成单倍体种子, 随后通过化学处理或温度震荡等手段进行染色体加倍, 进而形成遗传上纯合的双单倍体植株.Liu等(2017)利用CRISPR/Cas9技术对玉米ZmPLA1基因第1外显子进行精确编辑, 导致特定的缺失突变.编辑后的突变体平均单倍体诱导率约为2%, 与Stock6的诱导效率相似.该研究团队进一步采用CRISPR/Cas9技术敲除ZmDMP基因后, 观察到该基因缺失单倍体诱导率提高5-6倍.这是首次在非Stock6背景下观察到的独立单倍体诱导现象, 展现出基因编辑技术在提高单倍体诱导率方面的巨大应用潜力.通过将CRISPR/Cas9基因编辑技术与传统单倍体诱导策略相结合, 创制了单倍体诱导编辑(haploid-induction editing, HI-Edit)策略(Kelliher et al., 2019)和单倍体诱导介导的基因组编辑(haploid inducer-mediated genome editing, IMGE)策略(Wang et al., 2019a).利用单倍体诱导技术可以高效生成单倍体植株, 随后通过CRISPR/Cas9或其它基因编辑技术进行目标基因的精确修改.HI-Edit策略的独特之处在于, 允许在不引入外源DNA的条件下对基因进行精准改良, 因此显著降低了对转基因技术的依赖.通过这种策略, 可在2个世代内成功培育出特定性状的纯合株系.此外, 该策略有效克服了玉米遗传转化过程中的基因型限制, 为玉米育种提供了更广泛的适用范围.在真核生物中, 着丝粒是染色体准确分离与遗传信息传递不可或缺的区域, 而特异的着丝粒组蛋白CH3 (CENH3)在识别和维持着丝粒染色质结构方面扮演着关键角色.Wang等(2021a)通过CRISPR/Cas9技术对玉米CENH3基因进行编辑, 成功创制了一个由单碱基缺失引起编辑提前终止的突变体.该突变体与野生型进行杂交后, 自交时纯合的突变体具有高度致死性, 无法通过配子传递, 而杂合子与野生型进行正反交配, 后代为单倍体或非整倍体.这表明CENH3突变可通过一次杂交转移到其它品系中, 为构建高效且简化的玉米单倍体诱导系统提供了可能. ...
在自然条件下, 大多数植物(如玉米)表现为二倍体, 即每个细胞含有2套染色体.为培育出遗传上纯合的系谱, 研究人员通过多代连续自交以确保后代基因的纯合性.而单倍体诱导技术提供了一种更为高效的方法.该技术通过特定的双单倍体(DH)途径, 诱导植物产生仅含1套染色体的细胞, 进而发育成单倍体植株.随后, 利用染色体加倍技术, 将单倍体植株转化为遗传稳定的二倍体植株, 极大地缩短了培育纯合谱系的时间(Ren et al., 2017).基于CRISPR/Cas9技术对玉米中的花粉特异性磷脂酶基因ZmPLA1进行精确编辑, Dong等(2018)成功开发出高效的孤雌生殖单倍体诱导体系; 他们还融入一个组织特异性表达的双荧光蛋白标记系统, 显著优化了单倍体的鉴别和筛选流程, 极大地提高了筛选效率, 并为作物改良中双单倍体育种技术的应用确立了新标准.Stock6 (可诱导产生单倍体的玉米突变体)作为玉米单倍体诱导育种的关键工具, 可通过杂交诱发孤雌生殖, 即使花粉与雌蕊接触, 也不形成正常的双倍体合子, 而是直接形成单倍体种子, 随后通过化学处理或温度震荡等手段进行染色体加倍, 进而形成遗传上纯合的双单倍体植株.Liu等(2017)利用CRISPR/Cas9技术对玉米ZmPLA1基因第1外显子进行精确编辑, 导致特定的缺失突变.编辑后的突变体平均单倍体诱导率约为2%, 与Stock6的诱导效率相似.该研究团队进一步采用CRISPR/Cas9技术敲除ZmDMP基因后, 观察到该基因缺失单倍体诱导率提高5-6倍.这是首次在非Stock6背景下观察到的独立单倍体诱导现象, 展现出基因编辑技术在提高单倍体诱导率方面的巨大应用潜力.通过将CRISPR/Cas9基因编辑技术与传统单倍体诱导策略相结合, 创制了单倍体诱导编辑(haploid-induction editing, HI-Edit)策略(Kelliher et al., 2019)和单倍体诱导介导的基因组编辑(haploid inducer-mediated genome editing, IMGE)策略(Wang et al., 2019a).利用单倍体诱导技术可以高效生成单倍体植株, 随后通过CRISPR/Cas9或其它基因编辑技术进行目标基因的精确修改.HI-Edit策略的独特之处在于, 允许在不引入外源DNA的条件下对基因进行精准改良, 因此显著降低了对转基因技术的依赖.通过这种策略, 可在2个世代内成功培育出特定性状的纯合株系.此外, 该策略有效克服了玉米遗传转化过程中的基因型限制, 为玉米育种提供了更广泛的适用范围.在真核生物中, 着丝粒是染色体准确分离与遗传信息传递不可或缺的区域, 而特异的着丝粒组蛋白CH3 (CENH3)在识别和维持着丝粒染色质结构方面扮演着关键角色.Wang等(2021a)通过CRISPR/Cas9技术对玉米CENH3基因进行编辑, 成功创制了一个由单碱基缺失引起编辑提前终止的突变体.该突变体与野生型进行杂交后, 自交时纯合的突变体具有高度致死性, 无法通过配子传递, 而杂合子与野生型进行正反交配, 后代为单倍体或非整倍体.这表明CENH3突变可通过一次杂交转移到其它品系中, 为构建高效且简化的玉米单倍体诱导系统提供了可能. ...
在自然条件下, 大多数植物(如玉米)表现为二倍体, 即每个细胞含有2套染色体.为培育出遗传上纯合的系谱, 研究人员通过多代连续自交以确保后代基因的纯合性.而单倍体诱导技术提供了一种更为高效的方法.该技术通过特定的双单倍体(DH)途径, 诱导植物产生仅含1套染色体的细胞, 进而发育成单倍体植株.随后, 利用染色体加倍技术, 将单倍体植株转化为遗传稳定的二倍体植株, 极大地缩短了培育纯合谱系的时间(Ren et al., 2017).基于CRISPR/Cas9技术对玉米中的花粉特异性磷脂酶基因ZmPLA1进行精确编辑, Dong等(2018)成功开发出高效的孤雌生殖单倍体诱导体系; 他们还融入一个组织特异性表达的双荧光蛋白标记系统, 显著优化了单倍体的鉴别和筛选流程, 极大地提高了筛选效率, 并为作物改良中双单倍体育种技术的应用确立了新标准.Stock6 (可诱导产生单倍体的玉米突变体)作为玉米单倍体诱导育种的关键工具, 可通过杂交诱发孤雌生殖, 即使花粉与雌蕊接触, 也不形成正常的双倍体合子, 而是直接形成单倍体种子, 随后通过化学处理或温度震荡等手段进行染色体加倍, 进而形成遗传上纯合的双单倍体植株.Liu等(2017)利用CRISPR/Cas9技术对玉米ZmPLA1基因第1外显子进行精确编辑, 导致特定的缺失突变.编辑后的突变体平均单倍体诱导率约为2%, 与Stock6的诱导效率相似.该研究团队进一步采用CRISPR/Cas9技术敲除ZmDMP基因后, 观察到该基因缺失单倍体诱导率提高5-6倍.这是首次在非Stock6背景下观察到的独立单倍体诱导现象, 展现出基因编辑技术在提高单倍体诱导率方面的巨大应用潜力.通过将CRISPR/Cas9基因编辑技术与传统单倍体诱导策略相结合, 创制了单倍体诱导编辑(haploid-induction editing, HI-Edit)策略(Kelliher et al., 2019)和单倍体诱导介导的基因组编辑(haploid inducer-mediated genome editing, IMGE)策略(Wang et al., 2019a).利用单倍体诱导技术可以高效生成单倍体植株, 随后通过CRISPR/Cas9或其它基因编辑技术进行目标基因的精确修改.HI-Edit策略的独特之处在于, 允许在不引入外源DNA的条件下对基因进行精准改良, 因此显著降低了对转基因技术的依赖.通过这种策略, 可在2个世代内成功培育出特定性状的纯合株系.此外, 该策略有效克服了玉米遗传转化过程中的基因型限制, 为玉米育种提供了更广泛的适用范围.在真核生物中, 着丝粒是染色体准确分离与遗传信息传递不可或缺的区域, 而特异的着丝粒组蛋白CH3 (CENH3)在识别和维持着丝粒染色质结构方面扮演着关键角色.Wang等(2021a)通过CRISPR/Cas9技术对玉米CENH3基因进行编辑, 成功创制了一个由单碱基缺失引起编辑提前终止的突变体.该突变体与野生型进行杂交后, 自交时纯合的突变体具有高度致死性, 无法通过配子传递, 而杂合子与野生型进行正反交配, 后代为单倍体或非整倍体.这表明CENH3突变可通过一次杂交转移到其它品系中, 为构建高效且简化的玉米单倍体诱导系统提供了可能. ...
在自然条件下, 大多数植物(如玉米)表现为二倍体, 即每个细胞含有2套染色体.为培育出遗传上纯合的系谱, 研究人员通过多代连续自交以确保后代基因的纯合性.而单倍体诱导技术提供了一种更为高效的方法.该技术通过特定的双单倍体(DH)途径, 诱导植物产生仅含1套染色体的细胞, 进而发育成单倍体植株.随后, 利用染色体加倍技术, 将单倍体植株转化为遗传稳定的二倍体植株, 极大地缩短了培育纯合谱系的时间(Ren et al., 2017).基于CRISPR/Cas9技术对玉米中的花粉特异性磷脂酶基因ZmPLA1进行精确编辑, Dong等(2018)成功开发出高效的孤雌生殖单倍体诱导体系; 他们还融入一个组织特异性表达的双荧光蛋白标记系统, 显著优化了单倍体的鉴别和筛选流程, 极大地提高了筛选效率, 并为作物改良中双单倍体育种技术的应用确立了新标准.Stock6 (可诱导产生单倍体的玉米突变体)作为玉米单倍体诱导育种的关键工具, 可通过杂交诱发孤雌生殖, 即使花粉与雌蕊接触, 也不形成正常的双倍体合子, 而是直接形成单倍体种子, 随后通过化学处理或温度震荡等手段进行染色体加倍, 进而形成遗传上纯合的双单倍体植株.Liu等(2017)利用CRISPR/Cas9技术对玉米ZmPLA1基因第1外显子进行精确编辑, 导致特定的缺失突变.编辑后的突变体平均单倍体诱导率约为2%, 与Stock6的诱导效率相似.该研究团队进一步采用CRISPR/Cas9技术敲除ZmDMP基因后, 观察到该基因缺失单倍体诱导率提高5-6倍.这是首次在非Stock6背景下观察到的独立单倍体诱导现象, 展现出基因编辑技术在提高单倍体诱导率方面的巨大应用潜力.通过将CRISPR/Cas9基因编辑技术与传统单倍体诱导策略相结合, 创制了单倍体诱导编辑(haploid-induction editing, HI-Edit)策略(Kelliher et al., 2019)和单倍体诱导介导的基因组编辑(haploid inducer-mediated genome editing, IMGE)策略(Wang et al., 2019a).利用单倍体诱导技术可以高效生成单倍体植株, 随后通过CRISPR/Cas9或其它基因编辑技术进行目标基因的精确修改.HI-Edit策略的独特之处在于, 允许在不引入外源DNA的条件下对基因进行精准改良, 因此显著降低了对转基因技术的依赖.通过这种策略, 可在2个世代内成功培育出特定性状的纯合株系.此外, 该策略有效克服了玉米遗传转化过程中的基因型限制, 为玉米育种提供了更广泛的适用范围.在真核生物中, 着丝粒是染色体准确分离与遗传信息传递不可或缺的区域, 而特异的着丝粒组蛋白CH3 (CENH3)在识别和维持着丝粒染色质结构方面扮演着关键角色.Wang等(2021a)通过CRISPR/Cas9技术对玉米CENH3基因进行编辑, 成功创制了一个由单碱基缺失引起编辑提前终止的突变体.该突变体与野生型进行杂交后, 自交时纯合的突变体具有高度致死性, 无法通过配子传递, 而杂合子与野生型进行正反交配, 后代为单倍体或非整倍体.这表明CENH3突变可通过一次杂交转移到其它品系中, 为构建高效且简化的玉米单倍体诱导系统提供了可能. ...
在自然条件下, 大多数植物(如玉米)表现为二倍体, 即每个细胞含有2套染色体.为培育出遗传上纯合的系谱, 研究人员通过多代连续自交以确保后代基因的纯合性.而单倍体诱导技术提供了一种更为高效的方法.该技术通过特定的双单倍体(DH)途径, 诱导植物产生仅含1套染色体的细胞, 进而发育成单倍体植株.随后, 利用染色体加倍技术, 将单倍体植株转化为遗传稳定的二倍体植株, 极大地缩短了培育纯合谱系的时间(Ren et al., 2017).基于CRISPR/Cas9技术对玉米中的花粉特异性磷脂酶基因ZmPLA1进行精确编辑, Dong等(2018)成功开发出高效的孤雌生殖单倍体诱导体系; 他们还融入一个组织特异性表达的双荧光蛋白标记系统, 显著优化了单倍体的鉴别和筛选流程, 极大地提高了筛选效率, 并为作物改良中双单倍体育种技术的应用确立了新标准.Stock6 (可诱导产生单倍体的玉米突变体)作为玉米单倍体诱导育种的关键工具, 可通过杂交诱发孤雌生殖, 即使花粉与雌蕊接触, 也不形成正常的双倍体合子, 而是直接形成单倍体种子, 随后通过化学处理或温度震荡等手段进行染色体加倍, 进而形成遗传上纯合的双单倍体植株.Liu等(2017)利用CRISPR/Cas9技术对玉米ZmPLA1基因第1外显子进行精确编辑, 导致特定的缺失突变.编辑后的突变体平均单倍体诱导率约为2%, 与Stock6的诱导效率相似.该研究团队进一步采用CRISPR/Cas9技术敲除ZmDMP基因后, 观察到该基因缺失单倍体诱导率提高5-6倍.这是首次在非Stock6背景下观察到的独立单倍体诱导现象, 展现出基因编辑技术在提高单倍体诱导率方面的巨大应用潜力.通过将CRISPR/Cas9基因编辑技术与传统单倍体诱导策略相结合, 创制了单倍体诱导编辑(haploid-induction editing, HI-Edit)策略(Kelliher et al., 2019)和单倍体诱导介导的基因组编辑(haploid inducer-mediated genome editing, IMGE)策略(Wang et al., 2019a).利用单倍体诱导技术可以高效生成单倍体植株, 随后通过CRISPR/Cas9或其它基因编辑技术进行目标基因的精确修改.HI-Edit策略的独特之处在于, 允许在不引入外源DNA的条件下对基因进行精准改良, 因此显著降低了对转基因技术的依赖.通过这种策略, 可在2个世代内成功培育出特定性状的纯合株系.此外, 该策略有效克服了玉米遗传转化过程中的基因型限制, 为玉米育种提供了更广泛的适用范围.在真核生物中, 着丝粒是染色体准确分离与遗传信息传递不可或缺的区域, 而特异的着丝粒组蛋白CH3 (CENH3)在识别和维持着丝粒染色质结构方面扮演着关键角色.Wang等(2021a)通过CRISPR/Cas9技术对玉米CENH3基因进行编辑, 成功创制了一个由单碱基缺失引起编辑提前终止的突变体.该突变体与野生型进行杂交后, 自交时纯合的突变体具有高度致死性, 无法通过配子传递, 而杂合子与野生型进行正反交配, 后代为单倍体或非整倍体.这表明CENH3突变可通过一次杂交转移到其它品系中, 为构建高效且简化的玉米单倍体诱导系统提供了可能. ...
在自然条件下, 大多数植物(如玉米)表现为二倍体, 即每个细胞含有2套染色体.为培育出遗传上纯合的系谱, 研究人员通过多代连续自交以确保后代基因的纯合性.而单倍体诱导技术提供了一种更为高效的方法.该技术通过特定的双单倍体(DH)途径, 诱导植物产生仅含1套染色体的细胞, 进而发育成单倍体植株.随后, 利用染色体加倍技术, 将单倍体植株转化为遗传稳定的二倍体植株, 极大地缩短了培育纯合谱系的时间(Ren et al., 2017).基于CRISPR/Cas9技术对玉米中的花粉特异性磷脂酶基因ZmPLA1进行精确编辑, Dong等(2018)成功开发出高效的孤雌生殖单倍体诱导体系; 他们还融入一个组织特异性表达的双荧光蛋白标记系统, 显著优化了单倍体的鉴别和筛选流程, 极大地提高了筛选效率, 并为作物改良中双单倍体育种技术的应用确立了新标准.Stock6 (可诱导产生单倍体的玉米突变体)作为玉米单倍体诱导育种的关键工具, 可通过杂交诱发孤雌生殖, 即使花粉与雌蕊接触, 也不形成正常的双倍体合子, 而是直接形成单倍体种子, 随后通过化学处理或温度震荡等手段进行染色体加倍, 进而形成遗传上纯合的双单倍体植株.Liu等(2017)利用CRISPR/Cas9技术对玉米ZmPLA1基因第1外显子进行精确编辑, 导致特定的缺失突变.编辑后的突变体平均单倍体诱导率约为2%, 与Stock6的诱导效率相似.该研究团队进一步采用CRISPR/Cas9技术敲除ZmDMP基因后, 观察到该基因缺失单倍体诱导率提高5-6倍.这是首次在非Stock6背景下观察到的独立单倍体诱导现象, 展现出基因编辑技术在提高单倍体诱导率方面的巨大应用潜力.通过将CRISPR/Cas9基因编辑技术与传统单倍体诱导策略相结合, 创制了单倍体诱导编辑(haploid-induction editing, HI-Edit)策略(Kelliher et al., 2019)和单倍体诱导介导的基因组编辑(haploid inducer-mediated genome editing, IMGE)策略(Wang et al., 2019a).利用单倍体诱导技术可以高效生成单倍体植株, 随后通过CRISPR/Cas9或其它基因编辑技术进行目标基因的精确修改.HI-Edit策略的独特之处在于, 允许在不引入外源DNA的条件下对基因进行精准改良, 因此显著降低了对转基因技术的依赖.通过这种策略, 可在2个世代内成功培育出特定性状的纯合株系.此外, 该策略有效克服了玉米遗传转化过程中的基因型限制, 为玉米育种提供了更广泛的适用范围.在真核生物中, 着丝粒是染色体准确分离与遗传信息传递不可或缺的区域, 而特异的着丝粒组蛋白CH3 (CENH3)在识别和维持着丝粒染色质结构方面扮演着关键角色.Wang等(2021a)通过CRISPR/Cas9技术对玉米CENH3基因进行编辑, 成功创制了一个由单碱基缺失引起编辑提前终止的突变体.该突变体与野生型进行杂交后, 自交时纯合的突变体具有高度致死性, 无法通过配子传递, 而杂合子与野生型进行正反交配, 后代为单倍体或非整倍体.这表明CENH3突变可通过一次杂交转移到其它品系中, 为构建高效且简化的玉米单倍体诱导系统提供了可能. ...
在自然条件下, 大多数植物(如玉米)表现为二倍体, 即每个细胞含有2套染色体.为培育出遗传上纯合的系谱, 研究人员通过多代连续自交以确保后代基因的纯合性.而单倍体诱导技术提供了一种更为高效的方法.该技术通过特定的双单倍体(DH)途径, 诱导植物产生仅含1套染色体的细胞, 进而发育成单倍体植株.随后, 利用染色体加倍技术, 将单倍体植株转化为遗传稳定的二倍体植株, 极大地缩短了培育纯合谱系的时间(Ren et al., 2017).基于CRISPR/Cas9技术对玉米中的花粉特异性磷脂酶基因ZmPLA1进行精确编辑, Dong等(2018)成功开发出高效的孤雌生殖单倍体诱导体系; 他们还融入一个组织特异性表达的双荧光蛋白标记系统, 显著优化了单倍体的鉴别和筛选流程, 极大地提高了筛选效率, 并为作物改良中双单倍体育种技术的应用确立了新标准.Stock6 (可诱导产生单倍体的玉米突变体)作为玉米单倍体诱导育种的关键工具, 可通过杂交诱发孤雌生殖, 即使花粉与雌蕊接触, 也不形成正常的双倍体合子, 而是直接形成单倍体种子, 随后通过化学处理或温度震荡等手段进行染色体加倍, 进而形成遗传上纯合的双单倍体植株.Liu等(2017)利用CRISPR/Cas9技术对玉米ZmPLA1基因第1外显子进行精确编辑, 导致特定的缺失突变.编辑后的突变体平均单倍体诱导率约为2%, 与Stock6的诱导效率相似.该研究团队进一步采用CRISPR/Cas9技术敲除ZmDMP基因后, 观察到该基因缺失单倍体诱导率提高5-6倍.这是首次在非Stock6背景下观察到的独立单倍体诱导现象, 展现出基因编辑技术在提高单倍体诱导率方面的巨大应用潜力.通过将CRISPR/Cas9基因编辑技术与传统单倍体诱导策略相结合, 创制了单倍体诱导编辑(haploid-induction editing, HI-Edit)策略(Kelliher et al., 2019)和单倍体诱导介导的基因组编辑(haploid inducer-mediated genome editing, IMGE)策略(Wang et al., 2019a).利用单倍体诱导技术可以高效生成单倍体植株, 随后通过CRISPR/Cas9或其它基因编辑技术进行目标基因的精确修改.HI-Edit策略的独特之处在于, 允许在不引入外源DNA的条件下对基因进行精准改良, 因此显著降低了对转基因技术的依赖.通过这种策略, 可在2个世代内成功培育出特定性状的纯合株系.此外, 该策略有效克服了玉米遗传转化过程中的基因型限制, 为玉米育种提供了更广泛的适用范围.在真核生物中, 着丝粒是染色体准确分离与遗传信息传递不可或缺的区域, 而特异的着丝粒组蛋白CH3 (CENH3)在识别和维持着丝粒染色质结构方面扮演着关键角色.Wang等(2021a)通过CRISPR/Cas9技术对玉米CENH3基因进行编辑, 成功创制了一个由单碱基缺失引起编辑提前终止的突变体.该突变体与野生型进行杂交后, 自交时纯合的突变体具有高度致死性, 无法通过配子传递, 而杂合子与野生型进行正反交配, 后代为单倍体或非整倍体.这表明CENH3突变可通过一次杂交转移到其它品系中, 为构建高效且简化的玉米单倍体诱导系统提供了可能. ...
在自然条件下, 大多数植物(如玉米)表现为二倍体, 即每个细胞含有2套染色体.为培育出遗传上纯合的系谱, 研究人员通过多代连续自交以确保后代基因的纯合性.而单倍体诱导技术提供了一种更为高效的方法.该技术通过特定的双单倍体(DH)途径, 诱导植物产生仅含1套染色体的细胞, 进而发育成单倍体植株.随后, 利用染色体加倍技术, 将单倍体植株转化为遗传稳定的二倍体植株, 极大地缩短了培育纯合谱系的时间(Ren et al., 2017).基于CRISPR/Cas9技术对玉米中的花粉特异性磷脂酶基因ZmPLA1进行精确编辑, Dong等(2018)成功开发出高效的孤雌生殖单倍体诱导体系; 他们还融入一个组织特异性表达的双荧光蛋白标记系统, 显著优化了单倍体的鉴别和筛选流程, 极大地提高了筛选效率, 并为作物改良中双单倍体育种技术的应用确立了新标准.Stock6 (可诱导产生单倍体的玉米突变体)作为玉米单倍体诱导育种的关键工具, 可通过杂交诱发孤雌生殖, 即使花粉与雌蕊接触, 也不形成正常的双倍体合子, 而是直接形成单倍体种子, 随后通过化学处理或温度震荡等手段进行染色体加倍, 进而形成遗传上纯合的双单倍体植株.Liu等(2017)利用CRISPR/Cas9技术对玉米ZmPLA1基因第1外显子进行精确编辑, 导致特定的缺失突变.编辑后的突变体平均单倍体诱导率约为2%, 与Stock6的诱导效率相似.该研究团队进一步采用CRISPR/Cas9技术敲除ZmDMP基因后, 观察到该基因缺失单倍体诱导率提高5-6倍.这是首次在非Stock6背景下观察到的独立单倍体诱导现象, 展现出基因编辑技术在提高单倍体诱导率方面的巨大应用潜力.通过将CRISPR/Cas9基因编辑技术与传统单倍体诱导策略相结合, 创制了单倍体诱导编辑(haploid-induction editing, HI-Edit)策略(Kelliher et al., 2019)和单倍体诱导介导的基因组编辑(haploid inducer-mediated genome editing, IMGE)策略(Wang et al., 2019a).利用单倍体诱导技术可以高效生成单倍体植株, 随后通过CRISPR/Cas9或其它基因编辑技术进行目标基因的精确修改.HI-Edit策略的独特之处在于, 允许在不引入外源DNA的条件下对基因进行精准改良, 因此显著降低了对转基因技术的依赖.通过这种策略, 可在2个世代内成功培育出特定性状的纯合株系.此外, 该策略有效克服了玉米遗传转化过程中的基因型限制, 为玉米育种提供了更广泛的适用范围.在真核生物中, 着丝粒是染色体准确分离与遗传信息传递不可或缺的区域, 而特异的着丝粒组蛋白CH3 (CENH3)在识别和维持着丝粒染色质结构方面扮演着关键角色.Wang等(2021a)通过CRISPR/Cas9技术对玉米CENH3基因进行编辑, 成功创制了一个由单碱基缺失引起编辑提前终止的突变体.该突变体与野生型进行杂交后, 自交时纯合的突变体具有高度致死性, 无法通过配子传递, 而杂合子与野生型进行正反交配, 后代为单倍体或非整倍体.这表明CENH3突变可通过一次杂交转移到其它品系中, 为构建高效且简化的玉米单倍体诱导系统提供了可能. ...
在自然条件下, 大多数植物(如玉米)表现为二倍体, 即每个细胞含有2套染色体.为培育出遗传上纯合的系谱, 研究人员通过多代连续自交以确保后代基因的纯合性.而单倍体诱导技术提供了一种更为高效的方法.该技术通过特定的双单倍体(DH)途径, 诱导植物产生仅含1套染色体的细胞, 进而发育成单倍体植株.随后, 利用染色体加倍技术, 将单倍体植株转化为遗传稳定的二倍体植株, 极大地缩短了培育纯合谱系的时间(Ren et al., 2017).基于CRISPR/Cas9技术对玉米中的花粉特异性磷脂酶基因ZmPLA1进行精确编辑, Dong等(2018)成功开发出高效的孤雌生殖单倍体诱导体系; 他们还融入一个组织特异性表达的双荧光蛋白标记系统, 显著优化了单倍体的鉴别和筛选流程, 极大地提高了筛选效率, 并为作物改良中双单倍体育种技术的应用确立了新标准.Stock6 (可诱导产生单倍体的玉米突变体)作为玉米单倍体诱导育种的关键工具, 可通过杂交诱发孤雌生殖, 即使花粉与雌蕊接触, 也不形成正常的双倍体合子, 而是直接形成单倍体种子, 随后通过化学处理或温度震荡等手段进行染色体加倍, 进而形成遗传上纯合的双单倍体植株.Liu等(2017)利用CRISPR/Cas9技术对玉米ZmPLA1基因第1外显子进行精确编辑, 导致特定的缺失突变.编辑后的突变体平均单倍体诱导率约为2%, 与Stock6的诱导效率相似.该研究团队进一步采用CRISPR/Cas9技术敲除ZmDMP基因后, 观察到该基因缺失单倍体诱导率提高5-6倍.这是首次在非Stock6背景下观察到的独立单倍体诱导现象, 展现出基因编辑技术在提高单倍体诱导率方面的巨大应用潜力.通过将CRISPR/Cas9基因编辑技术与传统单倍体诱导策略相结合, 创制了单倍体诱导编辑(haploid-induction editing, HI-Edit)策略(Kelliher et al., 2019)和单倍体诱导介导的基因组编辑(haploid inducer-mediated genome editing, IMGE)策略(Wang et al., 2019a).利用单倍体诱导技术可以高效生成单倍体植株, 随后通过CRISPR/Cas9或其它基因编辑技术进行目标基因的精确修改.HI-Edit策略的独特之处在于, 允许在不引入外源DNA的条件下对基因进行精准改良, 因此显著降低了对转基因技术的依赖.通过这种策略, 可在2个世代内成功培育出特定性状的纯合株系.此外, 该策略有效克服了玉米遗传转化过程中的基因型限制, 为玉米育种提供了更广泛的适用范围.在真核生物中, 着丝粒是染色体准确分离与遗传信息传递不可或缺的区域, 而特异的着丝粒组蛋白CH3 (CENH3)在识别和维持着丝粒染色质结构方面扮演着关键角色.Wang等(2021a)通过CRISPR/Cas9技术对玉米CENH3基因进行编辑, 成功创制了一个由单碱基缺失引起编辑提前终止的突变体.该突变体与野生型进行杂交后, 自交时纯合的突变体具有高度致死性, 无法通过配子传递, 而杂合子与野生型进行正反交配, 后代为单倍体或非整倍体.这表明CENH3突变可通过一次杂交转移到其它品系中, 为构建高效且简化的玉米单倍体诱导系统提供了可能. ...
在自然条件下, 大多数植物(如玉米)表现为二倍体, 即每个细胞含有2套染色体.为培育出遗传上纯合的系谱, 研究人员通过多代连续自交以确保后代基因的纯合性.而单倍体诱导技术提供了一种更为高效的方法.该技术通过特定的双单倍体(DH)途径, 诱导植物产生仅含1套染色体的细胞, 进而发育成单倍体植株.随后, 利用染色体加倍技术, 将单倍体植株转化为遗传稳定的二倍体植株, 极大地缩短了培育纯合谱系的时间(Ren et al., 2017).基于CRISPR/Cas9技术对玉米中的花粉特异性磷脂酶基因ZmPLA1进行精确编辑, Dong等(2018)成功开发出高效的孤雌生殖单倍体诱导体系; 他们还融入一个组织特异性表达的双荧光蛋白标记系统, 显著优化了单倍体的鉴别和筛选流程, 极大地提高了筛选效率, 并为作物改良中双单倍体育种技术的应用确立了新标准.Stock6 (可诱导产生单倍体的玉米突变体)作为玉米单倍体诱导育种的关键工具, 可通过杂交诱发孤雌生殖, 即使花粉与雌蕊接触, 也不形成正常的双倍体合子, 而是直接形成单倍体种子, 随后通过化学处理或温度震荡等手段进行染色体加倍, 进而形成遗传上纯合的双单倍体植株.Liu等(2017)利用CRISPR/Cas9技术对玉米ZmPLA1基因第1外显子进行精确编辑, 导致特定的缺失突变.编辑后的突变体平均单倍体诱导率约为2%, 与Stock6的诱导效率相似.该研究团队进一步采用CRISPR/Cas9技术敲除ZmDMP基因后, 观察到该基因缺失单倍体诱导率提高5-6倍.这是首次在非Stock6背景下观察到的独立单倍体诱导现象, 展现出基因编辑技术在提高单倍体诱导率方面的巨大应用潜力.通过将CRISPR/Cas9基因编辑技术与传统单倍体诱导策略相结合, 创制了单倍体诱导编辑(haploid-induction editing, HI-Edit)策略(Kelliher et al., 2019)和单倍体诱导介导的基因组编辑(haploid inducer-mediated genome editing, IMGE)策略(Wang et al., 2019a).利用单倍体诱导技术可以高效生成单倍体植株, 随后通过CRISPR/Cas9或其它基因编辑技术进行目标基因的精确修改.HI-Edit策略的独特之处在于, 允许在不引入外源DNA的条件下对基因进行精准改良, 因此显著降低了对转基因技术的依赖.通过这种策略, 可在2个世代内成功培育出特定性状的纯合株系.此外, 该策略有效克服了玉米遗传转化过程中的基因型限制, 为玉米育种提供了更广泛的适用范围.在真核生物中, 着丝粒是染色体准确分离与遗传信息传递不可或缺的区域, 而特异的着丝粒组蛋白CH3 (CENH3)在识别和维持着丝粒染色质结构方面扮演着关键角色.Wang等(2021a)通过CRISPR/Cas9技术对玉米CENH3基因进行编辑, 成功创制了一个由单碱基缺失引起编辑提前终止的突变体.该突变体与野生型进行杂交后, 自交时纯合的突变体具有高度致死性, 无法通过配子传递, 而杂合子与野生型进行正反交配, 后代为单倍体或非整倍体.这表明CENH3突变可通过一次杂交转移到其它品系中, 为构建高效且简化的玉米单倍体诱导系统提供了可能. ...
在自然条件下, 大多数植物(如玉米)表现为二倍体, 即每个细胞含有2套染色体.为培育出遗传上纯合的系谱, 研究人员通过多代连续自交以确保后代基因的纯合性.而单倍体诱导技术提供了一种更为高效的方法.该技术通过特定的双单倍体(DH)途径, 诱导植物产生仅含1套染色体的细胞, 进而发育成单倍体植株.随后, 利用染色体加倍技术, 将单倍体植株转化为遗传稳定的二倍体植株, 极大地缩短了培育纯合谱系的时间(Ren et al., 2017).基于CRISPR/Cas9技术对玉米中的花粉特异性磷脂酶基因ZmPLA1进行精确编辑, Dong等(2018)成功开发出高效的孤雌生殖单倍体诱导体系; 他们还融入一个组织特异性表达的双荧光蛋白标记系统, 显著优化了单倍体的鉴别和筛选流程, 极大地提高了筛选效率, 并为作物改良中双单倍体育种技术的应用确立了新标准.Stock6 (可诱导产生单倍体的玉米突变体)作为玉米单倍体诱导育种的关键工具, 可通过杂交诱发孤雌生殖, 即使花粉与雌蕊接触, 也不形成正常的双倍体合子, 而是直接形成单倍体种子, 随后通过化学处理或温度震荡等手段进行染色体加倍, 进而形成遗传上纯合的双单倍体植株.Liu等(2017)利用CRISPR/Cas9技术对玉米ZmPLA1基因第1外显子进行精确编辑, 导致特定的缺失突变.编辑后的突变体平均单倍体诱导率约为2%, 与Stock6的诱导效率相似.该研究团队进一步采用CRISPR/Cas9技术敲除ZmDMP基因后, 观察到该基因缺失单倍体诱导率提高5-6倍.这是首次在非Stock6背景下观察到的独立单倍体诱导现象, 展现出基因编辑技术在提高单倍体诱导率方面的巨大应用潜力.通过将CRISPR/Cas9基因编辑技术与传统单倍体诱导策略相结合, 创制了单倍体诱导编辑(haploid-induction editing, HI-Edit)策略(Kelliher et al., 2019)和单倍体诱导介导的基因组编辑(haploid inducer-mediated genome editing, IMGE)策略(Wang et al., 2019a).利用单倍体诱导技术可以高效生成单倍体植株, 随后通过CRISPR/Cas9或其它基因编辑技术进行目标基因的精确修改.HI-Edit策略的独特之处在于, 允许在不引入外源DNA的条件下对基因进行精准改良, 因此显著降低了对转基因技术的依赖.通过这种策略, 可在2个世代内成功培育出特定性状的纯合株系.此外, 该策略有效克服了玉米遗传转化过程中的基因型限制, 为玉米育种提供了更广泛的适用范围.在真核生物中, 着丝粒是染色体准确分离与遗传信息传递不可或缺的区域, 而特异的着丝粒组蛋白CH3 (CENH3)在识别和维持着丝粒染色质结构方面扮演着关键角色.Wang等(2021a)通过CRISPR/Cas9技术对玉米CENH3基因进行编辑, 成功创制了一个由单碱基缺失引起编辑提前终止的突变体.该突变体与野生型进行杂交后, 自交时纯合的突变体具有高度致死性, 无法通过配子传递, 而杂合子与野生型进行正反交配, 后代为单倍体或非整倍体.这表明CENH3突变可通过一次杂交转移到其它品系中, 为构建高效且简化的玉米单倍体诱导系统提供了可能. ...
在自然条件下, 大多数植物(如玉米)表现为二倍体, 即每个细胞含有2套染色体.为培育出遗传上纯合的系谱, 研究人员通过多代连续自交以确保后代基因的纯合性.而单倍体诱导技术提供了一种更为高效的方法.该技术通过特定的双单倍体(DH)途径, 诱导植物产生仅含1套染色体的细胞, 进而发育成单倍体植株.随后, 利用染色体加倍技术, 将单倍体植株转化为遗传稳定的二倍体植株, 极大地缩短了培育纯合谱系的时间(Ren et al., 2017).基于CRISPR/Cas9技术对玉米中的花粉特异性磷脂酶基因ZmPLA1进行精确编辑, Dong等(2018)成功开发出高效的孤雌生殖单倍体诱导体系; 他们还融入一个组织特异性表达的双荧光蛋白标记系统, 显著优化了单倍体的鉴别和筛选流程, 极大地提高了筛选效率, 并为作物改良中双单倍体育种技术的应用确立了新标准.Stock6 (可诱导产生单倍体的玉米突变体)作为玉米单倍体诱导育种的关键工具, 可通过杂交诱发孤雌生殖, 即使花粉与雌蕊接触, 也不形成正常的双倍体合子, 而是直接形成单倍体种子, 随后通过化学处理或温度震荡等手段进行染色体加倍, 进而形成遗传上纯合的双单倍体植株.Liu等(2017)利用CRISPR/Cas9技术对玉米ZmPLA1基因第1外显子进行精确编辑, 导致特定的缺失突变.编辑后的突变体平均单倍体诱导率约为2%, 与Stock6的诱导效率相似.该研究团队进一步采用CRISPR/Cas9技术敲除ZmDMP基因后, 观察到该基因缺失单倍体诱导率提高5-6倍.这是首次在非Stock6背景下观察到的独立单倍体诱导现象, 展现出基因编辑技术在提高单倍体诱导率方面的巨大应用潜力.通过将CRISPR/Cas9基因编辑技术与传统单倍体诱导策略相结合, 创制了单倍体诱导编辑(haploid-induction editing, HI-Edit)策略(Kelliher et al., 2019)和单倍体诱导介导的基因组编辑(haploid inducer-mediated genome editing, IMGE)策略(Wang et al., 2019a).利用单倍体诱导技术可以高效生成单倍体植株, 随后通过CRISPR/Cas9或其它基因编辑技术进行目标基因的精确修改.HI-Edit策略的独特之处在于, 允许在不引入外源DNA的条件下对基因进行精准改良, 因此显著降低了对转基因技术的依赖.通过这种策略, 可在2个世代内成功培育出特定性状的纯合株系.此外, 该策略有效克服了玉米遗传转化过程中的基因型限制, 为玉米育种提供了更广泛的适用范围.在真核生物中, 着丝粒是染色体准确分离与遗传信息传递不可或缺的区域, 而特异的着丝粒组蛋白CH3 (CENH3)在识别和维持着丝粒染色质结构方面扮演着关键角色.Wang等(2021a)通过CRISPR/Cas9技术对玉米CENH3基因进行编辑, 成功创制了一个由单碱基缺失引起编辑提前终止的突变体.该突变体与野生型进行杂交后, 自交时纯合的突变体具有高度致死性, 无法通过配子传递, 而杂合子与野生型进行正反交配, 后代为单倍体或非整倍体.这表明CENH3突变可通过一次杂交转移到其它品系中, 为构建高效且简化的玉米单倍体诱导系统提供了可能. ...
在自然条件下, 大多数植物(如玉米)表现为二倍体, 即每个细胞含有2套染色体.为培育出遗传上纯合的系谱, 研究人员通过多代连续自交以确保后代基因的纯合性.而单倍体诱导技术提供了一种更为高效的方法.该技术通过特定的双单倍体(DH)途径, 诱导植物产生仅含1套染色体的细胞, 进而发育成单倍体植株.随后, 利用染色体加倍技术, 将单倍体植株转化为遗传稳定的二倍体植株, 极大地缩短了培育纯合谱系的时间(Ren et al., 2017).基于CRISPR/Cas9技术对玉米中的花粉特异性磷脂酶基因ZmPLA1进行精确编辑, Dong等(2018)成功开发出高效的孤雌生殖单倍体诱导体系; 他们还融入一个组织特异性表达的双荧光蛋白标记系统, 显著优化了单倍体的鉴别和筛选流程, 极大地提高了筛选效率, 并为作物改良中双单倍体育种技术的应用确立了新标准.Stock6 (可诱导产生单倍体的玉米突变体)作为玉米单倍体诱导育种的关键工具, 可通过杂交诱发孤雌生殖, 即使花粉与雌蕊接触, 也不形成正常的双倍体合子, 而是直接形成单倍体种子, 随后通过化学处理或温度震荡等手段进行染色体加倍, 进而形成遗传上纯合的双单倍体植株.Liu等(2017)利用CRISPR/Cas9技术对玉米ZmPLA1基因第1外显子进行精确编辑, 导致特定的缺失突变.编辑后的突变体平均单倍体诱导率约为2%, 与Stock6的诱导效率相似.该研究团队进一步采用CRISPR/Cas9技术敲除ZmDMP基因后, 观察到该基因缺失单倍体诱导率提高5-6倍.这是首次在非Stock6背景下观察到的独立单倍体诱导现象, 展现出基因编辑技术在提高单倍体诱导率方面的巨大应用潜力.通过将CRISPR/Cas9基因编辑技术与传统单倍体诱导策略相结合, 创制了单倍体诱导编辑(haploid-induction editing, HI-Edit)策略(Kelliher et al., 2019)和单倍体诱导介导的基因组编辑(haploid inducer-mediated genome editing, IMGE)策略(Wang et al., 2019a).利用单倍体诱导技术可以高效生成单倍体植株, 随后通过CRISPR/Cas9或其它基因编辑技术进行目标基因的精确修改.HI-Edit策略的独特之处在于, 允许在不引入外源DNA的条件下对基因进行精准改良, 因此显著降低了对转基因技术的依赖.通过这种策略, 可在2个世代内成功培育出特定性状的纯合株系.此外, 该策略有效克服了玉米遗传转化过程中的基因型限制, 为玉米育种提供了更广泛的适用范围.在真核生物中, 着丝粒是染色体准确分离与遗传信息传递不可或缺的区域, 而特异的着丝粒组蛋白CH3 (CENH3)在识别和维持着丝粒染色质结构方面扮演着关键角色.Wang等(2021a)通过CRISPR/Cas9技术对玉米CENH3基因进行编辑, 成功创制了一个由单碱基缺失引起编辑提前终止的突变体.该突变体与野生型进行杂交后, 自交时纯合的突变体具有高度致死性, 无法通过配子传递, 而杂合子与野生型进行正反交配, 后代为单倍体或非整倍体.这表明CENH3突变可通过一次杂交转移到其它品系中, 为构建高效且简化的玉米单倍体诱导系统提供了可能. ...
在自然条件下, 大多数植物(如玉米)表现为二倍体, 即每个细胞含有2套染色体.为培育出遗传上纯合的系谱, 研究人员通过多代连续自交以确保后代基因的纯合性.而单倍体诱导技术提供了一种更为高效的方法.该技术通过特定的双单倍体(DH)途径, 诱导植物产生仅含1套染色体的细胞, 进而发育成单倍体植株.随后, 利用染色体加倍技术, 将单倍体植株转化为遗传稳定的二倍体植株, 极大地缩短了培育纯合谱系的时间(Ren et al., 2017).基于CRISPR/Cas9技术对玉米中的花粉特异性磷脂酶基因ZmPLA1进行精确编辑, Dong等(2018)成功开发出高效的孤雌生殖单倍体诱导体系; 他们还融入一个组织特异性表达的双荧光蛋白标记系统, 显著优化了单倍体的鉴别和筛选流程, 极大地提高了筛选效率, 并为作物改良中双单倍体育种技术的应用确立了新标准.Stock6 (可诱导产生单倍体的玉米突变体)作为玉米单倍体诱导育种的关键工具, 可通过杂交诱发孤雌生殖, 即使花粉与雌蕊接触, 也不形成正常的双倍体合子, 而是直接形成单倍体种子, 随后通过化学处理或温度震荡等手段进行染色体加倍, 进而形成遗传上纯合的双单倍体植株.Liu等(2017)利用CRISPR/Cas9技术对玉米ZmPLA1基因第1外显子进行精确编辑, 导致特定的缺失突变.编辑后的突变体平均单倍体诱导率约为2%, 与Stock6的诱导效率相似.该研究团队进一步采用CRISPR/Cas9技术敲除ZmDMP基因后, 观察到该基因缺失单倍体诱导率提高5-6倍.这是首次在非Stock6背景下观察到的独立单倍体诱导现象, 展现出基因编辑技术在提高单倍体诱导率方面的巨大应用潜力.通过将CRISPR/Cas9基因编辑技术与传统单倍体诱导策略相结合, 创制了单倍体诱导编辑(haploid-induction editing, HI-Edit)策略(Kelliher et al., 2019)和单倍体诱导介导的基因组编辑(haploid inducer-mediated genome editing, IMGE)策略(Wang et al., 2019a).利用单倍体诱导技术可以高效生成单倍体植株, 随后通过CRISPR/Cas9或其它基因编辑技术进行目标基因的精确修改.HI-Edit策略的独特之处在于, 允许在不引入外源DNA的条件下对基因进行精准改良, 因此显著降低了对转基因技术的依赖.通过这种策略, 可在2个世代内成功培育出特定性状的纯合株系.此外, 该策略有效克服了玉米遗传转化过程中的基因型限制, 为玉米育种提供了更广泛的适用范围.在真核生物中, 着丝粒是染色体准确分离与遗传信息传递不可或缺的区域, 而特异的着丝粒组蛋白CH3 (CENH3)在识别和维持着丝粒染色质结构方面扮演着关键角色.Wang等(2021a)通过CRISPR/Cas9技术对玉米CENH3基因进行编辑, 成功创制了一个由单碱基缺失引起编辑提前终止的突变体.该突变体与野生型进行杂交后, 自交时纯合的突变体具有高度致死性, 无法通过配子传递, 而杂合子与野生型进行正反交配, 后代为单倍体或非整倍体.这表明CENH3突变可通过一次杂交转移到其它品系中, 为构建高效且简化的玉米单倍体诱导系统提供了可能. ...
在自然条件下, 大多数植物(如玉米)表现为二倍体, 即每个细胞含有2套染色体.为培育出遗传上纯合的系谱, 研究人员通过多代连续自交以确保后代基因的纯合性.而单倍体诱导技术提供了一种更为高效的方法.该技术通过特定的双单倍体(DH)途径, 诱导植物产生仅含1套染色体的细胞, 进而发育成单倍体植株.随后, 利用染色体加倍技术, 将单倍体植株转化为遗传稳定的二倍体植株, 极大地缩短了培育纯合谱系的时间(Ren et al., 2017).基于CRISPR/Cas9技术对玉米中的花粉特异性磷脂酶基因ZmPLA1进行精确编辑, Dong等(2018)成功开发出高效的孤雌生殖单倍体诱导体系; 他们还融入一个组织特异性表达的双荧光蛋白标记系统, 显著优化了单倍体的鉴别和筛选流程, 极大地提高了筛选效率, 并为作物改良中双单倍体育种技术的应用确立了新标准.Stock6 (可诱导产生单倍体的玉米突变体)作为玉米单倍体诱导育种的关键工具, 可通过杂交诱发孤雌生殖, 即使花粉与雌蕊接触, 也不形成正常的双倍体合子, 而是直接形成单倍体种子, 随后通过化学处理或温度震荡等手段进行染色体加倍, 进而形成遗传上纯合的双单倍体植株.Liu等(2017)利用CRISPR/Cas9技术对玉米ZmPLA1基因第1外显子进行精确编辑, 导致特定的缺失突变.编辑后的突变体平均单倍体诱导率约为2%, 与Stock6的诱导效率相似.该研究团队进一步采用CRISPR/Cas9技术敲除ZmDMP基因后, 观察到该基因缺失单倍体诱导率提高5-6倍.这是首次在非Stock6背景下观察到的独立单倍体诱导现象, 展现出基因编辑技术在提高单倍体诱导率方面的巨大应用潜力.通过将CRISPR/Cas9基因编辑技术与传统单倍体诱导策略相结合, 创制了单倍体诱导编辑(haploid-induction editing, HI-Edit)策略(Kelliher et al., 2019)和单倍体诱导介导的基因组编辑(haploid inducer-mediated genome editing, IMGE)策略(Wang et al., 2019a).利用单倍体诱导技术可以高效生成单倍体植株, 随后通过CRISPR/Cas9或其它基因编辑技术进行目标基因的精确修改.HI-Edit策略的独特之处在于, 允许在不引入外源DNA的条件下对基因进行精准改良, 因此显著降低了对转基因技术的依赖.通过这种策略, 可在2个世代内成功培育出特定性状的纯合株系.此外, 该策略有效克服了玉米遗传转化过程中的基因型限制, 为玉米育种提供了更广泛的适用范围.在真核生物中, 着丝粒是染色体准确分离与遗传信息传递不可或缺的区域, 而特异的着丝粒组蛋白CH3 (CENH3)在识别和维持着丝粒染色质结构方面扮演着关键角色.Wang等(2021a)通过CRISPR/Cas9技术对玉米CENH3基因进行编辑, 成功创制了一个由单碱基缺失引起编辑提前终止的突变体.该突变体与野生型进行杂交后, 自交时纯合的突变体具有高度致死性, 无法通过配子传递, 而杂合子与野生型进行正反交配, 后代为单倍体或非整倍体.这表明CENH3突变可通过一次杂交转移到其它品系中, 为构建高效且简化的玉米单倍体诱导系统提供了可能. ...
在自然条件下, 大多数植物(如玉米)表现为二倍体, 即每个细胞含有2套染色体.为培育出遗传上纯合的系谱, 研究人员通过多代连续自交以确保后代基因的纯合性.而单倍体诱导技术提供了一种更为高效的方法.该技术通过特定的双单倍体(DH)途径, 诱导植物产生仅含1套染色体的细胞, 进而发育成单倍体植株.随后, 利用染色体加倍技术, 将单倍体植株转化为遗传稳定的二倍体植株, 极大地缩短了培育纯合谱系的时间(Ren et al., 2017).基于CRISPR/Cas9技术对玉米中的花粉特异性磷脂酶基因ZmPLA1进行精确编辑, Dong等(2018)成功开发出高效的孤雌生殖单倍体诱导体系; 他们还融入一个组织特异性表达的双荧光蛋白标记系统, 显著优化了单倍体的鉴别和筛选流程, 极大地提高了筛选效率, 并为作物改良中双单倍体育种技术的应用确立了新标准.Stock6 (可诱导产生单倍体的玉米突变体)作为玉米单倍体诱导育种的关键工具, 可通过杂交诱发孤雌生殖, 即使花粉与雌蕊接触, 也不形成正常的双倍体合子, 而是直接形成单倍体种子, 随后通过化学处理或温度震荡等手段进行染色体加倍, 进而形成遗传上纯合的双单倍体植株.Liu等(2017)利用CRISPR/Cas9技术对玉米ZmPLA1基因第1外显子进行精确编辑, 导致特定的缺失突变.编辑后的突变体平均单倍体诱导率约为2%, 与Stock6的诱导效率相似.该研究团队进一步采用CRISPR/Cas9技术敲除ZmDMP基因后, 观察到该基因缺失单倍体诱导率提高5-6倍.这是首次在非Stock6背景下观察到的独立单倍体诱导现象, 展现出基因编辑技术在提高单倍体诱导率方面的巨大应用潜力.通过将CRISPR/Cas9基因编辑技术与传统单倍体诱导策略相结合, 创制了单倍体诱导编辑(haploid-induction editing, HI-Edit)策略(Kelliher et al., 2019)和单倍体诱导介导的基因组编辑(haploid inducer-mediated genome editing, IMGE)策略(Wang et al., 2019a).利用单倍体诱导技术可以高效生成单倍体植株, 随后通过CRISPR/Cas9或其它基因编辑技术进行目标基因的精确修改.HI-Edit策略的独特之处在于, 允许在不引入外源DNA的条件下对基因进行精准改良, 因此显著降低了对转基因技术的依赖.通过这种策略, 可在2个世代内成功培育出特定性状的纯合株系.此外, 该策略有效克服了玉米遗传转化过程中的基因型限制, 为玉米育种提供了更广泛的适用范围.在真核生物中, 着丝粒是染色体准确分离与遗传信息传递不可或缺的区域, 而特异的着丝粒组蛋白CH3 (CENH3)在识别和维持着丝粒染色质结构方面扮演着关键角色.Wang等(2021a)通过CRISPR/Cas9技术对玉米CENH3基因进行编辑, 成功创制了一个由单碱基缺失引起编辑提前终止的突变体.该突变体与野生型进行杂交后, 自交时纯合的突变体具有高度致死性, 无法通过配子传递, 而杂合子与野生型进行正反交配, 后代为单倍体或非整倍体.这表明CENH3突变可通过一次杂交转移到其它品系中, 为构建高效且简化的玉米单倍体诱导系统提供了可能. ...
在自然条件下, 大多数植物(如玉米)表现为二倍体, 即每个细胞含有2套染色体.为培育出遗传上纯合的系谱, 研究人员通过多代连续自交以确保后代基因的纯合性.而单倍体诱导技术提供了一种更为高效的方法.该技术通过特定的双单倍体(DH)途径, 诱导植物产生仅含1套染色体的细胞, 进而发育成单倍体植株.随后, 利用染色体加倍技术, 将单倍体植株转化为遗传稳定的二倍体植株, 极大地缩短了培育纯合谱系的时间(Ren et al., 2017).基于CRISPR/Cas9技术对玉米中的花粉特异性磷脂酶基因ZmPLA1进行精确编辑, Dong等(2018)成功开发出高效的孤雌生殖单倍体诱导体系; 他们还融入一个组织特异性表达的双荧光蛋白标记系统, 显著优化了单倍体的鉴别和筛选流程, 极大地提高了筛选效率, 并为作物改良中双单倍体育种技术的应用确立了新标准.Stock6 (可诱导产生单倍体的玉米突变体)作为玉米单倍体诱导育种的关键工具, 可通过杂交诱发孤雌生殖, 即使花粉与雌蕊接触, 也不形成正常的双倍体合子, 而是直接形成单倍体种子, 随后通过化学处理或温度震荡等手段进行染色体加倍, 进而形成遗传上纯合的双单倍体植株.Liu等(2017)利用CRISPR/Cas9技术对玉米ZmPLA1基因第1外显子进行精确编辑, 导致特定的缺失突变.编辑后的突变体平均单倍体诱导率约为2%, 与Stock6的诱导效率相似.该研究团队进一步采用CRISPR/Cas9技术敲除ZmDMP基因后, 观察到该基因缺失单倍体诱导率提高5-6倍.这是首次在非Stock6背景下观察到的独立单倍体诱导现象, 展现出基因编辑技术在提高单倍体诱导率方面的巨大应用潜力.通过将CRISPR/Cas9基因编辑技术与传统单倍体诱导策略相结合, 创制了单倍体诱导编辑(haploid-induction editing, HI-Edit)策略(Kelliher et al., 2019)和单倍体诱导介导的基因组编辑(haploid inducer-mediated genome editing, IMGE)策略(Wang et al., 2019a).利用单倍体诱导技术可以高效生成单倍体植株, 随后通过CRISPR/Cas9或其它基因编辑技术进行目标基因的精确修改.HI-Edit策略的独特之处在于, 允许在不引入外源DNA的条件下对基因进行精准改良, 因此显著降低了对转基因技术的依赖.通过这种策略, 可在2个世代内成功培育出特定性状的纯合株系.此外, 该策略有效克服了玉米遗传转化过程中的基因型限制, 为玉米育种提供了更广泛的适用范围.在真核生物中, 着丝粒是染色体准确分离与遗传信息传递不可或缺的区域, 而特异的着丝粒组蛋白CH3 (CENH3)在识别和维持着丝粒染色质结构方面扮演着关键角色.Wang等(2021a)通过CRISPR/Cas9技术对玉米CENH3基因进行编辑, 成功创制了一个由单碱基缺失引起编辑提前终止的突变体.该突变体与野生型进行杂交后, 自交时纯合的突变体具有高度致死性, 无法通过配子传递, 而杂合子与野生型进行正反交配, 后代为单倍体或非整倍体.这表明CENH3突变可通过一次杂交转移到其它品系中, 为构建高效且简化的玉米单倍体诱导系统提供了可能. ...
在自然条件下, 大多数植物(如玉米)表现为二倍体, 即每个细胞含有2套染色体.为培育出遗传上纯合的系谱, 研究人员通过多代连续自交以确保后代基因的纯合性.而单倍体诱导技术提供了一种更为高效的方法.该技术通过特定的双单倍体(DH)途径, 诱导植物产生仅含1套染色体的细胞, 进而发育成单倍体植株.随后, 利用染色体加倍技术, 将单倍体植株转化为遗传稳定的二倍体植株, 极大地缩短了培育纯合谱系的时间(Ren et al., 2017).基于CRISPR/Cas9技术对玉米中的花粉特异性磷脂酶基因ZmPLA1进行精确编辑, Dong等(2018)成功开发出高效的孤雌生殖单倍体诱导体系; 他们还融入一个组织特异性表达的双荧光蛋白标记系统, 显著优化了单倍体的鉴别和筛选流程, 极大地提高了筛选效率, 并为作物改良中双单倍体育种技术的应用确立了新标准.Stock6 (可诱导产生单倍体的玉米突变体)作为玉米单倍体诱导育种的关键工具, 可通过杂交诱发孤雌生殖, 即使花粉与雌蕊接触, 也不形成正常的双倍体合子, 而是直接形成单倍体种子, 随后通过化学处理或温度震荡等手段进行染色体加倍, 进而形成遗传上纯合的双单倍体植株.Liu等(2017)利用CRISPR/Cas9技术对玉米ZmPLA1基因第1外显子进行精确编辑, 导致特定的缺失突变.编辑后的突变体平均单倍体诱导率约为2%, 与Stock6的诱导效率相似.该研究团队进一步采用CRISPR/Cas9技术敲除ZmDMP基因后, 观察到该基因缺失单倍体诱导率提高5-6倍.这是首次在非Stock6背景下观察到的独立单倍体诱导现象, 展现出基因编辑技术在提高单倍体诱导率方面的巨大应用潜力.通过将CRISPR/Cas9基因编辑技术与传统单倍体诱导策略相结合, 创制了单倍体诱导编辑(haploid-induction editing, HI-Edit)策略(Kelliher et al., 2019)和单倍体诱导介导的基因组编辑(haploid inducer-mediated genome editing, IMGE)策略(Wang et al., 2019a).利用单倍体诱导技术可以高效生成单倍体植株, 随后通过CRISPR/Cas9或其它基因编辑技术进行目标基因的精确修改.HI-Edit策略的独特之处在于, 允许在不引入外源DNA的条件下对基因进行精准改良, 因此显著降低了对转基因技术的依赖.通过这种策略, 可在2个世代内成功培育出特定性状的纯合株系.此外, 该策略有效克服了玉米遗传转化过程中的基因型限制, 为玉米育种提供了更广泛的适用范围.在真核生物中, 着丝粒是染色体准确分离与遗传信息传递不可或缺的区域, 而特异的着丝粒组蛋白CH3 (CENH3)在识别和维持着丝粒染色质结构方面扮演着关键角色.Wang等(2021a)通过CRISPR/Cas9技术对玉米CENH3基因进行编辑, 成功创制了一个由单碱基缺失引起编辑提前终止的突变体.该突变体与野生型进行杂交后, 自交时纯合的突变体具有高度致死性, 无法通过配子传递, 而杂合子与野生型进行正反交配, 后代为单倍体或非整倍体.这表明CENH3突变可通过一次杂交转移到其它品系中, 为构建高效且简化的玉米单倍体诱导系统提供了可能. ...
在自然条件下, 大多数植物(如玉米)表现为二倍体, 即每个细胞含有2套染色体.为培育出遗传上纯合的系谱, 研究人员通过多代连续自交以确保后代基因的纯合性.而单倍体诱导技术提供了一种更为高效的方法.该技术通过特定的双单倍体(DH)途径, 诱导植物产生仅含1套染色体的细胞, 进而发育成单倍体植株.随后, 利用染色体加倍技术, 将单倍体植株转化为遗传稳定的二倍体植株, 极大地缩短了培育纯合谱系的时间(Ren et al., 2017).基于CRISPR/Cas9技术对玉米中的花粉特异性磷脂酶基因ZmPLA1进行精确编辑, Dong等(2018)成功开发出高效的孤雌生殖单倍体诱导体系; 他们还融入一个组织特异性表达的双荧光蛋白标记系统, 显著优化了单倍体的鉴别和筛选流程, 极大地提高了筛选效率, 并为作物改良中双单倍体育种技术的应用确立了新标准.Stock6 (可诱导产生单倍体的玉米突变体)作为玉米单倍体诱导育种的关键工具, 可通过杂交诱发孤雌生殖, 即使花粉与雌蕊接触, 也不形成正常的双倍体合子, 而是直接形成单倍体种子, 随后通过化学处理或温度震荡等手段进行染色体加倍, 进而形成遗传上纯合的双单倍体植株.Liu等(2017)利用CRISPR/Cas9技术对玉米ZmPLA1基因第1外显子进行精确编辑, 导致特定的缺失突变.编辑后的突变体平均单倍体诱导率约为2%, 与Stock6的诱导效率相似.该研究团队进一步采用CRISPR/Cas9技术敲除ZmDMP基因后, 观察到该基因缺失单倍体诱导率提高5-6倍.这是首次在非Stock6背景下观察到的独立单倍体诱导现象, 展现出基因编辑技术在提高单倍体诱导率方面的巨大应用潜力.通过将CRISPR/Cas9基因编辑技术与传统单倍体诱导策略相结合, 创制了单倍体诱导编辑(haploid-induction editing, HI-Edit)策略(Kelliher et al., 2019)和单倍体诱导介导的基因组编辑(haploid inducer-mediated genome editing, IMGE)策略(Wang et al., 2019a).利用单倍体诱导技术可以高效生成单倍体植株, 随后通过CRISPR/Cas9或其它基因编辑技术进行目标基因的精确修改.HI-Edit策略的独特之处在于, 允许在不引入外源DNA的条件下对基因进行精准改良, 因此显著降低了对转基因技术的依赖.通过这种策略, 可在2个世代内成功培育出特定性状的纯合株系.此外, 该策略有效克服了玉米遗传转化过程中的基因型限制, 为玉米育种提供了更广泛的适用范围.在真核生物中, 着丝粒是染色体准确分离与遗传信息传递不可或缺的区域, 而特异的着丝粒组蛋白CH3 (CENH3)在识别和维持着丝粒染色质结构方面扮演着关键角色.Wang等(2021a)通过CRISPR/Cas9技术对玉米CENH3基因进行编辑, 成功创制了一个由单碱基缺失引起编辑提前终止的突变体.该突变体与野生型进行杂交后, 自交时纯合的突变体具有高度致死性, 无法通过配子传递, 而杂合子与野生型进行正反交配, 后代为单倍体或非整倍体.这表明CENH3突变可通过一次杂交转移到其它品系中, 为构建高效且简化的玉米单倍体诱导系统提供了可能. ...
在自然条件下, 大多数植物(如玉米)表现为二倍体, 即每个细胞含有2套染色体.为培育出遗传上纯合的系谱, 研究人员通过多代连续自交以确保后代基因的纯合性.而单倍体诱导技术提供了一种更为高效的方法.该技术通过特定的双单倍体(DH)途径, 诱导植物产生仅含1套染色体的细胞, 进而发育成单倍体植株.随后, 利用染色体加倍技术, 将单倍体植株转化为遗传稳定的二倍体植株, 极大地缩短了培育纯合谱系的时间(Ren et al., 2017).基于CRISPR/Cas9技术对玉米中的花粉特异性磷脂酶基因ZmPLA1进行精确编辑, Dong等(2018)成功开发出高效的孤雌生殖单倍体诱导体系; 他们还融入一个组织特异性表达的双荧光蛋白标记系统, 显著优化了单倍体的鉴别和筛选流程, 极大地提高了筛选效率, 并为作物改良中双单倍体育种技术的应用确立了新标准.Stock6 (可诱导产生单倍体的玉米突变体)作为玉米单倍体诱导育种的关键工具, 可通过杂交诱发孤雌生殖, 即使花粉与雌蕊接触, 也不形成正常的双倍体合子, 而是直接形成单倍体种子, 随后通过化学处理或温度震荡等手段进行染色体加倍, 进而形成遗传上纯合的双单倍体植株.Liu等(2017)利用CRISPR/Cas9技术对玉米ZmPLA1基因第1外显子进行精确编辑, 导致特定的缺失突变.编辑后的突变体平均单倍体诱导率约为2%, 与Stock6的诱导效率相似.该研究团队进一步采用CRISPR/Cas9技术敲除ZmDMP基因后, 观察到该基因缺失单倍体诱导率提高5-6倍.这是首次在非Stock6背景下观察到的独立单倍体诱导现象, 展现出基因编辑技术在提高单倍体诱导率方面的巨大应用潜力.通过将CRISPR/Cas9基因编辑技术与传统单倍体诱导策略相结合, 创制了单倍体诱导编辑(haploid-induction editing, HI-Edit)策略(Kelliher et al., 2019)和单倍体诱导介导的基因组编辑(haploid inducer-mediated genome editing, IMGE)策略(Wang et al., 2019a).利用单倍体诱导技术可以高效生成单倍体植株, 随后通过CRISPR/Cas9或其它基因编辑技术进行目标基因的精确修改.HI-Edit策略的独特之处在于, 允许在不引入外源DNA的条件下对基因进行精准改良, 因此显著降低了对转基因技术的依赖.通过这种策略, 可在2个世代内成功培育出特定性状的纯合株系.此外, 该策略有效克服了玉米遗传转化过程中的基因型限制, 为玉米育种提供了更广泛的适用范围.在真核生物中, 着丝粒是染色体准确分离与遗传信息传递不可或缺的区域, 而特异的着丝粒组蛋白CH3 (CENH3)在识别和维持着丝粒染色质结构方面扮演着关键角色.Wang等(2021a)通过CRISPR/Cas9技术对玉米CENH3基因进行编辑, 成功创制了一个由单碱基缺失引起编辑提前终止的突变体.该突变体与野生型进行杂交后, 自交时纯合的突变体具有高度致死性, 无法通过配子传递, 而杂合子与野生型进行正反交配, 后代为单倍体或非整倍体.这表明CENH3突变可通过一次杂交转移到其它品系中, 为构建高效且简化的玉米单倍体诱导系统提供了可能. ...
在自然条件下, 大多数植物(如玉米)表现为二倍体, 即每个细胞含有2套染色体.为培育出遗传上纯合的系谱, 研究人员通过多代连续自交以确保后代基因的纯合性.而单倍体诱导技术提供了一种更为高效的方法.该技术通过特定的双单倍体(DH)途径, 诱导植物产生仅含1套染色体的细胞, 进而发育成单倍体植株.随后, 利用染色体加倍技术, 将单倍体植株转化为遗传稳定的二倍体植株, 极大地缩短了培育纯合谱系的时间(Ren et al., 2017).基于CRISPR/Cas9技术对玉米中的花粉特异性磷脂酶基因ZmPLA1进行精确编辑, Dong等(2018)成功开发出高效的孤雌生殖单倍体诱导体系; 他们还融入一个组织特异性表达的双荧光蛋白标记系统, 显著优化了单倍体的鉴别和筛选流程, 极大地提高了筛选效率, 并为作物改良中双单倍体育种技术的应用确立了新标准.Stock6 (可诱导产生单倍体的玉米突变体)作为玉米单倍体诱导育种的关键工具, 可通过杂交诱发孤雌生殖, 即使花粉与雌蕊接触, 也不形成正常的双倍体合子, 而是直接形成单倍体种子, 随后通过化学处理或温度震荡等手段进行染色体加倍, 进而形成遗传上纯合的双单倍体植株.Liu等(2017)利用CRISPR/Cas9技术对玉米ZmPLA1基因第1外显子进行精确编辑, 导致特定的缺失突变.编辑后的突变体平均单倍体诱导率约为2%, 与Stock6的诱导效率相似.该研究团队进一步采用CRISPR/Cas9技术敲除ZmDMP基因后, 观察到该基因缺失单倍体诱导率提高5-6倍.这是首次在非Stock6背景下观察到的独立单倍体诱导现象, 展现出基因编辑技术在提高单倍体诱导率方面的巨大应用潜力.通过将CRISPR/Cas9基因编辑技术与传统单倍体诱导策略相结合, 创制了单倍体诱导编辑(haploid-induction editing, HI-Edit)策略(Kelliher et al., 2019)和单倍体诱导介导的基因组编辑(haploid inducer-mediated genome editing, IMGE)策略(Wang et al., 2019a).利用单倍体诱导技术可以高效生成单倍体植株, 随后通过CRISPR/Cas9或其它基因编辑技术进行目标基因的精确修改.HI-Edit策略的独特之处在于, 允许在不引入外源DNA的条件下对基因进行精准改良, 因此显著降低了对转基因技术的依赖.通过这种策略, 可在2个世代内成功培育出特定性状的纯合株系.此外, 该策略有效克服了玉米遗传转化过程中的基因型限制, 为玉米育种提供了更广泛的适用范围.在真核生物中, 着丝粒是染色体准确分离与遗传信息传递不可或缺的区域, 而特异的着丝粒组蛋白CH3 (CENH3)在识别和维持着丝粒染色质结构方面扮演着关键角色.Wang等(2021a)通过CRISPR/Cas9技术对玉米CENH3基因进行编辑, 成功创制了一个由单碱基缺失引起编辑提前终止的突变体.该突变体与野生型进行杂交后, 自交时纯合的突变体具有高度致死性, 无法通过配子传递, 而杂合子与野生型进行正反交配, 后代为单倍体或非整倍体.这表明CENH3突变可通过一次杂交转移到其它品系中, 为构建高效且简化的玉米单倍体诱导系统提供了可能. ...
在自然条件下, 大多数植物(如玉米)表现为二倍体, 即每个细胞含有2套染色体.为培育出遗传上纯合的系谱, 研究人员通过多代连续自交以确保后代基因的纯合性.而单倍体诱导技术提供了一种更为高效的方法.该技术通过特定的双单倍体(DH)途径, 诱导植物产生仅含1套染色体的细胞, 进而发育成单倍体植株.随后, 利用染色体加倍技术, 将单倍体植株转化为遗传稳定的二倍体植株, 极大地缩短了培育纯合谱系的时间(Ren et al., 2017).基于CRISPR/Cas9技术对玉米中的花粉特异性磷脂酶基因ZmPLA1进行精确编辑, Dong等(2018)成功开发出高效的孤雌生殖单倍体诱导体系; 他们还融入一个组织特异性表达的双荧光蛋白标记系统, 显著优化了单倍体的鉴别和筛选流程, 极大地提高了筛选效率, 并为作物改良中双单倍体育种技术的应用确立了新标准.Stock6 (可诱导产生单倍体的玉米突变体)作为玉米单倍体诱导育种的关键工具, 可通过杂交诱发孤雌生殖, 即使花粉与雌蕊接触, 也不形成正常的双倍体合子, 而是直接形成单倍体种子, 随后通过化学处理或温度震荡等手段进行染色体加倍, 进而形成遗传上纯合的双单倍体植株.Liu等(2017)利用CRISPR/Cas9技术对玉米ZmPLA1基因第1外显子进行精确编辑, 导致特定的缺失突变.编辑后的突变体平均单倍体诱导率约为2%, 与Stock6的诱导效率相似.该研究团队进一步采用CRISPR/Cas9技术敲除ZmDMP基因后, 观察到该基因缺失单倍体诱导率提高5-6倍.这是首次在非Stock6背景下观察到的独立单倍体诱导现象, 展现出基因编辑技术在提高单倍体诱导率方面的巨大应用潜力.通过将CRISPR/Cas9基因编辑技术与传统单倍体诱导策略相结合, 创制了单倍体诱导编辑(haploid-induction editing, HI-Edit)策略(Kelliher et al., 2019)和单倍体诱导介导的基因组编辑(haploid inducer-mediated genome editing, IMGE)策略(Wang et al., 2019a).利用单倍体诱导技术可以高效生成单倍体植株, 随后通过CRISPR/Cas9或其它基因编辑技术进行目标基因的精确修改.HI-Edit策略的独特之处在于, 允许在不引入外源DNA的条件下对基因进行精准改良, 因此显著降低了对转基因技术的依赖.通过这种策略, 可在2个世代内成功培育出特定性状的纯合株系.此外, 该策略有效克服了玉米遗传转化过程中的基因型限制, 为玉米育种提供了更广泛的适用范围.在真核生物中, 着丝粒是染色体准确分离与遗传信息传递不可或缺的区域, 而特异的着丝粒组蛋白CH3 (CENH3)在识别和维持着丝粒染色质结构方面扮演着关键角色.Wang等(2021a)通过CRISPR/Cas9技术对玉米CENH3基因进行编辑, 成功创制了一个由单碱基缺失引起编辑提前终止的突变体.该突变体与野生型进行杂交后, 自交时纯合的突变体具有高度致死性, 无法通过配子传递, 而杂合子与野生型进行正反交配, 后代为单倍体或非整倍体.这表明CENH3突变可通过一次杂交转移到其它品系中, 为构建高效且简化的玉米单倍体诱导系统提供了可能. ...
在自然条件下, 大多数植物(如玉米)表现为二倍体, 即每个细胞含有2套染色体.为培育出遗传上纯合的系谱, 研究人员通过多代连续自交以确保后代基因的纯合性.而单倍体诱导技术提供了一种更为高效的方法.该技术通过特定的双单倍体(DH)途径, 诱导植物产生仅含1套染色体的细胞, 进而发育成单倍体植株.随后, 利用染色体加倍技术, 将单倍体植株转化为遗传稳定的二倍体植株, 极大地缩短了培育纯合谱系的时间(Ren et al., 2017).基于CRISPR/Cas9技术对玉米中的花粉特异性磷脂酶基因ZmPLA1进行精确编辑, Dong等(2018)成功开发出高效的孤雌生殖单倍体诱导体系; 他们还融入一个组织特异性表达的双荧光蛋白标记系统, 显著优化了单倍体的鉴别和筛选流程, 极大地提高了筛选效率, 并为作物改良中双单倍体育种技术的应用确立了新标准.Stock6 (可诱导产生单倍体的玉米突变体)作为玉米单倍体诱导育种的关键工具, 可通过杂交诱发孤雌生殖, 即使花粉与雌蕊接触, 也不形成正常的双倍体合子, 而是直接形成单倍体种子, 随后通过化学处理或温度震荡等手段进行染色体加倍, 进而形成遗传上纯合的双单倍体植株.Liu等(2017)利用CRISPR/Cas9技术对玉米ZmPLA1基因第1外显子进行精确编辑, 导致特定的缺失突变.编辑后的突变体平均单倍体诱导率约为2%, 与Stock6的诱导效率相似.该研究团队进一步采用CRISPR/Cas9技术敲除ZmDMP基因后, 观察到该基因缺失单倍体诱导率提高5-6倍.这是首次在非Stock6背景下观察到的独立单倍体诱导现象, 展现出基因编辑技术在提高单倍体诱导率方面的巨大应用潜力.通过将CRISPR/Cas9基因编辑技术与传统单倍体诱导策略相结合, 创制了单倍体诱导编辑(haploid-induction editing, HI-Edit)策略(Kelliher et al., 2019)和单倍体诱导介导的基因组编辑(haploid inducer-mediated genome editing, IMGE)策略(Wang et al., 2019a).利用单倍体诱导技术可以高效生成单倍体植株, 随后通过CRISPR/Cas9或其它基因编辑技术进行目标基因的精确修改.HI-Edit策略的独特之处在于, 允许在不引入外源DNA的条件下对基因进行精准改良, 因此显著降低了对转基因技术的依赖.通过这种策略, 可在2个世代内成功培育出特定性状的纯合株系.此外, 该策略有效克服了玉米遗传转化过程中的基因型限制, 为玉米育种提供了更广泛的适用范围.在真核生物中, 着丝粒是染色体准确分离与遗传信息传递不可或缺的区域, 而特异的着丝粒组蛋白CH3 (CENH3)在识别和维持着丝粒染色质结构方面扮演着关键角色.Wang等(2021a)通过CRISPR/Cas9技术对玉米CENH3基因进行编辑, 成功创制了一个由单碱基缺失引起编辑提前终止的突变体.该突变体与野生型进行杂交后, 自交时纯合的突变体具有高度致死性, 无法通过配子传递, 而杂合子与野生型进行正反交配, 后代为单倍体或非整倍体.这表明CENH3突变可通过一次杂交转移到其它品系中, 为构建高效且简化的玉米单倍体诱导系统提供了可能. ...
在自然条件下, 大多数植物(如玉米)表现为二倍体, 即每个细胞含有2套染色体.为培育出遗传上纯合的系谱, 研究人员通过多代连续自交以确保后代基因的纯合性.而单倍体诱导技术提供了一种更为高效的方法.该技术通过特定的双单倍体(DH)途径, 诱导植物产生仅含1套染色体的细胞, 进而发育成单倍体植株.随后, 利用染色体加倍技术, 将单倍体植株转化为遗传稳定的二倍体植株, 极大地缩短了培育纯合谱系的时间(Ren et al., 2017).基于CRISPR/Cas9技术对玉米中的花粉特异性磷脂酶基因ZmPLA1进行精确编辑, Dong等(2018)成功开发出高效的孤雌生殖单倍体诱导体系; 他们还融入一个组织特异性表达的双荧光蛋白标记系统, 显著优化了单倍体的鉴别和筛选流程, 极大地提高了筛选效率, 并为作物改良中双单倍体育种技术的应用确立了新标准.Stock6 (可诱导产生单倍体的玉米突变体)作为玉米单倍体诱导育种的关键工具, 可通过杂交诱发孤雌生殖, 即使花粉与雌蕊接触, 也不形成正常的双倍体合子, 而是直接形成单倍体种子, 随后通过化学处理或温度震荡等手段进行染色体加倍, 进而形成遗传上纯合的双单倍体植株.Liu等(2017)利用CRISPR/Cas9技术对玉米ZmPLA1基因第1外显子进行精确编辑, 导致特定的缺失突变.编辑后的突变体平均单倍体诱导率约为2%, 与Stock6的诱导效率相似.该研究团队进一步采用CRISPR/Cas9技术敲除ZmDMP基因后, 观察到该基因缺失单倍体诱导率提高5-6倍.这是首次在非Stock6背景下观察到的独立单倍体诱导现象, 展现出基因编辑技术在提高单倍体诱导率方面的巨大应用潜力.通过将CRISPR/Cas9基因编辑技术与传统单倍体诱导策略相结合, 创制了单倍体诱导编辑(haploid-induction editing, HI-Edit)策略(Kelliher et al., 2019)和单倍体诱导介导的基因组编辑(haploid inducer-mediated genome editing, IMGE)策略(Wang et al., 2019a).利用单倍体诱导技术可以高效生成单倍体植株, 随后通过CRISPR/Cas9或其它基因编辑技术进行目标基因的精确修改.HI-Edit策略的独特之处在于, 允许在不引入外源DNA的条件下对基因进行精准改良, 因此显著降低了对转基因技术的依赖.通过这种策略, 可在2个世代内成功培育出特定性状的纯合株系.此外, 该策略有效克服了玉米遗传转化过程中的基因型限制, 为玉米育种提供了更广泛的适用范围.在真核生物中, 着丝粒是染色体准确分离与遗传信息传递不可或缺的区域, 而特异的着丝粒组蛋白CH3 (CENH3)在识别和维持着丝粒染色质结构方面扮演着关键角色.Wang等(2021a)通过CRISPR/Cas9技术对玉米CENH3基因进行编辑, 成功创制了一个由单碱基缺失引起编辑提前终止的突变体.该突变体与野生型进行杂交后, 自交时纯合的突变体具有高度致死性, 无法通过配子传递, 而杂合子与野生型进行正反交配, 后代为单倍体或非整倍体.这表明CENH3突变可通过一次杂交转移到其它品系中, 为构建高效且简化的玉米单倍体诱导系统提供了可能. ...
在自然条件下, 大多数植物(如玉米)表现为二倍体, 即每个细胞含有2套染色体.为培育出遗传上纯合的系谱, 研究人员通过多代连续自交以确保后代基因的纯合性.而单倍体诱导技术提供了一种更为高效的方法.该技术通过特定的双单倍体(DH)途径, 诱导植物产生仅含1套染色体的细胞, 进而发育成单倍体植株.随后, 利用染色体加倍技术, 将单倍体植株转化为遗传稳定的二倍体植株, 极大地缩短了培育纯合谱系的时间(Ren et al., 2017).基于CRISPR/Cas9技术对玉米中的花粉特异性磷脂酶基因ZmPLA1进行精确编辑, Dong等(2018)成功开发出高效的孤雌生殖单倍体诱导体系; 他们还融入一个组织特异性表达的双荧光蛋白标记系统, 显著优化了单倍体的鉴别和筛选流程, 极大地提高了筛选效率, 并为作物改良中双单倍体育种技术的应用确立了新标准.Stock6 (可诱导产生单倍体的玉米突变体)作为玉米单倍体诱导育种的关键工具, 可通过杂交诱发孤雌生殖, 即使花粉与雌蕊接触, 也不形成正常的双倍体合子, 而是直接形成单倍体种子, 随后通过化学处理或温度震荡等手段进行染色体加倍, 进而形成遗传上纯合的双单倍体植株.Liu等(2017)利用CRISPR/Cas9技术对玉米ZmPLA1基因第1外显子进行精确编辑, 导致特定的缺失突变.编辑后的突变体平均单倍体诱导率约为2%, 与Stock6的诱导效率相似.该研究团队进一步采用CRISPR/Cas9技术敲除ZmDMP基因后, 观察到该基因缺失单倍体诱导率提高5-6倍.这是首次在非Stock6背景下观察到的独立单倍体诱导现象, 展现出基因编辑技术在提高单倍体诱导率方面的巨大应用潜力.通过将CRISPR/Cas9基因编辑技术与传统单倍体诱导策略相结合, 创制了单倍体诱导编辑(haploid-induction editing, HI-Edit)策略(Kelliher et al., 2019)和单倍体诱导介导的基因组编辑(haploid inducer-mediated genome editing, IMGE)策略(Wang et al., 2019a).利用单倍体诱导技术可以高效生成单倍体植株, 随后通过CRISPR/Cas9或其它基因编辑技术进行目标基因的精确修改.HI-Edit策略的独特之处在于, 允许在不引入外源DNA的条件下对基因进行精准改良, 因此显著降低了对转基因技术的依赖.通过这种策略, 可在2个世代内成功培育出特定性状的纯合株系.此外, 该策略有效克服了玉米遗传转化过程中的基因型限制, 为玉米育种提供了更广泛的适用范围.在真核生物中, 着丝粒是染色体准确分离与遗传信息传递不可或缺的区域, 而特异的着丝粒组蛋白CH3 (CENH3)在识别和维持着丝粒染色质结构方面扮演着关键角色.Wang等(2021a)通过CRISPR/Cas9技术对玉米CENH3基因进行编辑, 成功创制了一个由单碱基缺失引起编辑提前终止的突变体.该突变体与野生型进行杂交后, 自交时纯合的突变体具有高度致死性, 无法通过配子传递, 而杂合子与野生型进行正反交配, 后代为单倍体或非整倍体.这表明CENH3突变可通过一次杂交转移到其它品系中, 为构建高效且简化的玉米单倍体诱导系统提供了可能. ...
在自然条件下, 大多数植物(如玉米)表现为二倍体, 即每个细胞含有2套染色体.为培育出遗传上纯合的系谱, 研究人员通过多代连续自交以确保后代基因的纯合性.而单倍体诱导技术提供了一种更为高效的方法.该技术通过特定的双单倍体(DH)途径, 诱导植物产生仅含1套染色体的细胞, 进而发育成单倍体植株.随后, 利用染色体加倍技术, 将单倍体植株转化为遗传稳定的二倍体植株, 极大地缩短了培育纯合谱系的时间(Ren et al., 2017).基于CRISPR/Cas9技术对玉米中的花粉特异性磷脂酶基因ZmPLA1进行精确编辑, Dong等(2018)成功开发出高效的孤雌生殖单倍体诱导体系; 他们还融入一个组织特异性表达的双荧光蛋白标记系统, 显著优化了单倍体的鉴别和筛选流程, 极大地提高了筛选效率, 并为作物改良中双单倍体育种技术的应用确立了新标准.Stock6 (可诱导产生单倍体的玉米突变体)作为玉米单倍体诱导育种的关键工具, 可通过杂交诱发孤雌生殖, 即使花粉与雌蕊接触, 也不形成正常的双倍体合子, 而是直接形成单倍体种子, 随后通过化学处理或温度震荡等手段进行染色体加倍, 进而形成遗传上纯合的双单倍体植株.Liu等(2017)利用CRISPR/Cas9技术对玉米ZmPLA1基因第1外显子进行精确编辑, 导致特定的缺失突变.编辑后的突变体平均单倍体诱导率约为2%, 与Stock6的诱导效率相似.该研究团队进一步采用CRISPR/Cas9技术敲除ZmDMP基因后, 观察到该基因缺失单倍体诱导率提高5-6倍.这是首次在非Stock6背景下观察到的独立单倍体诱导现象, 展现出基因编辑技术在提高单倍体诱导率方面的巨大应用潜力.通过将CRISPR/Cas9基因编辑技术与传统单倍体诱导策略相结合, 创制了单倍体诱导编辑(haploid-induction editing, HI-Edit)策略(Kelliher et al., 2019)和单倍体诱导介导的基因组编辑(haploid inducer-mediated genome editing, IMGE)策略(Wang et al., 2019a).利用单倍体诱导技术可以高效生成单倍体植株, 随后通过CRISPR/Cas9或其它基因编辑技术进行目标基因的精确修改.HI-Edit策略的独特之处在于, 允许在不引入外源DNA的条件下对基因进行精准改良, 因此显著降低了对转基因技术的依赖.通过这种策略, 可在2个世代内成功培育出特定性状的纯合株系.此外, 该策略有效克服了玉米遗传转化过程中的基因型限制, 为玉米育种提供了更广泛的适用范围.在真核生物中, 着丝粒是染色体准确分离与遗传信息传递不可或缺的区域, 而特异的着丝粒组蛋白CH3 (CENH3)在识别和维持着丝粒染色质结构方面扮演着关键角色.Wang等(2021a)通过CRISPR/Cas9技术对玉米CENH3基因进行编辑, 成功创制了一个由单碱基缺失引起编辑提前终止的突变体.该突变体与野生型进行杂交后, 自交时纯合的突变体具有高度致死性, 无法通过配子传递, 而杂合子与野生型进行正反交配, 后代为单倍体或非整倍体.这表明CENH3突变可通过一次杂交转移到其它品系中, 为构建高效且简化的玉米单倍体诱导系统提供了可能. ...
在自然条件下, 大多数植物(如玉米)表现为二倍体, 即每个细胞含有2套染色体.为培育出遗传上纯合的系谱, 研究人员通过多代连续自交以确保后代基因的纯合性.而单倍体诱导技术提供了一种更为高效的方法.该技术通过特定的双单倍体(DH)途径, 诱导植物产生仅含1套染色体的细胞, 进而发育成单倍体植株.随后, 利用染色体加倍技术, 将单倍体植株转化为遗传稳定的二倍体植株, 极大地缩短了培育纯合谱系的时间(Ren et al., 2017).基于CRISPR/Cas9技术对玉米中的花粉特异性磷脂酶基因ZmPLA1进行精确编辑, Dong等(2018)成功开发出高效的孤雌生殖单倍体诱导体系; 他们还融入一个组织特异性表达的双荧光蛋白标记系统, 显著优化了单倍体的鉴别和筛选流程, 极大地提高了筛选效率, 并为作物改良中双单倍体育种技术的应用确立了新标准.Stock6 (可诱导产生单倍体的玉米突变体)作为玉米单倍体诱导育种的关键工具, 可通过杂交诱发孤雌生殖, 即使花粉与雌蕊接触, 也不形成正常的双倍体合子, 而是直接形成单倍体种子, 随后通过化学处理或温度震荡等手段进行染色体加倍, 进而形成遗传上纯合的双单倍体植株.Liu等(2017)利用CRISPR/Cas9技术对玉米ZmPLA1基因第1外显子进行精确编辑, 导致特定的缺失突变.编辑后的突变体平均单倍体诱导率约为2%, 与Stock6的诱导效率相似.该研究团队进一步采用CRISPR/Cas9技术敲除ZmDMP基因后, 观察到该基因缺失单倍体诱导率提高5-6倍.这是首次在非Stock6背景下观察到的独立单倍体诱导现象, 展现出基因编辑技术在提高单倍体诱导率方面的巨大应用潜力.通过将CRISPR/Cas9基因编辑技术与传统单倍体诱导策略相结合, 创制了单倍体诱导编辑(haploid-induction editing, HI-Edit)策略(Kelliher et al., 2019)和单倍体诱导介导的基因组编辑(haploid inducer-mediated genome editing, IMGE)策略(Wang et al., 2019a).利用单倍体诱导技术可以高效生成单倍体植株, 随后通过CRISPR/Cas9或其它基因编辑技术进行目标基因的精确修改.HI-Edit策略的独特之处在于, 允许在不引入外源DNA的条件下对基因进行精准改良, 因此显著降低了对转基因技术的依赖.通过这种策略, 可在2个世代内成功培育出特定性状的纯合株系.此外, 该策略有效克服了玉米遗传转化过程中的基因型限制, 为玉米育种提供了更广泛的适用范围.在真核生物中, 着丝粒是染色体准确分离与遗传信息传递不可或缺的区域, 而特异的着丝粒组蛋白CH3 (CENH3)在识别和维持着丝粒染色质结构方面扮演着关键角色.Wang等(2021a)通过CRISPR/Cas9技术对玉米CENH3基因进行编辑, 成功创制了一个由单碱基缺失引起编辑提前终止的突变体.该突变体与野生型进行杂交后, 自交时纯合的突变体具有高度致死性, 无法通过配子传递, 而杂合子与野生型进行正反交配, 后代为单倍体或非整倍体.这表明CENH3突变可通过一次杂交转移到其它品系中, 为构建高效且简化的玉米单倍体诱导系统提供了可能. ...
在自然条件下, 大多数植物(如玉米)表现为二倍体, 即每个细胞含有2套染色体.为培育出遗传上纯合的系谱, 研究人员通过多代连续自交以确保后代基因的纯合性.而单倍体诱导技术提供了一种更为高效的方法.该技术通过特定的双单倍体(DH)途径, 诱导植物产生仅含1套染色体的细胞, 进而发育成单倍体植株.随后, 利用染色体加倍技术, 将单倍体植株转化为遗传稳定的二倍体植株, 极大地缩短了培育纯合谱系的时间(Ren et al., 2017).基于CRISPR/Cas9技术对玉米中的花粉特异性磷脂酶基因ZmPLA1进行精确编辑, Dong等(2018)成功开发出高效的孤雌生殖单倍体诱导体系; 他们还融入一个组织特异性表达的双荧光蛋白标记系统, 显著优化了单倍体的鉴别和筛选流程, 极大地提高了筛选效率, 并为作物改良中双单倍体育种技术的应用确立了新标准.Stock6 (可诱导产生单倍体的玉米突变体)作为玉米单倍体诱导育种的关键工具, 可通过杂交诱发孤雌生殖, 即使花粉与雌蕊接触, 也不形成正常的双倍体合子, 而是直接形成单倍体种子, 随后通过化学处理或温度震荡等手段进行染色体加倍, 进而形成遗传上纯合的双单倍体植株.Liu等(2017)利用CRISPR/Cas9技术对玉米ZmPLA1基因第1外显子进行精确编辑, 导致特定的缺失突变.编辑后的突变体平均单倍体诱导率约为2%, 与Stock6的诱导效率相似.该研究团队进一步采用CRISPR/Cas9技术敲除ZmDMP基因后, 观察到该基因缺失单倍体诱导率提高5-6倍.这是首次在非Stock6背景下观察到的独立单倍体诱导现象, 展现出基因编辑技术在提高单倍体诱导率方面的巨大应用潜力.通过将CRISPR/Cas9基因编辑技术与传统单倍体诱导策略相结合, 创制了单倍体诱导编辑(haploid-induction editing, HI-Edit)策略(Kelliher et al., 2019)和单倍体诱导介导的基因组编辑(haploid inducer-mediated genome editing, IMGE)策略(Wang et al., 2019a).利用单倍体诱导技术可以高效生成单倍体植株, 随后通过CRISPR/Cas9或其它基因编辑技术进行目标基因的精确修改.HI-Edit策略的独特之处在于, 允许在不引入外源DNA的条件下对基因进行精准改良, 因此显著降低了对转基因技术的依赖.通过这种策略, 可在2个世代内成功培育出特定性状的纯合株系.此外, 该策略有效克服了玉米遗传转化过程中的基因型限制, 为玉米育种提供了更广泛的适用范围.在真核生物中, 着丝粒是染色体准确分离与遗传信息传递不可或缺的区域, 而特异的着丝粒组蛋白CH3 (CENH3)在识别和维持着丝粒染色质结构方面扮演着关键角色.Wang等(2021a)通过CRISPR/Cas9技术对玉米CENH3基因进行编辑, 成功创制了一个由单碱基缺失引起编辑提前终止的突变体.该突变体与野生型进行杂交后, 自交时纯合的突变体具有高度致死性, 无法通过配子传递, 而杂合子与野生型进行正反交配, 后代为单倍体或非整倍体.这表明CENH3突变可通过一次杂交转移到其它品系中, 为构建高效且简化的玉米单倍体诱导系统提供了可能. ...
在自然条件下, 大多数植物(如玉米)表现为二倍体, 即每个细胞含有2套染色体.为培育出遗传上纯合的系谱, 研究人员通过多代连续自交以确保后代基因的纯合性.而单倍体诱导技术提供了一种更为高效的方法.该技术通过特定的双单倍体(DH)途径, 诱导植物产生仅含1套染色体的细胞, 进而发育成单倍体植株.随后, 利用染色体加倍技术, 将单倍体植株转化为遗传稳定的二倍体植株, 极大地缩短了培育纯合谱系的时间(Ren et al., 2017).基于CRISPR/Cas9技术对玉米中的花粉特异性磷脂酶基因ZmPLA1进行精确编辑, Dong等(2018)成功开发出高效的孤雌生殖单倍体诱导体系; 他们还融入一个组织特异性表达的双荧光蛋白标记系统, 显著优化了单倍体的鉴别和筛选流程, 极大地提高了筛选效率, 并为作物改良中双单倍体育种技术的应用确立了新标准.Stock6 (可诱导产生单倍体的玉米突变体)作为玉米单倍体诱导育种的关键工具, 可通过杂交诱发孤雌生殖, 即使花粉与雌蕊接触, 也不形成正常的双倍体合子, 而是直接形成单倍体种子, 随后通过化学处理或温度震荡等手段进行染色体加倍, 进而形成遗传上纯合的双单倍体植株.Liu等(2017)利用CRISPR/Cas9技术对玉米ZmPLA1基因第1外显子进行精确编辑, 导致特定的缺失突变.编辑后的突变体平均单倍体诱导率约为2%, 与Stock6的诱导效率相似.该研究团队进一步采用CRISPR/Cas9技术敲除ZmDMP基因后, 观察到该基因缺失单倍体诱导率提高5-6倍.这是首次在非Stock6背景下观察到的独立单倍体诱导现象, 展现出基因编辑技术在提高单倍体诱导率方面的巨大应用潜力.通过将CRISPR/Cas9基因编辑技术与传统单倍体诱导策略相结合, 创制了单倍体诱导编辑(haploid-induction editing, HI-Edit)策略(Kelliher et al., 2019)和单倍体诱导介导的基因组编辑(haploid inducer-mediated genome editing, IMGE)策略(Wang et al., 2019a).利用单倍体诱导技术可以高效生成单倍体植株, 随后通过CRISPR/Cas9或其它基因编辑技术进行目标基因的精确修改.HI-Edit策略的独特之处在于, 允许在不引入外源DNA的条件下对基因进行精准改良, 因此显著降低了对转基因技术的依赖.通过这种策略, 可在2个世代内成功培育出特定性状的纯合株系.此外, 该策略有效克服了玉米遗传转化过程中的基因型限制, 为玉米育种提供了更广泛的适用范围.在真核生物中, 着丝粒是染色体准确分离与遗传信息传递不可或缺的区域, 而特异的着丝粒组蛋白CH3 (CENH3)在识别和维持着丝粒染色质结构方面扮演着关键角色.Wang等(2021a)通过CRISPR/Cas9技术对玉米CENH3基因进行编辑, 成功创制了一个由单碱基缺失引起编辑提前终止的突变体.该突变体与野生型进行杂交后, 自交时纯合的突变体具有高度致死性, 无法通过配子传递, 而杂合子与野生型进行正反交配, 后代为单倍体或非整倍体.这表明CENH3突变可通过一次杂交转移到其它品系中, 为构建高效且简化的玉米单倍体诱导系统提供了可能. ...
在自然条件下, 大多数植物(如玉米)表现为二倍体, 即每个细胞含有2套染色体.为培育出遗传上纯合的系谱, 研究人员通过多代连续自交以确保后代基因的纯合性.而单倍体诱导技术提供了一种更为高效的方法.该技术通过特定的双单倍体(DH)途径, 诱导植物产生仅含1套染色体的细胞, 进而发育成单倍体植株.随后, 利用染色体加倍技术, 将单倍体植株转化为遗传稳定的二倍体植株, 极大地缩短了培育纯合谱系的时间(Ren et al., 2017).基于CRISPR/Cas9技术对玉米中的花粉特异性磷脂酶基因ZmPLA1进行精确编辑, Dong等(2018)成功开发出高效的孤雌生殖单倍体诱导体系; 他们还融入一个组织特异性表达的双荧光蛋白标记系统, 显著优化了单倍体的鉴别和筛选流程, 极大地提高了筛选效率, 并为作物改良中双单倍体育种技术的应用确立了新标准.Stock6 (可诱导产生单倍体的玉米突变体)作为玉米单倍体诱导育种的关键工具, 可通过杂交诱发孤雌生殖, 即使花粉与雌蕊接触, 也不形成正常的双倍体合子, 而是直接形成单倍体种子, 随后通过化学处理或温度震荡等手段进行染色体加倍, 进而形成遗传上纯合的双单倍体植株.Liu等(2017)利用CRISPR/Cas9技术对玉米ZmPLA1基因第1外显子进行精确编辑, 导致特定的缺失突变.编辑后的突变体平均单倍体诱导率约为2%, 与Stock6的诱导效率相似.该研究团队进一步采用CRISPR/Cas9技术敲除ZmDMP基因后, 观察到该基因缺失单倍体诱导率提高5-6倍.这是首次在非Stock6背景下观察到的独立单倍体诱导现象, 展现出基因编辑技术在提高单倍体诱导率方面的巨大应用潜力.通过将CRISPR/Cas9基因编辑技术与传统单倍体诱导策略相结合, 创制了单倍体诱导编辑(haploid-induction editing, HI-Edit)策略(Kelliher et al., 2019)和单倍体诱导介导的基因组编辑(haploid inducer-mediated genome editing, IMGE)策略(Wang et al., 2019a).利用单倍体诱导技术可以高效生成单倍体植株, 随后通过CRISPR/Cas9或其它基因编辑技术进行目标基因的精确修改.HI-Edit策略的独特之处在于, 允许在不引入外源DNA的条件下对基因进行精准改良, 因此显著降低了对转基因技术的依赖.通过这种策略, 可在2个世代内成功培育出特定性状的纯合株系.此外, 该策略有效克服了玉米遗传转化过程中的基因型限制, 为玉米育种提供了更广泛的适用范围.在真核生物中, 着丝粒是染色体准确分离与遗传信息传递不可或缺的区域, 而特异的着丝粒组蛋白CH3 (CENH3)在识别和维持着丝粒染色质结构方面扮演着关键角色.Wang等(2021a)通过CRISPR/Cas9技术对玉米CENH3基因进行编辑, 成功创制了一个由单碱基缺失引起编辑提前终止的突变体.该突变体与野生型进行杂交后, 自交时纯合的突变体具有高度致死性, 无法通过配子传递, 而杂合子与野生型进行正反交配, 后代为单倍体或非整倍体.这表明CENH3突变可通过一次杂交转移到其它品系中, 为构建高效且简化的玉米单倍体诱导系统提供了可能. ...
在自然条件下, 大多数植物(如玉米)表现为二倍体, 即每个细胞含有2套染色体.为培育出遗传上纯合的系谱, 研究人员通过多代连续自交以确保后代基因的纯合性.而单倍体诱导技术提供了一种更为高效的方法.该技术通过特定的双单倍体(DH)途径, 诱导植物产生仅含1套染色体的细胞, 进而发育成单倍体植株.随后, 利用染色体加倍技术, 将单倍体植株转化为遗传稳定的二倍体植株, 极大地缩短了培育纯合谱系的时间(Ren et al., 2017).基于CRISPR/Cas9技术对玉米中的花粉特异性磷脂酶基因ZmPLA1进行精确编辑, Dong等(2018)成功开发出高效的孤雌生殖单倍体诱导体系; 他们还融入一个组织特异性表达的双荧光蛋白标记系统, 显著优化了单倍体的鉴别和筛选流程, 极大地提高了筛选效率, 并为作物改良中双单倍体育种技术的应用确立了新标准.Stock6 (可诱导产生单倍体的玉米突变体)作为玉米单倍体诱导育种的关键工具, 可通过杂交诱发孤雌生殖, 即使花粉与雌蕊接触, 也不形成正常的双倍体合子, 而是直接形成单倍体种子, 随后通过化学处理或温度震荡等手段进行染色体加倍, 进而形成遗传上纯合的双单倍体植株.Liu等(2017)利用CRISPR/Cas9技术对玉米ZmPLA1基因第1外显子进行精确编辑, 导致特定的缺失突变.编辑后的突变体平均单倍体诱导率约为2%, 与Stock6的诱导效率相似.该研究团队进一步采用CRISPR/Cas9技术敲除ZmDMP基因后, 观察到该基因缺失单倍体诱导率提高5-6倍.这是首次在非Stock6背景下观察到的独立单倍体诱导现象, 展现出基因编辑技术在提高单倍体诱导率方面的巨大应用潜力.通过将CRISPR/Cas9基因编辑技术与传统单倍体诱导策略相结合, 创制了单倍体诱导编辑(haploid-induction editing, HI-Edit)策略(Kelliher et al., 2019)和单倍体诱导介导的基因组编辑(haploid inducer-mediated genome editing, IMGE)策略(Wang et al., 2019a).利用单倍体诱导技术可以高效生成单倍体植株, 随后通过CRISPR/Cas9或其它基因编辑技术进行目标基因的精确修改.HI-Edit策略的独特之处在于, 允许在不引入外源DNA的条件下对基因进行精准改良, 因此显著降低了对转基因技术的依赖.通过这种策略, 可在2个世代内成功培育出特定性状的纯合株系.此外, 该策略有效克服了玉米遗传转化过程中的基因型限制, 为玉米育种提供了更广泛的适用范围.在真核生物中, 着丝粒是染色体准确分离与遗传信息传递不可或缺的区域, 而特异的着丝粒组蛋白CH3 (CENH3)在识别和维持着丝粒染色质结构方面扮演着关键角色.Wang等(2021a)通过CRISPR/Cas9技术对玉米CENH3基因进行编辑, 成功创制了一个由单碱基缺失引起编辑提前终止的突变体.该突变体与野生型进行杂交后, 自交时纯合的突变体具有高度致死性, 无法通过配子传递, 而杂合子与野生型进行正反交配, 后代为单倍体或非整倍体.这表明CENH3突变可通过一次杂交转移到其它品系中, 为构建高效且简化的玉米单倍体诱导系统提供了可能. ...
在自然条件下, 大多数植物(如玉米)表现为二倍体, 即每个细胞含有2套染色体.为培育出遗传上纯合的系谱, 研究人员通过多代连续自交以确保后代基因的纯合性.而单倍体诱导技术提供了一种更为高效的方法.该技术通过特定的双单倍体(DH)途径, 诱导植物产生仅含1套染色体的细胞, 进而发育成单倍体植株.随后, 利用染色体加倍技术, 将单倍体植株转化为遗传稳定的二倍体植株, 极大地缩短了培育纯合谱系的时间(Ren et al., 2017).基于CRISPR/Cas9技术对玉米中的花粉特异性磷脂酶基因ZmPLA1进行精确编辑, Dong等(2018)成功开发出高效的孤雌生殖单倍体诱导体系; 他们还融入一个组织特异性表达的双荧光蛋白标记系统, 显著优化了单倍体的鉴别和筛选流程, 极大地提高了筛选效率, 并为作物改良中双单倍体育种技术的应用确立了新标准.Stock6 (可诱导产生单倍体的玉米突变体)作为玉米单倍体诱导育种的关键工具, 可通过杂交诱发孤雌生殖, 即使花粉与雌蕊接触, 也不形成正常的双倍体合子, 而是直接形成单倍体种子, 随后通过化学处理或温度震荡等手段进行染色体加倍, 进而形成遗传上纯合的双单倍体植株.Liu等(2017)利用CRISPR/Cas9技术对玉米ZmPLA1基因第1外显子进行精确编辑, 导致特定的缺失突变.编辑后的突变体平均单倍体诱导率约为2%, 与Stock6的诱导效率相似.该研究团队进一步采用CRISPR/Cas9技术敲除ZmDMP基因后, 观察到该基因缺失单倍体诱导率提高5-6倍.这是首次在非Stock6背景下观察到的独立单倍体诱导现象, 展现出基因编辑技术在提高单倍体诱导率方面的巨大应用潜力.通过将CRISPR/Cas9基因编辑技术与传统单倍体诱导策略相结合, 创制了单倍体诱导编辑(haploid-induction editing, HI-Edit)策略(Kelliher et al., 2019)和单倍体诱导介导的基因组编辑(haploid inducer-mediated genome editing, IMGE)策略(Wang et al., 2019a).利用单倍体诱导技术可以高效生成单倍体植株, 随后通过CRISPR/Cas9或其它基因编辑技术进行目标基因的精确修改.HI-Edit策略的独特之处在于, 允许在不引入外源DNA的条件下对基因进行精准改良, 因此显著降低了对转基因技术的依赖.通过这种策略, 可在2个世代内成功培育出特定性状的纯合株系.此外, 该策略有效克服了玉米遗传转化过程中的基因型限制, 为玉米育种提供了更广泛的适用范围.在真核生物中, 着丝粒是染色体准确分离与遗传信息传递不可或缺的区域, 而特异的着丝粒组蛋白CH3 (CENH3)在识别和维持着丝粒染色质结构方面扮演着关键角色.Wang等(2021a)通过CRISPR/Cas9技术对玉米CENH3基因进行编辑, 成功创制了一个由单碱基缺失引起编辑提前终止的突变体.该突变体与野生型进行杂交后, 自交时纯合的突变体具有高度致死性, 无法通过配子传递, 而杂合子与野生型进行正反交配, 后代为单倍体或非整倍体.这表明CENH3突变可通过一次杂交转移到其它品系中, 为构建高效且简化的玉米单倍体诱导系统提供了可能. ...
在自然条件下, 大多数植物(如玉米)表现为二倍体, 即每个细胞含有2套染色体.为培育出遗传上纯合的系谱, 研究人员通过多代连续自交以确保后代基因的纯合性.而单倍体诱导技术提供了一种更为高效的方法.该技术通过特定的双单倍体(DH)途径, 诱导植物产生仅含1套染色体的细胞, 进而发育成单倍体植株.随后, 利用染色体加倍技术, 将单倍体植株转化为遗传稳定的二倍体植株, 极大地缩短了培育纯合谱系的时间(Ren et al., 2017).基于CRISPR/Cas9技术对玉米中的花粉特异性磷脂酶基因ZmPLA1进行精确编辑, Dong等(2018)成功开发出高效的孤雌生殖单倍体诱导体系; 他们还融入一个组织特异性表达的双荧光蛋白标记系统, 显著优化了单倍体的鉴别和筛选流程, 极大地提高了筛选效率, 并为作物改良中双单倍体育种技术的应用确立了新标准.Stock6 (可诱导产生单倍体的玉米突变体)作为玉米单倍体诱导育种的关键工具, 可通过杂交诱发孤雌生殖, 即使花粉与雌蕊接触, 也不形成正常的双倍体合子, 而是直接形成单倍体种子, 随后通过化学处理或温度震荡等手段进行染色体加倍, 进而形成遗传上纯合的双单倍体植株.Liu等(2017)利用CRISPR/Cas9技术对玉米ZmPLA1基因第1外显子进行精确编辑, 导致特定的缺失突变.编辑后的突变体平均单倍体诱导率约为2%, 与Stock6的诱导效率相似.该研究团队进一步采用CRISPR/Cas9技术敲除ZmDMP基因后, 观察到该基因缺失单倍体诱导率提高5-6倍.这是首次在非Stock6背景下观察到的独立单倍体诱导现象, 展现出基因编辑技术在提高单倍体诱导率方面的巨大应用潜力.通过将CRISPR/Cas9基因编辑技术与传统单倍体诱导策略相结合, 创制了单倍体诱导编辑(haploid-induction editing, HI-Edit)策略(Kelliher et al., 2019)和单倍体诱导介导的基因组编辑(haploid inducer-mediated genome editing, IMGE)策略(Wang et al., 2019a).利用单倍体诱导技术可以高效生成单倍体植株, 随后通过CRISPR/Cas9或其它基因编辑技术进行目标基因的精确修改.HI-Edit策略的独特之处在于, 允许在不引入外源DNA的条件下对基因进行精准改良, 因此显著降低了对转基因技术的依赖.通过这种策略, 可在2个世代内成功培育出特定性状的纯合株系.此外, 该策略有效克服了玉米遗传转化过程中的基因型限制, 为玉米育种提供了更广泛的适用范围.在真核生物中, 着丝粒是染色体准确分离与遗传信息传递不可或缺的区域, 而特异的着丝粒组蛋白CH3 (CENH3)在识别和维持着丝粒染色质结构方面扮演着关键角色.Wang等(2021a)通过CRISPR/Cas9技术对玉米CENH3基因进行编辑, 成功创制了一个由单碱基缺失引起编辑提前终止的突变体.该突变体与野生型进行杂交后, 自交时纯合的突变体具有高度致死性, 无法通过配子传递, 而杂合子与野生型进行正反交配, 后代为单倍体或非整倍体.这表明CENH3突变可通过一次杂交转移到其它品系中, 为构建高效且简化的玉米单倍体诱导系统提供了可能. ...
在自然条件下, 大多数植物(如玉米)表现为二倍体, 即每个细胞含有2套染色体.为培育出遗传上纯合的系谱, 研究人员通过多代连续自交以确保后代基因的纯合性.而单倍体诱导技术提供了一种更为高效的方法.该技术通过特定的双单倍体(DH)途径, 诱导植物产生仅含1套染色体的细胞, 进而发育成单倍体植株.随后, 利用染色体加倍技术, 将单倍体植株转化为遗传稳定的二倍体植株, 极大地缩短了培育纯合谱系的时间(Ren et al., 2017).基于CRISPR/Cas9技术对玉米中的花粉特异性磷脂酶基因ZmPLA1进行精确编辑, Dong等(2018)成功开发出高效的孤雌生殖单倍体诱导体系; 他们还融入一个组织特异性表达的双荧光蛋白标记系统, 显著优化了单倍体的鉴别和筛选流程, 极大地提高了筛选效率, 并为作物改良中双单倍体育种技术的应用确立了新标准.Stock6 (可诱导产生单倍体的玉米突变体)作为玉米单倍体诱导育种的关键工具, 可通过杂交诱发孤雌生殖, 即使花粉与雌蕊接触, 也不形成正常的双倍体合子, 而是直接形成单倍体种子, 随后通过化学处理或温度震荡等手段进行染色体加倍, 进而形成遗传上纯合的双单倍体植株.Liu等(2017)利用CRISPR/Cas9技术对玉米ZmPLA1基因第1外显子进行精确编辑, 导致特定的缺失突变.编辑后的突变体平均单倍体诱导率约为2%, 与Stock6的诱导效率相似.该研究团队进一步采用CRISPR/Cas9技术敲除ZmDMP基因后, 观察到该基因缺失单倍体诱导率提高5-6倍.这是首次在非Stock6背景下观察到的独立单倍体诱导现象, 展现出基因编辑技术在提高单倍体诱导率方面的巨大应用潜力.通过将CRISPR/Cas9基因编辑技术与传统单倍体诱导策略相结合, 创制了单倍体诱导编辑(haploid-induction editing, HI-Edit)策略(Kelliher et al., 2019)和单倍体诱导介导的基因组编辑(haploid inducer-mediated genome editing, IMGE)策略(Wang et al., 2019a).利用单倍体诱导技术可以高效生成单倍体植株, 随后通过CRISPR/Cas9或其它基因编辑技术进行目标基因的精确修改.HI-Edit策略的独特之处在于, 允许在不引入外源DNA的条件下对基因进行精准改良, 因此显著降低了对转基因技术的依赖.通过这种策略, 可在2个世代内成功培育出特定性状的纯合株系.此外, 该策略有效克服了玉米遗传转化过程中的基因型限制, 为玉米育种提供了更广泛的适用范围.在真核生物中, 着丝粒是染色体准确分离与遗传信息传递不可或缺的区域, 而特异的着丝粒组蛋白CH3 (CENH3)在识别和维持着丝粒染色质结构方面扮演着关键角色.Wang等(2021a)通过CRISPR/Cas9技术对玉米CENH3基因进行编辑, 成功创制了一个由单碱基缺失引起编辑提前终止的突变体.该突变体与野生型进行杂交后, 自交时纯合的突变体具有高度致死性, 无法通过配子传递, 而杂合子与野生型进行正反交配, 后代为单倍体或非整倍体.这表明CENH3突变可通过一次杂交转移到其它品系中, 为构建高效且简化的玉米单倍体诱导系统提供了可能. ...
在自然条件下, 大多数植物(如玉米)表现为二倍体, 即每个细胞含有2套染色体.为培育出遗传上纯合的系谱, 研究人员通过多代连续自交以确保后代基因的纯合性.而单倍体诱导技术提供了一种更为高效的方法.该技术通过特定的双单倍体(DH)途径, 诱导植物产生仅含1套染色体的细胞, 进而发育成单倍体植株.随后, 利用染色体加倍技术, 将单倍体植株转化为遗传稳定的二倍体植株, 极大地缩短了培育纯合谱系的时间(Ren et al., 2017).基于CRISPR/Cas9技术对玉米中的花粉特异性磷脂酶基因ZmPLA1进行精确编辑, Dong等(2018)成功开发出高效的孤雌生殖单倍体诱导体系; 他们还融入一个组织特异性表达的双荧光蛋白标记系统, 显著优化了单倍体的鉴别和筛选流程, 极大地提高了筛选效率, 并为作物改良中双单倍体育种技术的应用确立了新标准.Stock6 (可诱导产生单倍体的玉米突变体)作为玉米单倍体诱导育种的关键工具, 可通过杂交诱发孤雌生殖, 即使花粉与雌蕊接触, 也不形成正常的双倍体合子, 而是直接形成单倍体种子, 随后通过化学处理或温度震荡等手段进行染色体加倍, 进而形成遗传上纯合的双单倍体植株.Liu等(2017)利用CRISPR/Cas9技术对玉米ZmPLA1基因第1外显子进行精确编辑, 导致特定的缺失突变.编辑后的突变体平均单倍体诱导率约为2%, 与Stock6的诱导效率相似.该研究团队进一步采用CRISPR/Cas9技术敲除ZmDMP基因后, 观察到该基因缺失单倍体诱导率提高5-6倍.这是首次在非Stock6背景下观察到的独立单倍体诱导现象, 展现出基因编辑技术在提高单倍体诱导率方面的巨大应用潜力.通过将CRISPR/Cas9基因编辑技术与传统单倍体诱导策略相结合, 创制了单倍体诱导编辑(haploid-induction editing, HI-Edit)策略(Kelliher et al., 2019)和单倍体诱导介导的基因组编辑(haploid inducer-mediated genome editing, IMGE)策略(Wang et al., 2019a).利用单倍体诱导技术可以高效生成单倍体植株, 随后通过CRISPR/Cas9或其它基因编辑技术进行目标基因的精确修改.HI-Edit策略的独特之处在于, 允许在不引入外源DNA的条件下对基因进行精准改良, 因此显著降低了对转基因技术的依赖.通过这种策略, 可在2个世代内成功培育出特定性状的纯合株系.此外, 该策略有效克服了玉米遗传转化过程中的基因型限制, 为玉米育种提供了更广泛的适用范围.在真核生物中, 着丝粒是染色体准确分离与遗传信息传递不可或缺的区域, 而特异的着丝粒组蛋白CH3 (CENH3)在识别和维持着丝粒染色质结构方面扮演着关键角色.Wang等(2021a)通过CRISPR/Cas9技术对玉米CENH3基因进行编辑, 成功创制了一个由单碱基缺失引起编辑提前终止的突变体.该突变体与野生型进行杂交后, 自交时纯合的突变体具有高度致死性, 无法通过配子传递, 而杂合子与野生型进行正反交配, 后代为单倍体或非整倍体.这表明CENH3突变可通过一次杂交转移到其它品系中, 为构建高效且简化的玉米单倍体诱导系统提供了可能. ...
在自然条件下, 大多数植物(如玉米)表现为二倍体, 即每个细胞含有2套染色体.为培育出遗传上纯合的系谱, 研究人员通过多代连续自交以确保后代基因的纯合性.而单倍体诱导技术提供了一种更为高效的方法.该技术通过特定的双单倍体(DH)途径, 诱导植物产生仅含1套染色体的细胞, 进而发育成单倍体植株.随后, 利用染色体加倍技术, 将单倍体植株转化为遗传稳定的二倍体植株, 极大地缩短了培育纯合谱系的时间(Ren et al., 2017).基于CRISPR/Cas9技术对玉米中的花粉特异性磷脂酶基因ZmPLA1进行精确编辑, Dong等(2018)成功开发出高效的孤雌生殖单倍体诱导体系; 他们还融入一个组织特异性表达的双荧光蛋白标记系统, 显著优化了单倍体的鉴别和筛选流程, 极大地提高了筛选效率, 并为作物改良中双单倍体育种技术的应用确立了新标准.Stock6 (可诱导产生单倍体的玉米突变体)作为玉米单倍体诱导育种的关键工具, 可通过杂交诱发孤雌生殖, 即使花粉与雌蕊接触, 也不形成正常的双倍体合子, 而是直接形成单倍体种子, 随后通过化学处理或温度震荡等手段进行染色体加倍, 进而形成遗传上纯合的双单倍体植株.Liu等(2017)利用CRISPR/Cas9技术对玉米ZmPLA1基因第1外显子进行精确编辑, 导致特定的缺失突变.编辑后的突变体平均单倍体诱导率约为2%, 与Stock6的诱导效率相似.该研究团队进一步采用CRISPR/Cas9技术敲除ZmDMP基因后, 观察到该基因缺失单倍体诱导率提高5-6倍.这是首次在非Stock6背景下观察到的独立单倍体诱导现象, 展现出基因编辑技术在提高单倍体诱导率方面的巨大应用潜力.通过将CRISPR/Cas9基因编辑技术与传统单倍体诱导策略相结合, 创制了单倍体诱导编辑(haploid-induction editing, HI-Edit)策略(Kelliher et al., 2019)和单倍体诱导介导的基因组编辑(haploid inducer-mediated genome editing, IMGE)策略(Wang et al., 2019a).利用单倍体诱导技术可以高效生成单倍体植株, 随后通过CRISPR/Cas9或其它基因编辑技术进行目标基因的精确修改.HI-Edit策略的独特之处在于, 允许在不引入外源DNA的条件下对基因进行精准改良, 因此显著降低了对转基因技术的依赖.通过这种策略, 可在2个世代内成功培育出特定性状的纯合株系.此外, 该策略有效克服了玉米遗传转化过程中的基因型限制, 为玉米育种提供了更广泛的适用范围.在真核生物中, 着丝粒是染色体准确分离与遗传信息传递不可或缺的区域, 而特异的着丝粒组蛋白CH3 (CENH3)在识别和维持着丝粒染色质结构方面扮演着关键角色.Wang等(2021a)通过CRISPR/Cas9技术对玉米CENH3基因进行编辑, 成功创制了一个由单碱基缺失引起编辑提前终止的突变体.该突变体与野生型进行杂交后, 自交时纯合的突变体具有高度致死性, 无法通过配子传递, 而杂合子与野生型进行正反交配, 后代为单倍体或非整倍体.这表明CENH3突变可通过一次杂交转移到其它品系中, 为构建高效且简化的玉米单倍体诱导系统提供了可能. ...
在自然条件下, 大多数植物(如玉米)表现为二倍体, 即每个细胞含有2套染色体.为培育出遗传上纯合的系谱, 研究人员通过多代连续自交以确保后代基因的纯合性.而单倍体诱导技术提供了一种更为高效的方法.该技术通过特定的双单倍体(DH)途径, 诱导植物产生仅含1套染色体的细胞, 进而发育成单倍体植株.随后, 利用染色体加倍技术, 将单倍体植株转化为遗传稳定的二倍体植株, 极大地缩短了培育纯合谱系的时间(Ren et al., 2017).基于CRISPR/Cas9技术对玉米中的花粉特异性磷脂酶基因ZmPLA1进行精确编辑, Dong等(2018)成功开发出高效的孤雌生殖单倍体诱导体系; 他们还融入一个组织特异性表达的双荧光蛋白标记系统, 显著优化了单倍体的鉴别和筛选流程, 极大地提高了筛选效率, 并为作物改良中双单倍体育种技术的应用确立了新标准.Stock6 (可诱导产生单倍体的玉米突变体)作为玉米单倍体诱导育种的关键工具, 可通过杂交诱发孤雌生殖, 即使花粉与雌蕊接触, 也不形成正常的双倍体合子, 而是直接形成单倍体种子, 随后通过化学处理或温度震荡等手段进行染色体加倍, 进而形成遗传上纯合的双单倍体植株.Liu等(2017)利用CRISPR/Cas9技术对玉米ZmPLA1基因第1外显子进行精确编辑, 导致特定的缺失突变.编辑后的突变体平均单倍体诱导率约为2%, 与Stock6的诱导效率相似.该研究团队进一步采用CRISPR/Cas9技术敲除ZmDMP基因后, 观察到该基因缺失单倍体诱导率提高5-6倍.这是首次在非Stock6背景下观察到的独立单倍体诱导现象, 展现出基因编辑技术在提高单倍体诱导率方面的巨大应用潜力.通过将CRISPR/Cas9基因编辑技术与传统单倍体诱导策略相结合, 创制了单倍体诱导编辑(haploid-induction editing, HI-Edit)策略(Kelliher et al., 2019)和单倍体诱导介导的基因组编辑(haploid inducer-mediated genome editing, IMGE)策略(Wang et al., 2019a).利用单倍体诱导技术可以高效生成单倍体植株, 随后通过CRISPR/Cas9或其它基因编辑技术进行目标基因的精确修改.HI-Edit策略的独特之处在于, 允许在不引入外源DNA的条件下对基因进行精准改良, 因此显著降低了对转基因技术的依赖.通过这种策略, 可在2个世代内成功培育出特定性状的纯合株系.此外, 该策略有效克服了玉米遗传转化过程中的基因型限制, 为玉米育种提供了更广泛的适用范围.在真核生物中, 着丝粒是染色体准确分离与遗传信息传递不可或缺的区域, 而特异的着丝粒组蛋白CH3 (CENH3)在识别和维持着丝粒染色质结构方面扮演着关键角色.Wang等(2021a)通过CRISPR/Cas9技术对玉米CENH3基因进行编辑, 成功创制了一个由单碱基缺失引起编辑提前终止的突变体.该突变体与野生型进行杂交后, 自交时纯合的突变体具有高度致死性, 无法通过配子传递, 而杂合子与野生型进行正反交配, 后代为单倍体或非整倍体.这表明CENH3突变可通过一次杂交转移到其它品系中, 为构建高效且简化的玉米单倍体诱导系统提供了可能. ...
在自然条件下, 大多数植物(如玉米)表现为二倍体, 即每个细胞含有2套染色体.为培育出遗传上纯合的系谱, 研究人员通过多代连续自交以确保后代基因的纯合性.而单倍体诱导技术提供了一种更为高效的方法.该技术通过特定的双单倍体(DH)途径, 诱导植物产生仅含1套染色体的细胞, 进而发育成单倍体植株.随后, 利用染色体加倍技术, 将单倍体植株转化为遗传稳定的二倍体植株, 极大地缩短了培育纯合谱系的时间(Ren et al., 2017).基于CRISPR/Cas9技术对玉米中的花粉特异性磷脂酶基因ZmPLA1进行精确编辑, Dong等(2018)成功开发出高效的孤雌生殖单倍体诱导体系; 他们还融入一个组织特异性表达的双荧光蛋白标记系统, 显著优化了单倍体的鉴别和筛选流程, 极大地提高了筛选效率, 并为作物改良中双单倍体育种技术的应用确立了新标准.Stock6 (可诱导产生单倍体的玉米突变体)作为玉米单倍体诱导育种的关键工具, 可通过杂交诱发孤雌生殖, 即使花粉与雌蕊接触, 也不形成正常的双倍体合子, 而是直接形成单倍体种子, 随后通过化学处理或温度震荡等手段进行染色体加倍, 进而形成遗传上纯合的双单倍体植株.Liu等(2017)利用CRISPR/Cas9技术对玉米ZmPLA1基因第1外显子进行精确编辑, 导致特定的缺失突变.编辑后的突变体平均单倍体诱导率约为2%, 与Stock6的诱导效率相似.该研究团队进一步采用CRISPR/Cas9技术敲除ZmDMP基因后, 观察到该基因缺失单倍体诱导率提高5-6倍.这是首次在非Stock6背景下观察到的独立单倍体诱导现象, 展现出基因编辑技术在提高单倍体诱导率方面的巨大应用潜力.通过将CRISPR/Cas9基因编辑技术与传统单倍体诱导策略相结合, 创制了单倍体诱导编辑(haploid-induction editing, HI-Edit)策略(Kelliher et al., 2019)和单倍体诱导介导的基因组编辑(haploid inducer-mediated genome editing, IMGE)策略(Wang et al., 2019a).利用单倍体诱导技术可以高效生成单倍体植株, 随后通过CRISPR/Cas9或其它基因编辑技术进行目标基因的精确修改.HI-Edit策略的独特之处在于, 允许在不引入外源DNA的条件下对基因进行精准改良, 因此显著降低了对转基因技术的依赖.通过这种策略, 可在2个世代内成功培育出特定性状的纯合株系.此外, 该策略有效克服了玉米遗传转化过程中的基因型限制, 为玉米育种提供了更广泛的适用范围.在真核生物中, 着丝粒是染色体准确分离与遗传信息传递不可或缺的区域, 而特异的着丝粒组蛋白CH3 (CENH3)在识别和维持着丝粒染色质结构方面扮演着关键角色.Wang等(2021a)通过CRISPR/Cas9技术对玉米CENH3基因进行编辑, 成功创制了一个由单碱基缺失引起编辑提前终止的突变体.该突变体与野生型进行杂交后, 自交时纯合的突变体具有高度致死性, 无法通过配子传递, 而杂合子与野生型进行正反交配, 后代为单倍体或非整倍体.这表明CENH3突变可通过一次杂交转移到其它品系中, 为构建高效且简化的玉米单倍体诱导系统提供了可能. ...
在自然条件下, 大多数植物(如玉米)表现为二倍体, 即每个细胞含有2套染色体.为培育出遗传上纯合的系谱, 研究人员通过多代连续自交以确保后代基因的纯合性.而单倍体诱导技术提供了一种更为高效的方法.该技术通过特定的双单倍体(DH)途径, 诱导植物产生仅含1套染色体的细胞, 进而发育成单倍体植株.随后, 利用染色体加倍技术, 将单倍体植株转化为遗传稳定的二倍体植株, 极大地缩短了培育纯合谱系的时间(Ren et al., 2017).基于CRISPR/Cas9技术对玉米中的花粉特异性磷脂酶基因ZmPLA1进行精确编辑, Dong等(2018)成功开发出高效的孤雌生殖单倍体诱导体系; 他们还融入一个组织特异性表达的双荧光蛋白标记系统, 显著优化了单倍体的鉴别和筛选流程, 极大地提高了筛选效率, 并为作物改良中双单倍体育种技术的应用确立了新标准.Stock6 (可诱导产生单倍体的玉米突变体)作为玉米单倍体诱导育种的关键工具, 可通过杂交诱发孤雌生殖, 即使花粉与雌蕊接触, 也不形成正常的双倍体合子, 而是直接形成单倍体种子, 随后通过化学处理或温度震荡等手段进行染色体加倍, 进而形成遗传上纯合的双单倍体植株.Liu等(2017)利用CRISPR/Cas9技术对玉米ZmPLA1基因第1外显子进行精确编辑, 导致特定的缺失突变.编辑后的突变体平均单倍体诱导率约为2%, 与Stock6的诱导效率相似.该研究团队进一步采用CRISPR/Cas9技术敲除ZmDMP基因后, 观察到该基因缺失单倍体诱导率提高5-6倍.这是首次在非Stock6背景下观察到的独立单倍体诱导现象, 展现出基因编辑技术在提高单倍体诱导率方面的巨大应用潜力.通过将CRISPR/Cas9基因编辑技术与传统单倍体诱导策略相结合, 创制了单倍体诱导编辑(haploid-induction editing, HI-Edit)策略(Kelliher et al., 2019)和单倍体诱导介导的基因组编辑(haploid inducer-mediated genome editing, IMGE)策略(Wang et al., 2019a).利用单倍体诱导技术可以高效生成单倍体植株, 随后通过CRISPR/Cas9或其它基因编辑技术进行目标基因的精确修改.HI-Edit策略的独特之处在于, 允许在不引入外源DNA的条件下对基因进行精准改良, 因此显著降低了对转基因技术的依赖.通过这种策略, 可在2个世代内成功培育出特定性状的纯合株系.此外, 该策略有效克服了玉米遗传转化过程中的基因型限制, 为玉米育种提供了更广泛的适用范围.在真核生物中, 着丝粒是染色体准确分离与遗传信息传递不可或缺的区域, 而特异的着丝粒组蛋白CH3 (CENH3)在识别和维持着丝粒染色质结构方面扮演着关键角色.Wang等(2021a)通过CRISPR/Cas9技术对玉米CENH3基因进行编辑, 成功创制了一个由单碱基缺失引起编辑提前终止的突变体.该突变体与野生型进行杂交后, 自交时纯合的突变体具有高度致死性, 无法通过配子传递, 而杂合子与野生型进行正反交配, 后代为单倍体或非整倍体.这表明CENH3突变可通过一次杂交转移到其它品系中, 为构建高效且简化的玉米单倍体诱导系统提供了可能. ...
在自然条件下, 大多数植物(如玉米)表现为二倍体, 即每个细胞含有2套染色体.为培育出遗传上纯合的系谱, 研究人员通过多代连续自交以确保后代基因的纯合性.而单倍体诱导技术提供了一种更为高效的方法.该技术通过特定的双单倍体(DH)途径, 诱导植物产生仅含1套染色体的细胞, 进而发育成单倍体植株.随后, 利用染色体加倍技术, 将单倍体植株转化为遗传稳定的二倍体植株, 极大地缩短了培育纯合谱系的时间(Ren et al., 2017).基于CRISPR/Cas9技术对玉米中的花粉特异性磷脂酶基因ZmPLA1进行精确编辑, Dong等(2018)成功开发出高效的孤雌生殖单倍体诱导体系; 他们还融入一个组织特异性表达的双荧光蛋白标记系统, 显著优化了单倍体的鉴别和筛选流程, 极大地提高了筛选效率, 并为作物改良中双单倍体育种技术的应用确立了新标准.Stock6 (可诱导产生单倍体的玉米突变体)作为玉米单倍体诱导育种的关键工具, 可通过杂交诱发孤雌生殖, 即使花粉与雌蕊接触, 也不形成正常的双倍体合子, 而是直接形成单倍体种子, 随后通过化学处理或温度震荡等手段进行染色体加倍, 进而形成遗传上纯合的双单倍体植株.Liu等(2017)利用CRISPR/Cas9技术对玉米ZmPLA1基因第1外显子进行精确编辑, 导致特定的缺失突变.编辑后的突变体平均单倍体诱导率约为2%, 与Stock6的诱导效率相似.该研究团队进一步采用CRISPR/Cas9技术敲除ZmDMP基因后, 观察到该基因缺失单倍体诱导率提高5-6倍.这是首次在非Stock6背景下观察到的独立单倍体诱导现象, 展现出基因编辑技术在提高单倍体诱导率方面的巨大应用潜力.通过将CRISPR/Cas9基因编辑技术与传统单倍体诱导策略相结合, 创制了单倍体诱导编辑(haploid-induction editing, HI-Edit)策略(Kelliher et al., 2019)和单倍体诱导介导的基因组编辑(haploid inducer-mediated genome editing, IMGE)策略(Wang et al., 2019a).利用单倍体诱导技术可以高效生成单倍体植株, 随后通过CRISPR/Cas9或其它基因编辑技术进行目标基因的精确修改.HI-Edit策略的独特之处在于, 允许在不引入外源DNA的条件下对基因进行精准改良, 因此显著降低了对转基因技术的依赖.通过这种策略, 可在2个世代内成功培育出特定性状的纯合株系.此外, 该策略有效克服了玉米遗传转化过程中的基因型限制, 为玉米育种提供了更广泛的适用范围.在真核生物中, 着丝粒是染色体准确分离与遗传信息传递不可或缺的区域, 而特异的着丝粒组蛋白CH3 (CENH3)在识别和维持着丝粒染色质结构方面扮演着关键角色.Wang等(2021a)通过CRISPR/Cas9技术对玉米CENH3基因进行编辑, 成功创制了一个由单碱基缺失引起编辑提前终止的突变体.该突变体与野生型进行杂交后, 自交时纯合的突变体具有高度致死性, 无法通过配子传递, 而杂合子与野生型进行正反交配, 后代为单倍体或非整倍体.这表明CENH3突变可通过一次杂交转移到其它品系中, 为构建高效且简化的玉米单倍体诱导系统提供了可能. ...
在自然条件下, 大多数植物(如玉米)表现为二倍体, 即每个细胞含有2套染色体.为培育出遗传上纯合的系谱, 研究人员通过多代连续自交以确保后代基因的纯合性.而单倍体诱导技术提供了一种更为高效的方法.该技术通过特定的双单倍体(DH)途径, 诱导植物产生仅含1套染色体的细胞, 进而发育成单倍体植株.随后, 利用染色体加倍技术, 将单倍体植株转化为遗传稳定的二倍体植株, 极大地缩短了培育纯合谱系的时间(Ren et al., 2017).基于CRISPR/Cas9技术对玉米中的花粉特异性磷脂酶基因ZmPLA1进行精确编辑, Dong等(2018)成功开发出高效的孤雌生殖单倍体诱导体系; 他们还融入一个组织特异性表达的双荧光蛋白标记系统, 显著优化了单倍体的鉴别和筛选流程, 极大地提高了筛选效率, 并为作物改良中双单倍体育种技术的应用确立了新标准.Stock6 (可诱导产生单倍体的玉米突变体)作为玉米单倍体诱导育种的关键工具, 可通过杂交诱发孤雌生殖, 即使花粉与雌蕊接触, 也不形成正常的双倍体合子, 而是直接形成单倍体种子, 随后通过化学处理或温度震荡等手段进行染色体加倍, 进而形成遗传上纯合的双单倍体植株.Liu等(2017)利用CRISPR/Cas9技术对玉米ZmPLA1基因第1外显子进行精确编辑, 导致特定的缺失突变.编辑后的突变体平均单倍体诱导率约为2%, 与Stock6的诱导效率相似.该研究团队进一步采用CRISPR/Cas9技术敲除ZmDMP基因后, 观察到该基因缺失单倍体诱导率提高5-6倍.这是首次在非Stock6背景下观察到的独立单倍体诱导现象, 展现出基因编辑技术在提高单倍体诱导率方面的巨大应用潜力.通过将CRISPR/Cas9基因编辑技术与传统单倍体诱导策略相结合, 创制了单倍体诱导编辑(haploid-induction editing, HI-Edit)策略(Kelliher et al., 2019)和单倍体诱导介导的基因组编辑(haploid inducer-mediated genome editing, IMGE)策略(Wang et al., 2019a).利用单倍体诱导技术可以高效生成单倍体植株, 随后通过CRISPR/Cas9或其它基因编辑技术进行目标基因的精确修改.HI-Edit策略的独特之处在于, 允许在不引入外源DNA的条件下对基因进行精准改良, 因此显著降低了对转基因技术的依赖.通过这种策略, 可在2个世代内成功培育出特定性状的纯合株系.此外, 该策略有效克服了玉米遗传转化过程中的基因型限制, 为玉米育种提供了更广泛的适用范围.在真核生物中, 着丝粒是染色体准确分离与遗传信息传递不可或缺的区域, 而特异的着丝粒组蛋白CH3 (CENH3)在识别和维持着丝粒染色质结构方面扮演着关键角色.Wang等(2021a)通过CRISPR/Cas9技术对玉米CENH3基因进行编辑, 成功创制了一个由单碱基缺失引起编辑提前终止的突变体.该突变体与野生型进行杂交后, 自交时纯合的突变体具有高度致死性, 无法通过配子传递, 而杂合子与野生型进行正反交配, 后代为单倍体或非整倍体.这表明CENH3突变可通过一次杂交转移到其它品系中, 为构建高效且简化的玉米单倍体诱导系统提供了可能. ...
在自然条件下, 大多数植物(如玉米)表现为二倍体, 即每个细胞含有2套染色体.为培育出遗传上纯合的系谱, 研究人员通过多代连续自交以确保后代基因的纯合性.而单倍体诱导技术提供了一种更为高效的方法.该技术通过特定的双单倍体(DH)途径, 诱导植物产生仅含1套染色体的细胞, 进而发育成单倍体植株.随后, 利用染色体加倍技术, 将单倍体植株转化为遗传稳定的二倍体植株, 极大地缩短了培育纯合谱系的时间(Ren et al., 2017).基于CRISPR/Cas9技术对玉米中的花粉特异性磷脂酶基因ZmPLA1进行精确编辑, Dong等(2018)成功开发出高效的孤雌生殖单倍体诱导体系; 他们还融入一个组织特异性表达的双荧光蛋白标记系统, 显著优化了单倍体的鉴别和筛选流程, 极大地提高了筛选效率, 并为作物改良中双单倍体育种技术的应用确立了新标准.Stock6 (可诱导产生单倍体的玉米突变体)作为玉米单倍体诱导育种的关键工具, 可通过杂交诱发孤雌生殖, 即使花粉与雌蕊接触, 也不形成正常的双倍体合子, 而是直接形成单倍体种子, 随后通过化学处理或温度震荡等手段进行染色体加倍, 进而形成遗传上纯合的双单倍体植株.Liu等(2017)利用CRISPR/Cas9技术对玉米ZmPLA1基因第1外显子进行精确编辑, 导致特定的缺失突变.编辑后的突变体平均单倍体诱导率约为2%, 与Stock6的诱导效率相似.该研究团队进一步采用CRISPR/Cas9技术敲除ZmDMP基因后, 观察到该基因缺失单倍体诱导率提高5-6倍.这是首次在非Stock6背景下观察到的独立单倍体诱导现象, 展现出基因编辑技术在提高单倍体诱导率方面的巨大应用潜力.通过将CRISPR/Cas9基因编辑技术与传统单倍体诱导策略相结合, 创制了单倍体诱导编辑(haploid-induction editing, HI-Edit)策略(Kelliher et al., 2019)和单倍体诱导介导的基因组编辑(haploid inducer-mediated genome editing, IMGE)策略(Wang et al., 2019a).利用单倍体诱导技术可以高效生成单倍体植株, 随后通过CRISPR/Cas9或其它基因编辑技术进行目标基因的精确修改.HI-Edit策略的独特之处在于, 允许在不引入外源DNA的条件下对基因进行精准改良, 因此显著降低了对转基因技术的依赖.通过这种策略, 可在2个世代内成功培育出特定性状的纯合株系.此外, 该策略有效克服了玉米遗传转化过程中的基因型限制, 为玉米育种提供了更广泛的适用范围.在真核生物中, 着丝粒是染色体准确分离与遗传信息传递不可或缺的区域, 而特异的着丝粒组蛋白CH3 (CENH3)在识别和维持着丝粒染色质结构方面扮演着关键角色.Wang等(2021a)通过CRISPR/Cas9技术对玉米CENH3基因进行编辑, 成功创制了一个由单碱基缺失引起编辑提前终止的突变体.该突变体与野生型进行杂交后, 自交时纯合的突变体具有高度致死性, 无法通过配子传递, 而杂合子与野生型进行正反交配, 后代为单倍体或非整倍体.这表明CENH3突变可通过一次杂交转移到其它品系中, 为构建高效且简化的玉米单倍体诱导系统提供了可能. ...
在自然条件下, 大多数植物(如玉米)表现为二倍体, 即每个细胞含有2套染色体.为培育出遗传上纯合的系谱, 研究人员通过多代连续自交以确保后代基因的纯合性.而单倍体诱导技术提供了一种更为高效的方法.该技术通过特定的双单倍体(DH)途径, 诱导植物产生仅含1套染色体的细胞, 进而发育成单倍体植株.随后, 利用染色体加倍技术, 将单倍体植株转化为遗传稳定的二倍体植株, 极大地缩短了培育纯合谱系的时间(Ren et al., 2017).基于CRISPR/Cas9技术对玉米中的花粉特异性磷脂酶基因ZmPLA1进行精确编辑, Dong等(2018)成功开发出高效的孤雌生殖单倍体诱导体系; 他们还融入一个组织特异性表达的双荧光蛋白标记系统, 显著优化了单倍体的鉴别和筛选流程, 极大地提高了筛选效率, 并为作物改良中双单倍体育种技术的应用确立了新标准.Stock6 (可诱导产生单倍体的玉米突变体)作为玉米单倍体诱导育种的关键工具, 可通过杂交诱发孤雌生殖, 即使花粉与雌蕊接触, 也不形成正常的双倍体合子, 而是直接形成单倍体种子, 随后通过化学处理或温度震荡等手段进行染色体加倍, 进而形成遗传上纯合的双单倍体植株.Liu等(2017)利用CRISPR/Cas9技术对玉米ZmPLA1基因第1外显子进行精确编辑, 导致特定的缺失突变.编辑后的突变体平均单倍体诱导率约为2%, 与Stock6的诱导效率相似.该研究团队进一步采用CRISPR/Cas9技术敲除ZmDMP基因后, 观察到该基因缺失单倍体诱导率提高5-6倍.这是首次在非Stock6背景下观察到的独立单倍体诱导现象, 展现出基因编辑技术在提高单倍体诱导率方面的巨大应用潜力.通过将CRISPR/Cas9基因编辑技术与传统单倍体诱导策略相结合, 创制了单倍体诱导编辑(haploid-induction editing, HI-Edit)策略(Kelliher et al., 2019)和单倍体诱导介导的基因组编辑(haploid inducer-mediated genome editing, IMGE)策略(Wang et al., 2019a).利用单倍体诱导技术可以高效生成单倍体植株, 随后通过CRISPR/Cas9或其它基因编辑技术进行目标基因的精确修改.HI-Edit策略的独特之处在于, 允许在不引入外源DNA的条件下对基因进行精准改良, 因此显著降低了对转基因技术的依赖.通过这种策略, 可在2个世代内成功培育出特定性状的纯合株系.此外, 该策略有效克服了玉米遗传转化过程中的基因型限制, 为玉米育种提供了更广泛的适用范围.在真核生物中, 着丝粒是染色体准确分离与遗传信息传递不可或缺的区域, 而特异的着丝粒组蛋白CH3 (CENH3)在识别和维持着丝粒染色质结构方面扮演着关键角色.Wang等(2021a)通过CRISPR/Cas9技术对玉米CENH3基因进行编辑, 成功创制了一个由单碱基缺失引起编辑提前终止的突变体.该突变体与野生型进行杂交后, 自交时纯合的突变体具有高度致死性, 无法通过配子传递, 而杂合子与野生型进行正反交配, 后代为单倍体或非整倍体.这表明CENH3突变可通过一次杂交转移到其它品系中, 为构建高效且简化的玉米单倍体诱导系统提供了可能. ...
在自然条件下, 大多数植物(如玉米)表现为二倍体, 即每个细胞含有2套染色体.为培育出遗传上纯合的系谱, 研究人员通过多代连续自交以确保后代基因的纯合性.而单倍体诱导技术提供了一种更为高效的方法.该技术通过特定的双单倍体(DH)途径, 诱导植物产生仅含1套染色体的细胞, 进而发育成单倍体植株.随后, 利用染色体加倍技术, 将单倍体植株转化为遗传稳定的二倍体植株, 极大地缩短了培育纯合谱系的时间(Ren et al., 2017).基于CRISPR/Cas9技术对玉米中的花粉特异性磷脂酶基因ZmPLA1进行精确编辑, Dong等(2018)成功开发出高效的孤雌生殖单倍体诱导体系; 他们还融入一个组织特异性表达的双荧光蛋白标记系统, 显著优化了单倍体的鉴别和筛选流程, 极大地提高了筛选效率, 并为作物改良中双单倍体育种技术的应用确立了新标准.Stock6 (可诱导产生单倍体的玉米突变体)作为玉米单倍体诱导育种的关键工具, 可通过杂交诱发孤雌生殖, 即使花粉与雌蕊接触, 也不形成正常的双倍体合子, 而是直接形成单倍体种子, 随后通过化学处理或温度震荡等手段进行染色体加倍, 进而形成遗传上纯合的双单倍体植株.Liu等(2017)利用CRISPR/Cas9技术对玉米ZmPLA1基因第1外显子进行精确编辑, 导致特定的缺失突变.编辑后的突变体平均单倍体诱导率约为2%, 与Stock6的诱导效率相似.该研究团队进一步采用CRISPR/Cas9技术敲除ZmDMP基因后, 观察到该基因缺失单倍体诱导率提高5-6倍.这是首次在非Stock6背景下观察到的独立单倍体诱导现象, 展现出基因编辑技术在提高单倍体诱导率方面的巨大应用潜力.通过将CRISPR/Cas9基因编辑技术与传统单倍体诱导策略相结合, 创制了单倍体诱导编辑(haploid-induction editing, HI-Edit)策略(Kelliher et al., 2019)和单倍体诱导介导的基因组编辑(haploid inducer-mediated genome editing, IMGE)策略(Wang et al., 2019a).利用单倍体诱导技术可以高效生成单倍体植株, 随后通过CRISPR/Cas9或其它基因编辑技术进行目标基因的精确修改.HI-Edit策略的独特之处在于, 允许在不引入外源DNA的条件下对基因进行精准改良, 因此显著降低了对转基因技术的依赖.通过这种策略, 可在2个世代内成功培育出特定性状的纯合株系.此外, 该策略有效克服了玉米遗传转化过程中的基因型限制, 为玉米育种提供了更广泛的适用范围.在真核生物中, 着丝粒是染色体准确分离与遗传信息传递不可或缺的区域, 而特异的着丝粒组蛋白CH3 (CENH3)在识别和维持着丝粒染色质结构方面扮演着关键角色.Wang等(2021a)通过CRISPR/Cas9技术对玉米CENH3基因进行编辑, 成功创制了一个由单碱基缺失引起编辑提前终止的突变体.该突变体与野生型进行杂交后, 自交时纯合的突变体具有高度致死性, 无法通过配子传递, 而杂合子与野生型进行正反交配, 后代为单倍体或非整倍体.这表明CENH3突变可通过一次杂交转移到其它品系中, 为构建高效且简化的玉米单倍体诱导系统提供了可能. ...
在自然条件下, 大多数植物(如玉米)表现为二倍体, 即每个细胞含有2套染色体.为培育出遗传上纯合的系谱, 研究人员通过多代连续自交以确保后代基因的纯合性.而单倍体诱导技术提供了一种更为高效的方法.该技术通过特定的双单倍体(DH)途径, 诱导植物产生仅含1套染色体的细胞, 进而发育成单倍体植株.随后, 利用染色体加倍技术, 将单倍体植株转化为遗传稳定的二倍体植株, 极大地缩短了培育纯合谱系的时间(Ren et al., 2017).基于CRISPR/Cas9技术对玉米中的花粉特异性磷脂酶基因ZmPLA1进行精确编辑, Dong等(2018)成功开发出高效的孤雌生殖单倍体诱导体系; 他们还融入一个组织特异性表达的双荧光蛋白标记系统, 显著优化了单倍体的鉴别和筛选流程, 极大地提高了筛选效率, 并为作物改良中双单倍体育种技术的应用确立了新标准.Stock6 (可诱导产生单倍体的玉米突变体)作为玉米单倍体诱导育种的关键工具, 可通过杂交诱发孤雌生殖, 即使花粉与雌蕊接触, 也不形成正常的双倍体合子, 而是直接形成单倍体种子, 随后通过化学处理或温度震荡等手段进行染色体加倍, 进而形成遗传上纯合的双单倍体植株.Liu等(2017)利用CRISPR/Cas9技术对玉米ZmPLA1基因第1外显子进行精确编辑, 导致特定的缺失突变.编辑后的突变体平均单倍体诱导率约为2%, 与Stock6的诱导效率相似.该研究团队进一步采用CRISPR/Cas9技术敲除ZmDMP基因后, 观察到该基因缺失单倍体诱导率提高5-6倍.这是首次在非Stock6背景下观察到的独立单倍体诱导现象, 展现出基因编辑技术在提高单倍体诱导率方面的巨大应用潜力.通过将CRISPR/Cas9基因编辑技术与传统单倍体诱导策略相结合, 创制了单倍体诱导编辑(haploid-induction editing, HI-Edit)策略(Kelliher et al., 2019)和单倍体诱导介导的基因组编辑(haploid inducer-mediated genome editing, IMGE)策略(Wang et al., 2019a).利用单倍体诱导技术可以高效生成单倍体植株, 随后通过CRISPR/Cas9或其它基因编辑技术进行目标基因的精确修改.HI-Edit策略的独特之处在于, 允许在不引入外源DNA的条件下对基因进行精准改良, 因此显著降低了对转基因技术的依赖.通过这种策略, 可在2个世代内成功培育出特定性状的纯合株系.此外, 该策略有效克服了玉米遗传转化过程中的基因型限制, 为玉米育种提供了更广泛的适用范围.在真核生物中, 着丝粒是染色体准确分离与遗传信息传递不可或缺的区域, 而特异的着丝粒组蛋白CH3 (CENH3)在识别和维持着丝粒染色质结构方面扮演着关键角色.Wang等(2021a)通过CRISPR/Cas9技术对玉米CENH3基因进行编辑, 成功创制了一个由单碱基缺失引起编辑提前终止的突变体.该突变体与野生型进行杂交后, 自交时纯合的突变体具有高度致死性, 无法通过配子传递, 而杂合子与野生型进行正反交配, 后代为单倍体或非整倍体.这表明CENH3突变可通过一次杂交转移到其它品系中, 为构建高效且简化的玉米单倍体诱导系统提供了可能. ...
在自然条件下, 大多数植物(如玉米)表现为二倍体, 即每个细胞含有2套染色体.为培育出遗传上纯合的系谱, 研究人员通过多代连续自交以确保后代基因的纯合性.而单倍体诱导技术提供了一种更为高效的方法.该技术通过特定的双单倍体(DH)途径, 诱导植物产生仅含1套染色体的细胞, 进而发育成单倍体植株.随后, 利用染色体加倍技术, 将单倍体植株转化为遗传稳定的二倍体植株, 极大地缩短了培育纯合谱系的时间(Ren et al., 2017).基于CRISPR/Cas9技术对玉米中的花粉特异性磷脂酶基因ZmPLA1进行精确编辑, Dong等(2018)成功开发出高效的孤雌生殖单倍体诱导体系; 他们还融入一个组织特异性表达的双荧光蛋白标记系统, 显著优化了单倍体的鉴别和筛选流程, 极大地提高了筛选效率, 并为作物改良中双单倍体育种技术的应用确立了新标准.Stock6 (可诱导产生单倍体的玉米突变体)作为玉米单倍体诱导育种的关键工具, 可通过杂交诱发孤雌生殖, 即使花粉与雌蕊接触, 也不形成正常的双倍体合子, 而是直接形成单倍体种子, 随后通过化学处理或温度震荡等手段进行染色体加倍, 进而形成遗传上纯合的双单倍体植株.Liu等(2017)利用CRISPR/Cas9技术对玉米ZmPLA1基因第1外显子进行精确编辑, 导致特定的缺失突变.编辑后的突变体平均单倍体诱导率约为2%, 与Stock6的诱导效率相似.该研究团队进一步采用CRISPR/Cas9技术敲除ZmDMP基因后, 观察到该基因缺失单倍体诱导率提高5-6倍.这是首次在非Stock6背景下观察到的独立单倍体诱导现象, 展现出基因编辑技术在提高单倍体诱导率方面的巨大应用潜力.通过将CRISPR/Cas9基因编辑技术与传统单倍体诱导策略相结合, 创制了单倍体诱导编辑(haploid-induction editing, HI-Edit)策略(Kelliher et al., 2019)和单倍体诱导介导的基因组编辑(haploid inducer-mediated genome editing, IMGE)策略(Wang et al., 2019a).利用单倍体诱导技术可以高效生成单倍体植株, 随后通过CRISPR/Cas9或其它基因编辑技术进行目标基因的精确修改.HI-Edit策略的独特之处在于, 允许在不引入外源DNA的条件下对基因进行精准改良, 因此显著降低了对转基因技术的依赖.通过这种策略, 可在2个世代内成功培育出特定性状的纯合株系.此外, 该策略有效克服了玉米遗传转化过程中的基因型限制, 为玉米育种提供了更广泛的适用范围.在真核生物中, 着丝粒是染色体准确分离与遗传信息传递不可或缺的区域, 而特异的着丝粒组蛋白CH3 (CENH3)在识别和维持着丝粒染色质结构方面扮演着关键角色.Wang等(2021a)通过CRISPR/Cas9技术对玉米CENH3基因进行编辑, 成功创制了一个由单碱基缺失引起编辑提前终止的突变体.该突变体与野生型进行杂交后, 自交时纯合的突变体具有高度致死性, 无法通过配子传递, 而杂合子与野生型进行正反交配, 后代为单倍体或非整倍体.这表明CENH3突变可通过一次杂交转移到其它品系中, 为构建高效且简化的玉米单倍体诱导系统提供了可能. ...
本文的其它图/表
-
 表1
CRISPR/Cas及其衍生技术
表1
CRISPR/Cas及其衍生技术
-
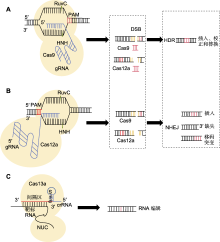 图1
CRISPR/Cas基因编辑系统工作原理
图1
CRISPR/Cas基因编辑系统工作原理
(A) Cas9蛋白利用结构域RuvC在原间隔区邻近基序(PAM)序列附近的特定单链DNA上切割, 随后, HNH的结构域与sgRNA配对的DNA另一条单链进行切割形成双链断裂(DSB), 最终进行同源定向修复(HDR)或非同源末端连接(NHEJ)修复成双链; (B) Cas12a通过crRNA介导识别5'-TTTN或5'-TTN的PAM序列; (C) 当crRNA与靶标RNA通过碱基互补配对结合后, 形成crRNA-Cas13复合物, 导致Cas13蛋白构象发生变化, 从而激活其RNA切割活性, 使其能够特异性识别并结合靶标RNA进行切割
-
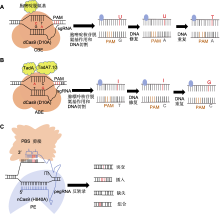 图2
碱基编辑器技术工作原理
图2
碱基编辑器技术工作原理
(A) sgRNA识别并结合到目标DNA序列特定的原间隔区邻近基序(PAM)位点, dCas9蛋白则与sgRNA结合, 形成复合物并结合于目标DNA上, 但不切割DNA双链, 仅使其单链化; 随后胞嘧啶脱氨酶在sgRNA的引导下, 接触到暴露的单链DNA上的胞嘧啶, 并催化其脱氨反应, 将胞嘧啶转化为尿嘧啶; 最后在DNA重复或修复过程中, 尿嘧啶被视为胸腺嘧啶的类似物, 从而纳入到新合成的DNA链中, 实现C-G碱基对到T-A碱基对的直接替换; (B) 利用CRISPR-Cas9系统中的sgRNA识别并结合到目标DNA序列的PAM位点, Cas9蛋白与sgRNA结合形成复合物, 并定位于目标DNA上; ABE中的腺嘌呤脱氨酶在sgRNA的引导下, 接触到暴露的单链DNA上的腺嘌呤, 并催化其脱氨反应, 将腺嘌呤转化为次黄嘌呤或脱氧次黄嘌呤; 最后在DNA修复过程中, 识别到次黄嘌呤后, 启动修复过程, 中间产物通常被替换为鸟嘌呤, 从而实现A-T碱基对到G-C碱基对的直接替换; (C) 利用pegRNA作为引导分子结合sgRNA, 并在其3'末端增加引物结合位点(PBS)序列和逆转录模板(RTT); 在pegRNA的引导下, 部分失活的Cas9切口酶切断含PAM序列的DNA单链; 切割后的DNA单链与pegRNA的3'末端PBS序列互补并结合, 随后逆转录酶沿RTT模板序列开始逆转录反应, 将目标编辑序列直接引到DNA切口处; 随后细胞内DNA修复机制识别并处理切口处的DNA结构, 最终保留携带目标编辑的DNA链。CBE、ABE和PE同表1。
|
