
|
|
||
|
水稻中乙烯生物合成关键酶OsACS和OsACO调控机制研究进展
植物学报
2024, 59 (2):
291-301.
DOI: 10.11983/CBB23143
乙烯在调控水稻(Oryza sativa)生长发育及胁迫响应中具有重要作用。乙烯生物合成的第1步是甲硫氨酸转化为S-腺苷甲硫氨酸(SAM), 然后在ACC合酶(ACS)的催化下合成乙烯前体物质ACC, 最后通过ACC氧化酶(ACO)生成乙烯。该文综述了水稻乙烯生物合成途径中2个关键酶OsACS和OsACO在转录及翻译后的调控机制, 提出了一些未解决的问题, 并展望了未来的研究方向, 以期加深人们对乙烯生物合成复杂机制的理解。 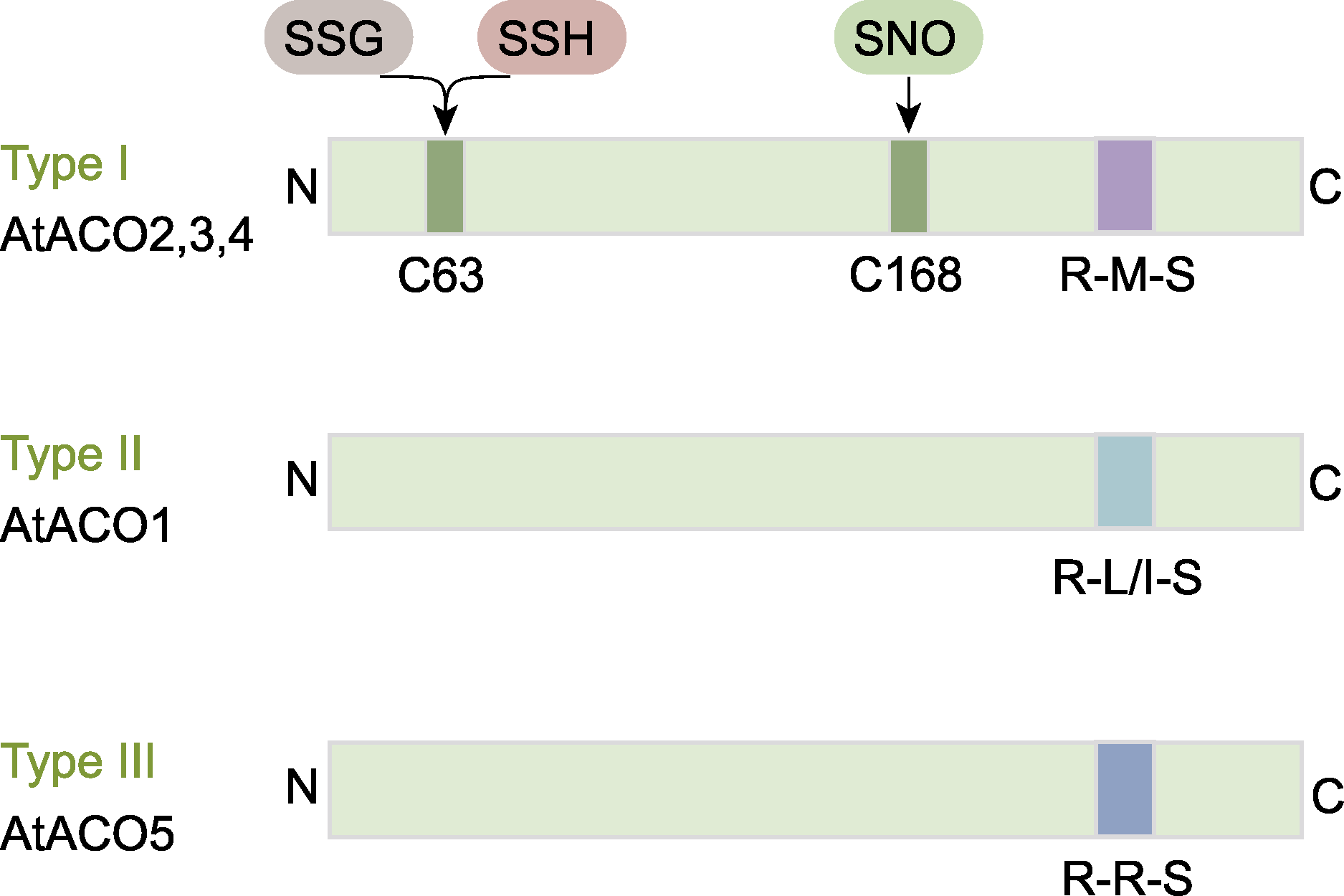 View image in article
图7
拟南芥3种亚型的ACO蛋白结构(参考Pattyn et al.,
C63位点的翻译后修饰包括S-谷胱甘肽化(SSG)和S-硫巯基化(SSH); C168位点的修饰包括S-亚硝基化(SNO)。ACO同
正文中引用本图/表的段落
ACO是非血红素含铁蛋白质, 属于2-酮戊二酸依赖的双加氧酶(2OGD)超家族成员。其以Fe2+为辅助因子, 需要共底物2-酮戊二酸介导分子氧的活化来氧化底物, 且其含有9个保守的氨基酸残基(Kawai et al., 2014)。在水稻中, OsACO是多基因家族, 目前已在水稻基因组中发现了7个OsACO基因, 包括OsACO1 (Os09g0451400)、OsACO2 (Os09g0451000)、OsACO3 (Os02g0771600)、OsACO4 (Os11g0186900)、OsACO5 (Os05g0149400)、OsACO6 (Os05g0149300)和OsACO7 (Os01g0580500)。有趣的是, 不同于其它物种的ACO基因, 大多数水稻的OsACOs基因结构并不是典型的4个外显子结构(Ou-yang et al., 2007)。Iwai等(2006)通过序列比对, 发现OsACO6是编码截短ACO蛋白的假基因, OsACO4缺少ACO蛋白家族保守的A30和H42残基, OsACO5缺少保守的A30残基, 推测这3个OsACO蛋白可能不行使功能, 但有待进一步验证。通过比对OsACOs氨基酸全长序列可将其分为Type I-III三个亚型(Houben and Van de Poel, 2019), 每个亚型的RXS motif含有不同的X残基, 恰好对应3个不同的亚型。OsACO1、OsACO2和OsACO3属于I型, 其RXS motif为R-M-S序列; OsACO7属于II型, 为R-L/I-S序列; OsACO4和OsACO5属于III型, 为R-R-S序列(图5-图7)。其中, R244和S246是RXS motif中高度保守的2个残基, 对ACC的结合及ACO酶的催化活性具有重要作用(Dilley et al., 2013)。关于3种亚型的ACOs在功能上(如酶活性及蛋白稳定性)是否存在差异仍缺乏相关生理生化及遗传学证据, 有待进一步探索(Houben and Van de Poel, 2019)。
在拟南芥中, 已发现AtACO2含有2个保守的半胱氨酸残基C63和C168, 可能与翻译后修饰有关。AtACO2的C63位点能够被S-谷胱甘肽化(S-glutathionylation, SSG)修饰 (Datta et al., 2015), C168位点能够被S-亚硝基化(S-nitrosylation, SNO) (Hu et al., 2015)。此外, 与AtACO2同属Type I型的AtACO4存在S-硫巯基化(S-sulfhydration, SSH)修饰(Aroca et al., 2017)。基于番茄SlACO1和SlACO2已证实C60是SSH修饰位点(Jia et al., 2018)。通过对拟南芥AtACO2、AtACO4与番茄SlACO1和SlACO2进行蛋白序列比对, 推测拟南芥Type I型AtACO (以AtACO2为例)的C63可能是SSH修饰的潜在位点(图7)。因此, 基于已知的拟南芥Type I型AtACOs翻译后修饰位点(图7), 我们进一步将水稻OsACOs与拟南芥AtACO2进行蛋白序列比对, 发现水稻OsACOs的C63位点与拟南芥的保守性较低, 但C168位点与拟南芥的保守性较高(图8), 推测其可能是SNO修饰的潜在位点, 有待进一步实验验证。
目前, 关于植物中ACO蛋白翻译后水平调控的研究较少。研究表明, NatB介导的ACO2蛋白N端的乙酰化修饰(N-terminal acetylation, NTA)可增强拟南芥AtACO2的稳定性, 从而促进乙烯合成(Liu et al., 2021)。前文已总结了拟南芥AtACO半胱氨酸(Cys)残基通过特异性氧化还原进行翻译后修饰的相关研究。AtACO2的C63位点发生S-谷胱甘肽化(SSG)修饰(Datta et al., 2015), 其C168位点发生S-亚硝基化(SNO)修饰(Hu et al., 2015)。但这些翻译后修饰对AtACO蛋白的稳定性及活性的影响有待深入研究。近期, 在番茄中发现SlACOh4 (ACO homolog 4)的C172位点也能被S-亚硝基化并提高其活性, 从而促进乙烯合成以维持植物体内K+/Na+稳态, 进而提高耐盐性(Liu et al., 2023)。在水稻中, 对于OsACO翻译后调控机制仍知之甚少。鉴于水稻中C168位点与拟南芥的保守性较高(图7), 推测其可能是潜在的SNO修饰位点, 可作为后续深入研究的切入点。
本文的其它图/表
|