水稻中乙烯生物合成关键酶OsACS和OsACO调控机制研究进展
夏婧, 饶玉春, 曹丹芸, 王逸, 柳林昕, 徐雅婷, 牟望舒, 薛大伟
植物学报
2024, 59 ( 2):
291-301.
DOI: 10.11983/CBB23143
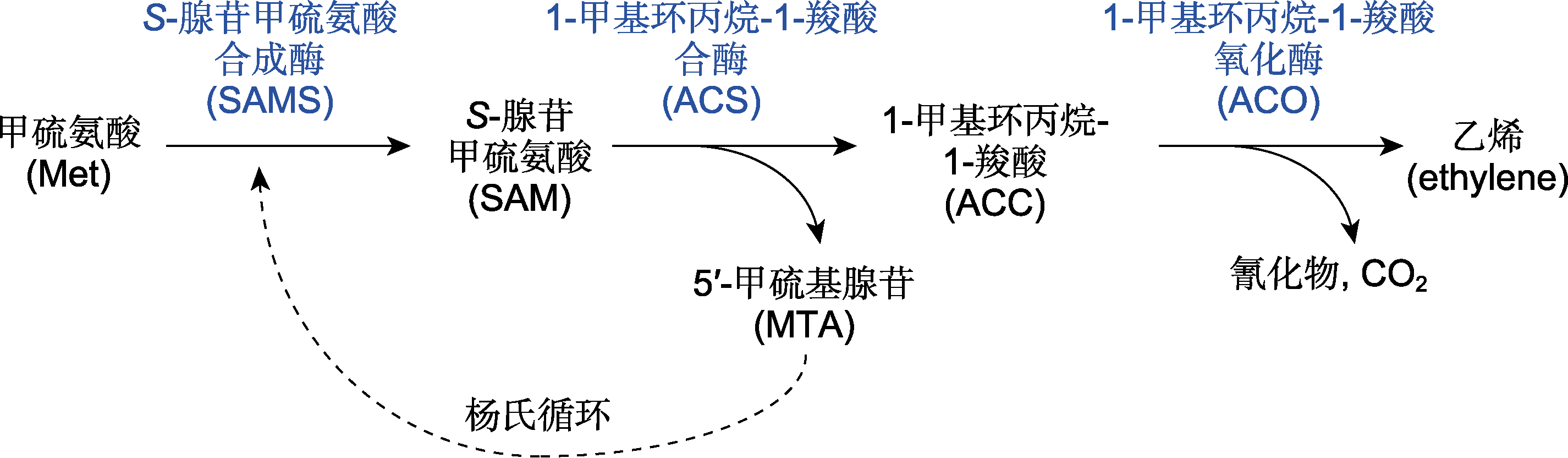
乙烯在调控水稻(Oryza sativa)生长发育及胁迫响应中具有重要作用。乙烯生物合成的第1步是甲硫氨酸转化为S-腺苷甲硫氨酸(SAM), 然后在ACC合酶(ACS)的催化下合成乙烯前体物质ACC, 最后通过ACC氧化酶(ACO)生成乙烯。该文综述了水稻乙烯生物合成途径中2个关键酶OsACS和OsACO在转录及翻译后的调控机制, 提出了一些未解决的问题, 并展望了未来的研究方向, 以期加深人们对乙烯生物合成复杂机制的理解。
View image in article
图1
乙烯生物合成途径(参考Park et al., 2021)
正文中引用本图/表的段落
在高等植物中, 乙烯的生物合成通路已得到阐明(图1)。简单来说, 乙烯的生物合成始于甲硫氨酸(methionine, Met), Met在S-腺苷甲硫氨酸(S-adenosyl methionine, SAM)合成酶(SAM synthetase, SAMS)的作用下合成SAM。然后在1-甲基环丙烷-1-羧酸(1-amino- cyclopropane-1-carboxylic acid, ACC)合酶(ACC synthase, ACS)的作用下合成ACC和副产物5′-甲硫基腺苷(5′-methylthioadenosine, MTA), 这是乙烯合成的主要限速步骤, 且ACS被认为是关键限速酶(Tsuchisaka and Theologis, 2004; Lee et al., 2017)。最后, ACC被ACC氧化酶(ACC oxidase, ACO)氧化, 生成乙烯、CO2和氰化物。同时, 副产物MTA通过杨氏循环(Yang cycle)重新转化为甲硫氨酸, 以确保乙烯生物合成的持续进行, 且不需要合成新的甲硫氨酸(Zhou et al., 2020; Park et al., 2021)。基于水稻OsACS和OsACO与拟南芥序列的相似性及其功能验证, 可知水稻中乙烯合成途径具有一定的保守性(Zhou et al., 2020)。目前在水稻中已鉴定出多个乙烯合成通路基因, 其中多数研究集中在关键酶OsACS和OsACO上。
Post-translational modifications at C63 include S-glutathionylation (SSG) and S-sulfhydration (SSH), while modifications at C168 involve S-nitrosylation (SNO). ACO is the same as shown in Figure 5. ... Rice OsDOF15 contributes to ethylene-inhibited primary root elongation under salt stress 1 2019 ... 水稻OsACSs基因的转录水平受多种转录因子调控.Yoon等(2020)通过ChIP分析发现, 锌指同源(ZF- HD)蛋白家族中的OsZHD2直接与OsACS5的启动子区域结合并激活其转录, 从而诱导乙烯的生物合成.Zhang等(2013)发现转录抑制因子OsERF3依赖其C端的保守结构EAR-motif (DLNRPPP)负调控OsACS2和OsACS6的表达, 抑制乙烯合成, 从而负调控水稻在苗期及分蘖期的抗旱能力.DOF (DNA-binding with one finger)蛋白是植物转录因子中的主要家族之一.水稻OsDOF15转录因子能够识别并结合OsACS1启动子区域的AAAG基序从而抑制其转录, 负调控水稻中乙烯生物合成, 促进水稻主根伸长(Qin et al., 2019).因此, 上述转录因子通过调控OsACSs基因的转录水平来影响乙烯的生物合成, 进而调控水稻生长发育及胁迫响应相关的生理过程. ... NAC transcription factor SPEEDY HYPONASTIC GROWTH regulates flooding-induced leaf movement in Arabidopsis 1 2013 ... 目前, 已在植物中发现部分转录因子家族调控ACO的表达.在拟南芥中, WRKY家族的转录激活因子WRKY29能够识别并结合AtACO5启动子区的保守结构域W-box (TTGAC(C/T)), 从而激活AtACO5的表达(Wang et al., 2023).NAC家族的III类转录因子SHYG (SPEEDY HYPONASTIC GROWTH)能够与AtACO5的启动子结合, 激活其转录(Rauf et al., 2013).近年来, 也有研究表明, 水稻中NAC转录因子家族在调控ACO转录水平上发挥重要作用.Yu等(2021)通过ChIP技术及酵母单杂交实验证实, 转录因子OsNAC2能够直接与OsACO3的启动子结合, 促进乙烯的生物合成.此外, 转录因子OsBIHD1含有植物抗性基因Pik-H4的同源结构域, 通过直接与OsACO3启动子结合的方式上调OsACO3的表达水平, 激活乙烯依赖防御途径(Liu et al., 2017).OsACO1的启动子区域含有GCC box (AGCCGCC), OsEBL1可能与该位点结合从而激活其转录(Iwamoto and Takano, 2011).除转录因子外, 非编码RNA对水稻ACO的转录调控也具有重要作用.Ahmadizadeh等(2020)利用软件预测水稻中osa-miR5809和osa-miR531可能与OsACOs靶向结合, 从而抑制其转录, 但仍需通过实验进一步验证其调控功能. ... Contrary effects of ethylene and ACC on cell growth in the liverwort Riella helicophylla 1 1989 ... 在高等植物中, 乙烯的生物合成途径虽然较为简单, 但其调控机制极为复杂, 受到包括转录及翻译后水平多个层次的调控.虽然在拟南芥中对乙烯合成的调控机制已有广泛的研究并取得了显著进展, 但是在水稻中的研究却相对有限.ACS作为乙烯合成通路的关键限速酶, 对其在转录以及翻译后调控的研究较为深入.Ahmadizadeh等(2020)通过生物信息学分析, 发现水稻ACS蛋白存在糖基化位点, 这可能作为一种新的翻译后修饰方式, 有待进一步研究; 而绝大多数ACO蛋白无糖基化位点, 磷酸化位点也较少, 其磷酸化程度低于ACS蛋白, 因此关于ACO的翻译后修饰方式仍需进一步探索.鉴于在水稻中构建的osetol1突变体可过量积累ACC进而促进乙烯的释放, 后续可考虑以osetol1突变体为材料, 通过正向遗传学手段(如EMS诱变)筛选出乙烯合成缺失突变体, 基于其本身可稳定ACS酶活性以维持ACC含量处于较高水平, 将更容易筛选出调控ACC转化为乙烯的关键酶OsACO的关键基因.近年来, 研究发现乙烯前体物质ACC也可以作为独立于乙烯的信号分子参与调控多种生理过程.例如, 在高等植物中, ACC能够独立调控拟南芥根细胞壁代谢(Xu, 2008)、早期营养器官生长(Vanderstraeten et al., 2019)、气孔发育(Yin et al., 2019)以及胚珠对花粉管的吸引(Mou et al., 2020); 调控番茄花粉管伸长(Althiab-Almasaud et al., 2021)及抗病(Tsolakidou et al., 2019); 在低等植物中, ACC能够独立调控苔类植物Riella helicophylla的芽孢柱细胞伸长(Stange and Osborne, 1989)和水生红藻植物Pyropia yezoensis的生殖器官发育(Uji et al., 2020), 以及抑制地钱(Marchantia polymorpha)叶状体及芽孢的生长(Li et al., 2020).因此, ACS作为催化ACC合成的酶, 对其调控机制的研究不仅拓宽了对乙烯合成通路的认识, 而且能够推动ACC作为独立于乙烯的信号分子研究取得更多成果.此外, Van de Poel等(2012, 2014a, 2014b)发现在番茄特定的生长发育阶段, ACO也作为乙烯合成的关键限速酶调控乙烯合成.这说明ACO的调控机制可能比预期更复杂.目前, 我们对于水稻OsACS和OsACO调控机制的认识仍是冰山一角.鉴于乙烯对水稻生长发育及逆境响应等生理过程起重要作用, 故对这2种关键酶的调控机制进行深入研究具有重要科学意义及应用价值. ... Casein kinase 1 regulates ethylene synthesis by phosphorylating and promoting the turnover of ACS5 1 2014 ... ACS蛋白翻译后水平调控在拟南芥中已得到较深入的研究, 其中磷酸化和26S蛋白酶体介导的泛素化是2种重要的调控方式.磷酸化对Type I和Type II型ACS蛋白均具有调控作用.例如, 拟南芥MPK3/ MPK6通过磷酸化Type I型ACS蛋白(AtACS2/6)的C端增强其稳定性, 保护AtACS2/6不被26S蛋白酶体降解, 从而促进乙烯的合成(Joo et al., 2008; Han et al., 2010).相反, 脱落酸信号通路负调控元件ABI1 (磷酸酶PP2C)与AtACS6互作, 使其C端去磷酸化而导致活性下降, 且负调控MPK6的活性进而影响其下游底物ACS6的稳定性(Ludwików et al., 2014).此外, 重金属Cd胁迫会降低拟南芥磷酸酶PP2A的活性, 减弱对ACS6的去磷酸化作用, 增强ACS6的稳定性, 导致乙烯合成增加, 从而抑制植物的生长(Chen et al., 2020).在水稻中, Li等(2014)发现盐胁迫可诱导凝集素类受体激酶SIT1, 并激活其下游MPK3/MPK6信号级联反应, 从而促进乙烯的释放, 同时发现OsACS2的表达显著上调, 推测水稻SlT1-MPK3/6级联可能也通过类似拟南芥MKK9-MPK3/6稳定AtACS2/ACS6的机制来提高OsACS的活性以促进乙烯的合成.在拟南芥中, Type II型ACS蛋白含有1个E3泛素连接酶结合位点TOE, 酪蛋白激酶CK1.8通过磷酸化TOE结构中的T463位点促进AtACS5与E3泛素连接酶ETO1的相互作用, 以加速AtACS5的降解(Tan and Xue, 2014).此外, 拟南芥14-3-3蛋白也通过依赖磷酸化的方式与其它蛋白互作, 从而参与调控ACS的稳定性(Freeman and Morrison, 2011).例如, 拟南芥14-3-3蛋白不仅直接与ACS5互作维持ACS5的稳定性, 而且与ETO1/EOLs互作使其降解, 进而正调控ACS5蛋白活性(Yoon and Kieber, 2013a).近年来, 研究发现拟南芥ACS5蛋白发挥支架作用(scaffold), 连接E3连接酶SINAT (SEVEN-IN-ABSENTIA)与EOL2形成复合体, 通过促进这2个E3连接酶相互降解来维持ACS5的稳定性, 且BR信号能促进SLNAT上T147位点发生磷酸化, 从而招募14-3-3蛋白进一步促进SlNAT与EOL2的相互降解以增加ACS5蛋白的积累(Lee et al., 2021).在水稻中, 通过酵母双杂交实验可观察到14-3-3蛋白(OsGF14s)与OsACS1互作, 推测Type I和Type II家族OsACS的C端RXSX基序可能是14-3-3的直接结合位点, 暗示在水稻中14-3-3可能通过与OsACS结合阻碍ETO1对ACS靶向降解/ACS去磷酸化, 具有稳定ACS活性进而促进乙烯合成的作用(Yao et al., 2007). ... Disruption and overexpression of the gene encoding ACC (1-aminocyclopropane-1-carboxylic acid) deaminase in soil-borne fungal pathogen Verticillium dahliae revealed the role of ACC as a potential regulator of virulence and plant defense 1 2019 ... 在高等植物中, 乙烯的生物合成途径虽然较为简单, 但其调控机制极为复杂, 受到包括转录及翻译后水平多个层次的调控.虽然在拟南芥中对乙烯合成的调控机制已有广泛的研究并取得了显著进展, 但是在水稻中的研究却相对有限.ACS作为乙烯合成通路的关键限速酶, 对其在转录以及翻译后调控的研究较为深入.Ahmadizadeh等(2020)通过生物信息学分析, 发现水稻ACS蛋白存在糖基化位点, 这可能作为一种新的翻译后修饰方式, 有待进一步研究; 而绝大多数ACO蛋白无糖基化位点, 磷酸化位点也较少, 其磷酸化程度低于ACS蛋白, 因此关于ACO的翻译后修饰方式仍需进一步探索.鉴于在水稻中构建的osetol1突变体可过量积累ACC进而促进乙烯的释放, 后续可考虑以osetol1突变体为材料, 通过正向遗传学手段(如EMS诱变)筛选出乙烯合成缺失突变体, 基于其本身可稳定ACS酶活性以维持ACC含量处于较高水平, 将更容易筛选出调控ACC转化为乙烯的关键酶OsACO的关键基因.近年来, 研究发现乙烯前体物质ACC也可以作为独立于乙烯的信号分子参与调控多种生理过程.例如, 在高等植物中, ACC能够独立调控拟南芥根细胞壁代谢(Xu, 2008)、早期营养器官生长(Vanderstraeten et al., 2019)、气孔发育(Yin et al., 2019)以及胚珠对花粉管的吸引(Mou et al., 2020); 调控番茄花粉管伸长(Althiab-Almasaud et al., 2021)及抗病(Tsolakidou et al., 2019); 在低等植物中, ACC能够独立调控苔类植物Riella helicophylla的芽孢柱细胞伸长(Stange and Osborne, 1989)和水生红藻植物Pyropia yezoensis的生殖器官发育(Uji et al., 2020), 以及抑制地钱(Marchantia polymorpha)叶状体及芽孢的生长(Li et al., 2020).因此, ACS作为催化ACC合成的酶, 对其调控机制的研究不仅拓宽了对乙烯合成通路的认识, 而且能够推动ACC作为独立于乙烯的信号分子研究取得更多成果.此外, Van de Poel等(2012, 2014a, 2014b)发现在番茄特定的生长发育阶段, ACO也作为乙烯合成的关键限速酶调控乙烯合成.这说明ACO的调控机制可能比预期更复杂.目前, 我们对于水稻OsACS和OsACO调控机制的认识仍是冰山一角.鉴于乙烯对水稻生长发育及逆境响应等生理过程起重要作用, 故对这2种关键酶的调控机制进行深入研究具有重要科学意义及应用价值. ... Unique and overlapping expression patterns among the Arabidopsis 1-amino- cyclopropane-1-carboxylate synthase gene family members 1 2004 ... 在高等植物中, 乙烯的生物合成通路已得到阐明(图1).简单来说, 乙烯的生物合成始于甲硫氨酸(methionine, Met), Met在S-腺苷甲硫氨酸(S-adenosyl methionine, SAM)合成酶(SAM synthetase, SAMS)的作用下合成SAM.然后在1-甲基环丙烷-1-羧酸(1-amino- cyclopropane-1-carboxylic acid, ACC)合酶(ACC synthase, ACS)的作用下合成ACC和副产物5′-甲硫基腺苷(5′-methylthioadenosine, MTA), 这是乙烯合成的主要限速步骤, 且ACS被认为是关键限速酶(Tsuchisaka and Theologis, 2004; Lee et al., 2017).最后, ACC被ACC氧化酶(ACC oxidase, ACO)氧化, 生成乙烯、CO2和氰化物.同时, 副产物MTA通过杨氏循环(Yang cycle)重新转化为甲硫氨酸, 以确保乙烯生物合成的持续进行, 且不需要合成新的甲硫氨酸(Zhou et al., 2020; Park et al., 2021).基于水稻OsACS和OsACO与拟南芥序列的相似性及其功能验证, 可知水稻中乙烯合成途径具有一定的保守性(Zhou et al., 2020).目前在水稻中已鉴定出多个乙烯合成通路基因, 其中多数研究集中在关键酶OsACS和OsACO上. ... Sexual reproduction via a 1-aminocyclopropane-1-carboxylic acid-dependent pathway through redox modulation in the marine red alga Pyropia yezoensis (Rhodophyta) 1 2020 ... 在高等植物中, 乙烯的生物合成途径虽然较为简单, 但其调控机制极为复杂, 受到包括转录及翻译后水平多个层次的调控.虽然在拟南芥中对乙烯合成的调控机制已有广泛的研究并取得了显著进展, 但是在水稻中的研究却相对有限.ACS作为乙烯合成通路的关键限速酶, 对其在转录以及翻译后调控的研究较为深入.Ahmadizadeh等(2020)通过生物信息学分析, 发现水稻ACS蛋白存在糖基化位点, 这可能作为一种新的翻译后修饰方式, 有待进一步研究; 而绝大多数ACO蛋白无糖基化位点, 磷酸化位点也较少, 其磷酸化程度低于ACS蛋白, 因此关于ACO的翻译后修饰方式仍需进一步探索.鉴于在水稻中构建的osetol1突变体可过量积累ACC进而促进乙烯的释放, 后续可考虑以osetol1突变体为材料, 通过正向遗传学手段(如EMS诱变)筛选出乙烯合成缺失突变体, 基于其本身可稳定ACS酶活性以维持ACC含量处于较高水平, 将更容易筛选出调控ACC转化为乙烯的关键酶OsACO的关键基因.近年来, 研究发现乙烯前体物质ACC也可以作为独立于乙烯的信号分子参与调控多种生理过程.例如, 在高等植物中, ACC能够独立调控拟南芥根细胞壁代谢(Xu, 2008)、早期营养器官生长(Vanderstraeten et al., 2019)、气孔发育(Yin et al., 2019)以及胚珠对花粉管的吸引(Mou et al., 2020); 调控番茄花粉管伸长(Althiab-Almasaud et al., 2021)及抗病(Tsolakidou et al., 2019); 在低等植物中, ACC能够独立调控苔类植物Riella helicophylla的芽孢柱细胞伸长(Stange and Osborne, 1989)和水生红藻植物Pyropia yezoensis的生殖器官发育(Uji et al., 2020), 以及抑制地钱(Marchantia polymorpha)叶状体及芽孢的生长(Li et al., 2020).因此, ACS作为催化ACC合成的酶, 对其调控机制的研究不仅拓宽了对乙烯合成通路的认识, 而且能够推动ACC作为独立于乙烯的信号分子研究取得更多成果.此外, Van de Poel等(2012, 2014a, 2014b)发现在番茄特定的生长发育阶段, ACO也作为乙烯合成的关键限速酶调控乙烯合成.这说明ACO的调控机制可能比预期更复杂.目前, 我们对于水稻OsACS和OsACO调控机制的认识仍是冰山一角.鉴于乙烯对水稻生长发育及逆境响应等生理过程起重要作用, 故对这2种关键酶的调控机制进行深入研究具有重要科学意义及应用价值. ... A transcriptomics-based kinetic model for ethylene biosynthesis in tomato (Solanum lycopersicum) fruit: development, validation and exploration of novel regulatory mechanisms 1 2014a ... 在高等植物中, 乙烯的生物合成途径虽然较为简单, 但其调控机制极为复杂, 受到包括转录及翻译后水平多个层次的调控.虽然在拟南芥中对乙烯合成的调控机制已有广泛的研究并取得了显著进展, 但是在水稻中的研究却相对有限.ACS作为乙烯合成通路的关键限速酶, 对其在转录以及翻译后调控的研究较为深入.Ahmadizadeh等(2020)通过生物信息学分析, 发现水稻ACS蛋白存在糖基化位点, 这可能作为一种新的翻译后修饰方式, 有待进一步研究; 而绝大多数ACO蛋白无糖基化位点, 磷酸化位点也较少, 其磷酸化程度低于ACS蛋白, 因此关于ACO的翻译后修饰方式仍需进一步探索.鉴于在水稻中构建的osetol1突变体可过量积累ACC进而促进乙烯的释放, 后续可考虑以osetol1突变体为材料, 通过正向遗传学手段(如EMS诱变)筛选出乙烯合成缺失突变体, 基于其本身可稳定ACS酶活性以维持ACC含量处于较高水平, 将更容易筛选出调控ACC转化为乙烯的关键酶OsACO的关键基因.近年来, 研究发现乙烯前体物质ACC也可以作为独立于乙烯的信号分子参与调控多种生理过程.例如, 在高等植物中, ACC能够独立调控拟南芥根细胞壁代谢(Xu, 2008)、早期营养器官生长(Vanderstraeten et al., 2019)、气孔发育(Yin et al., 2019)以及胚珠对花粉管的吸引(Mou et al., 2020); 调控番茄花粉管伸长(Althiab-Almasaud et al., 2021)及抗病(Tsolakidou et al., 2019); 在低等植物中, ACC能够独立调控苔类植物Riella helicophylla的芽孢柱细胞伸长(Stange and Osborne, 1989)和水生红藻植物Pyropia yezoensis的生殖器官发育(Uji et al., 2020), 以及抑制地钱(Marchantia polymorpha)叶状体及芽孢的生长(Li et al., 2020).因此, ACS作为催化ACC合成的酶, 对其调控机制的研究不仅拓宽了对乙烯合成通路的认识, 而且能够推动ACC作为独立于乙烯的信号分子研究取得更多成果.此外, Van de Poel等(2012, 2014a, 2014b)发现在番茄特定的生长发育阶段, ACO也作为乙烯合成的关键限速酶调控乙烯合成.这说明ACO的调控机制可能比预期更复杂.目前, 我们对于水稻OsACS和OsACO调控机制的认识仍是冰山一角.鉴于乙烯对水稻生长发育及逆境响应等生理过程起重要作用, 故对这2种关键酶的调控机制进行深入研究具有重要科学意义及应用价值. ... Targeted systems biology profiling of tomato fruit reveals coordination of the Yang cycle and a distinct regulation of ethylene biosynthesis during postclimacteric ripening 1 2012 ... 在高等植物中, 乙烯的生物合成途径虽然较为简单, 但其调控机制极为复杂, 受到包括转录及翻译后水平多个层次的调控.虽然在拟南芥中对乙烯合成的调控机制已有广泛的研究并取得了显著进展, 但是在水稻中的研究却相对有限.ACS作为乙烯合成通路的关键限速酶, 对其在转录以及翻译后调控的研究较为深入.Ahmadizadeh等(2020)通过生物信息学分析, 发现水稻ACS蛋白存在糖基化位点, 这可能作为一种新的翻译后修饰方式, 有待进一步研究; 而绝大多数ACO蛋白无糖基化位点, 磷酸化位点也较少, 其磷酸化程度低于ACS蛋白, 因此关于ACO的翻译后修饰方式仍需进一步探索.鉴于在水稻中构建的osetol1突变体可过量积累ACC进而促进乙烯的释放, 后续可考虑以osetol1突变体为材料, 通过正向遗传学手段(如EMS诱变)筛选出乙烯合成缺失突变体, 基于其本身可稳定ACS酶活性以维持ACC含量处于较高水平, 将更容易筛选出调控ACC转化为乙烯的关键酶OsACO的关键基因.近年来, 研究发现乙烯前体物质ACC也可以作为独立于乙烯的信号分子参与调控多种生理过程.例如, 在高等植物中, ACC能够独立调控拟南芥根细胞壁代谢(Xu, 2008)、早期营养器官生长(Vanderstraeten et al., 2019)、气孔发育(Yin et al., 2019)以及胚珠对花粉管的吸引(Mou et al., 2020); 调控番茄花粉管伸长(Althiab-Almasaud et al., 2021)及抗病(Tsolakidou et al., 2019); 在低等植物中, ACC能够独立调控苔类植物Riella helicophylla的芽孢柱细胞伸长(Stange and Osborne, 1989)和水生红藻植物Pyropia yezoensis的生殖器官发育(Uji et al., 2020), 以及抑制地钱(Marchantia polymorpha)叶状体及芽孢的生长(Li et al., 2020).因此, ACS作为催化ACC合成的酶, 对其调控机制的研究不仅拓宽了对乙烯合成通路的认识, 而且能够推动ACC作为独立于乙烯的信号分子研究取得更多成果.此外, Van de Poel等(2012, 2014a, 2014b)发现在番茄特定的生长发育阶段, ACO也作为乙烯合成的关键限速酶调控乙烯合成.这说明ACO的调控机制可能比预期更复杂.目前, 我们对于水稻OsACS和OsACO调控机制的认识仍是冰山一角.鉴于乙烯对水稻生长发育及逆境响应等生理过程起重要作用, 故对这2种关键酶的调控机制进行深入研究具有重要科学意义及应用价值. ... Tissue specific analysis reveals a differential organization and regulation of both ethylene biosynthesis and E8 during climacteric ripening of tomato 1 2014b ... 在高等植物中, 乙烯的生物合成途径虽然较为简单, 但其调控机制极为复杂, 受到包括转录及翻译后水平多个层次的调控.虽然在拟南芥中对乙烯合成的调控机制已有广泛的研究并取得了显著进展, 但是在水稻中的研究却相对有限.ACS作为乙烯合成通路的关键限速酶, 对其在转录以及翻译后调控的研究较为深入.Ahmadizadeh等(2020)通过生物信息学分析, 发现水稻ACS蛋白存在糖基化位点, 这可能作为一种新的翻译后修饰方式, 有待进一步研究; 而绝大多数ACO蛋白无糖基化位点, 磷酸化位点也较少, 其磷酸化程度低于ACS蛋白, 因此关于ACO的翻译后修饰方式仍需进一步探索.鉴于在水稻中构建的osetol1突变体可过量积累ACC进而促进乙烯的释放, 后续可考虑以osetol1突变体为材料, 通过正向遗传学手段(如EMS诱变)筛选出乙烯合成缺失突变体, 基于其本身可稳定ACS酶活性以维持ACC含量处于较高水平, 将更容易筛选出调控ACC转化为乙烯的关键酶OsACO的关键基因.近年来, 研究发现乙烯前体物质ACC也可以作为独立于乙烯的信号分子参与调控多种生理过程.例如, 在高等植物中, ACC能够独立调控拟南芥根细胞壁代谢(Xu, 2008)、早期营养器官生长(Vanderstraeten et al., 2019)、气孔发育(Yin et al., 2019)以及胚珠对花粉管的吸引(Mou et al., 2020); 调控番茄花粉管伸长(Althiab-Almasaud et al., 2021)及抗病(Tsolakidou et al., 2019); 在低等植物中, ACC能够独立调控苔类植物Riella helicophylla的芽孢柱细胞伸长(Stange and Osborne, 1989)和水生红藻植物Pyropia yezoensis的生殖器官发育(Uji et al., 2020), 以及抑制地钱(Marchantia polymorpha)叶状体及芽孢的生长(Li et al., 2020).因此, ACS作为催化ACC合成的酶, 对其调控机制的研究不仅拓宽了对乙烯合成通路的认识, 而且能够推动ACC作为独立于乙烯的信号分子研究取得更多成果.此外, Van de Poel等(2012, 2014a, 2014b)发现在番茄特定的生长发育阶段, ACO也作为乙烯合成的关键限速酶调控乙烯合成.这说明ACO的调控机制可能比预期更复杂.目前, 我们对于水稻OsACS和OsACO调控机制的认识仍是冰山一角.鉴于乙烯对水稻生长发育及逆境响应等生理过程起重要作用, 故对这2种关键酶的调控机制进行深入研究具有重要科学意义及应用价值. ... The ethylene precursor ACC affects early vegetative development independently of ethylene signaling 1 2019 ... 在高等植物中, 乙烯的生物合成途径虽然较为简单, 但其调控机制极为复杂, 受到包括转录及翻译后水平多个层次的调控.虽然在拟南芥中对乙烯合成的调控机制已有广泛的研究并取得了显著进展, 但是在水稻中的研究却相对有限.ACS作为乙烯合成通路的关键限速酶, 对其在转录以及翻译后调控的研究较为深入.Ahmadizadeh等(2020)通过生物信息学分析, 发现水稻ACS蛋白存在糖基化位点, 这可能作为一种新的翻译后修饰方式, 有待进一步研究; 而绝大多数ACO蛋白无糖基化位点, 磷酸化位点也较少, 其磷酸化程度低于ACS蛋白, 因此关于ACO的翻译后修饰方式仍需进一步探索.鉴于在水稻中构建的osetol1突变体可过量积累ACC进而促进乙烯的释放, 后续可考虑以osetol1突变体为材料, 通过正向遗传学手段(如EMS诱变)筛选出乙烯合成缺失突变体, 基于其本身可稳定ACS酶活性以维持ACC含量处于较高水平, 将更容易筛选出调控ACC转化为乙烯的关键酶OsACO的关键基因.近年来, 研究发现乙烯前体物质ACC也可以作为独立于乙烯的信号分子参与调控多种生理过程.例如, 在高等植物中, ACC能够独立调控拟南芥根细胞壁代谢(Xu, 2008)、早期营养器官生长(Vanderstraeten et al., 2019)、气孔发育(Yin et al., 2019)以及胚珠对花粉管的吸引(Mou et al., 2020); 调控番茄花粉管伸长(Althiab-Almasaud et al., 2021)及抗病(Tsolakidou et al., 2019); 在低等植物中, ACC能够独立调控苔类植物Riella helicophylla的芽孢柱细胞伸长(Stange and Osborne, 1989)和水生红藻植物Pyropia yezoensis的生殖器官发育(Uji et al., 2020), 以及抑制地钱(Marchantia polymorpha)叶状体及芽孢的生长(Li et al., 2020).因此, ACS作为催化ACC合成的酶, 对其调控机制的研究不仅拓宽了对乙烯合成通路的认识, 而且能够推动ACC作为独立于乙烯的信号分子研究取得更多成果.此外, Van de Poel等(2012, 2014a, 2014b)发现在番茄特定的生长发育阶段, ACO也作为乙烯合成的关键限速酶调控乙烯合成.这说明ACO的调控机制可能比预期更复杂.目前, 我们对于水稻OsACS和OsACO调控机制的认识仍是冰山一角.鉴于乙烯对水稻生长发育及逆境响应等生理过程起重要作用, 故对这2种关键酶的调控机制进行深入研究具有重要科学意义及应用价值. ... Regulation of ethylene gas biosynthesis by the Arabidopsis ETO1 protein 2 2004 ... ACS是一种磷酸吡哆醛(pyrodoxal-5′-phosphate, PLP)依赖酶, 由于其是催化乙烯生物合成过程中的关键限速酶, 因此大多数关于乙烯合成调控的研究都集中在该酶上(Argueso et al., 2007).在拟南芥中, 根据蛋白质C端调控序列的特征, 可将ACS家族分为3种不同的亚型, 即Type I、Type II和Type III (Pattyn et al., 2021).每种亚型的ACS蛋白由较短的N端、保守的催化结构域及含有调控序列的C端组成(Yoon, 2015).Type I型ACS蛋白具有最长的C端结构域, 包含1个钙依赖蛋白激酶(calcium-dependent protein kinase, CDPK)磷酸化位点和3个丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)磷酸化位点.Type II型ACS蛋白的C端有1个CDPK磷酸化位点和1个TOE (Target of ETO1)位点.其中, TOE是E3连接酶ETO1 (ETHYLENE OVERPRODUCER 1)及其2个同源物(EOL1和EOL2)的结合位点(Wang et al., 2004).ETO1及EOL1/2通过TOE结构与Type II型AtACS蛋白特异性互作, 导致其被26S蛋白酶体降解(Yoshida et al., 2005; Christians et al., 2009).相反, Type III型蛋白的N端能够被环型E3连接酶XBAT32泛素化, 随后被26S蛋白酶体降解, 其C端的调控机制尚未见报道(Lyzenga et al., 2012).水稻OsACS是多基因家族(Booker and DeLong, 2015), 目前在水稻基因组中共发现了6个OsACS基因(Iwai et al., 2006), 包括OsACS1 (Os03g0727600)、OsACS2 (Os04g0578000)、OsACS3 (Os05g0196600)、OsACS4 (Os05g0319200)、OsACS5 (Os01g0192900)和OsACS6 (Os06g0130400).进化分析显示, OsACS6与拟南芥(Arabidopsis thaliana) AtACS10和AtACS12的序列相似度很高, 推测其可能具有氨基转移酶活性, 而不具有ACC合酶活性, 其余5个OsACSs均具有ACS活性(Matsushima et al., 2016).通过构建拟南芥、大麦(Hordeum vulgare)、番茄(Solanum lycopersicum)与水稻ACS蛋白的系统发生树, 对比拟南芥与水稻ACS蛋白结构域, 可将水稻OsACS家族分为3种亚型, 即Type I-III (图2, 图3).OsACS2与拟南芥Type I型AtACS的蛋白结构相似, 在所有OsACSs中具有最长的C端结构域.OsACS1与拟南芥Type II型ACS的结构相关性较高, 虽然其TOE序列与拟南芥及番茄典型的Type II型ACS上的TOE序列有所不同(图4), 但Yoshida等(2006)将OsACS1的C端16个氨基酸残基(包含TOE序列)与GFP进行融合, 构成GFP-TOEOsACS1转入水稻愈伤组织, 发现其GFP荧光强度比对照(GFP空载)显著减弱, 表明TOEOsACS1能够被水稻内源OsEOLs靶向降解, 推测OsACS1的TOE序列与拟南芥及番茄的Type II型ACS的TOE序列具有功能保守性.此外, OsACS3、OsACS4和OsACS5与拟南芥Type III型ACS蛋白相似, 其C端较短, 目前还未在其C端发现已知的调控结构域(Lee and Yoon, 2018). ...
本文的其它图/表
|

