

植物学报 ›› 2018, Vol. 53 ›› Issue (4): 509-518.DOI: 10.11983/CBB17115 cstr: 32102.14.CBB17115
陈柯伊, 李朝娜, 成敏敏, 赵扬辉, 周明兵, 杨海芸*( )
)
收稿日期:2017-06-10
接受日期:2017-10-07
出版日期:2018-07-01
发布日期:2018-09-11
通讯作者:
杨海芸
作者简介:† 共同第一作者。
基金资助:
Chen Keyi, Li Zhaona, Cheng Minmin, Zhao Yanghui, Zhou Mingbing, Yang Haiyun*( )
)
Received:2017-06-10
Accepted:2017-10-07
Online:2018-07-01
Published:2018-09-11
Contact:
Yang Haiyun
About author:† These authors contributed equally to this paper
摘要: 以矢竹(Pseudosasa japonica)、花叶矢竹(P. japonica f. akebonosuji)和曙筋矢竹(P. japonica f. akebono)为研究对象, 借助叶绿体超微结构和荧光动力学曲线的变化揭示不同叶色矢竹的光系统活性及光合特性差异。结果表明: 3个竹种的光合色素含量差异明显, 除花叶矢竹条纹叶白色部分叶绿体内无完整类囊体片层结构外, 花叶矢竹绿条纹和曙筋矢竹的基粒数明显少于矢竹, 叶绿体发育成熟度不一致; OJIP曲线及参数表明, 花叶矢竹条纹绿叶和曙筋矢竹光系统II (PSII)反应中心开放降低程度低于矢竹, 捕获能量用于电子传递的份额变小, PSII活性变弱; 而曙筋矢竹叶片P700至初级电子受体(QA)的电子传递链氧化还原平衡偏向于还原侧, 推测其光系统I (PSI)反应中心P700至PSII QA电子传递链受损。因此, PSII活性变化导致叶绿体发育不成熟, 可能是引起矢竹类叶色差异的直接原因。
陈柯伊, 李朝娜, 成敏敏, 赵扬辉, 周明兵, 杨海芸. 不同叶色矢竹叶绿体结构和光系统特性差异. 植物学报, 2018, 53(4): 509-518.
Chen Keyi, Li Zhaona, Cheng Minmin, Zhao Yanghui, Zhou Mingbing, Yang Haiyun. Chloroplast Ultrastructure and Chlorophyll Fluorescence Characteristics of Three Cultivars of Pseudosasa japonica. Chinese Bulletin of Botany, 2018, 53(4): 509-518.
| Photosynthetic pigments | GL | SA | SG | VL |
|---|---|---|---|---|
| Chla (mg·g-1 FW) | 27.19±1.17 a | 0.34±0.17 c | 25.39±2.41 a | 17.09±0.52 b |
| Chlb (mg·g-1 FW) | 8.66±0.33 a | 0.16±0.07 c | 8.27±0.69 a | 5.70±0.17 b |
| Car (mg·g-1 FW) | 4.89±0.28 a | 0.32±0.08 c | 5.52±0.55 a | 4.07±0.13 b |
| Chla/b | 3.14±0.02 a | 1.99±0.09 b | 3.07±0.03 a | 3.00±0.00 a |
| Chla+b (mg·g-1 FW) | 35.86±1.51 a | 0.51±0.25 c | 33.66±3.11 a | 22.79±0.70 b |
表1 不同种类矢竹叶片光合色素含量及比值(平均值±标准误)
Table 1 Photosynthetic pigments content and relative ratio of different cultivars of Pseudosasa japonica leaves (means±SE)
| Photosynthetic pigments | GL | SA | SG | VL |
|---|---|---|---|---|
| Chla (mg·g-1 FW) | 27.19±1.17 a | 0.34±0.17 c | 25.39±2.41 a | 17.09±0.52 b |
| Chlb (mg·g-1 FW) | 8.66±0.33 a | 0.16±0.07 c | 8.27±0.69 a | 5.70±0.17 b |
| Car (mg·g-1 FW) | 4.89±0.28 a | 0.32±0.08 c | 5.52±0.55 a | 4.07±0.13 b |
| Chla/b | 3.14±0.02 a | 1.99±0.09 b | 3.07±0.03 a | 3.00±0.00 a |
| Chla+b (mg·g-1 FW) | 35.86±1.51 a | 0.51±0.25 c | 33.66±3.11 a | 22.79±0.70 b |

图1 矢竹类3个叶色叶片表型SG+SA: 花叶矢竹条纹叶片绿色部分及白色部分; VL: 曙筋矢竹淡绿色叶片; GL: 矢竹深绿色叶片
Figure 1 Three kinds of Pseudosasa japonica leavesSA+SG: Albino and green sector in leaf of P. japonica f. akebonosuji with strips; VL: Virescent leaf of P. japonica f. akebono. GL: Green leaf of P. japonica
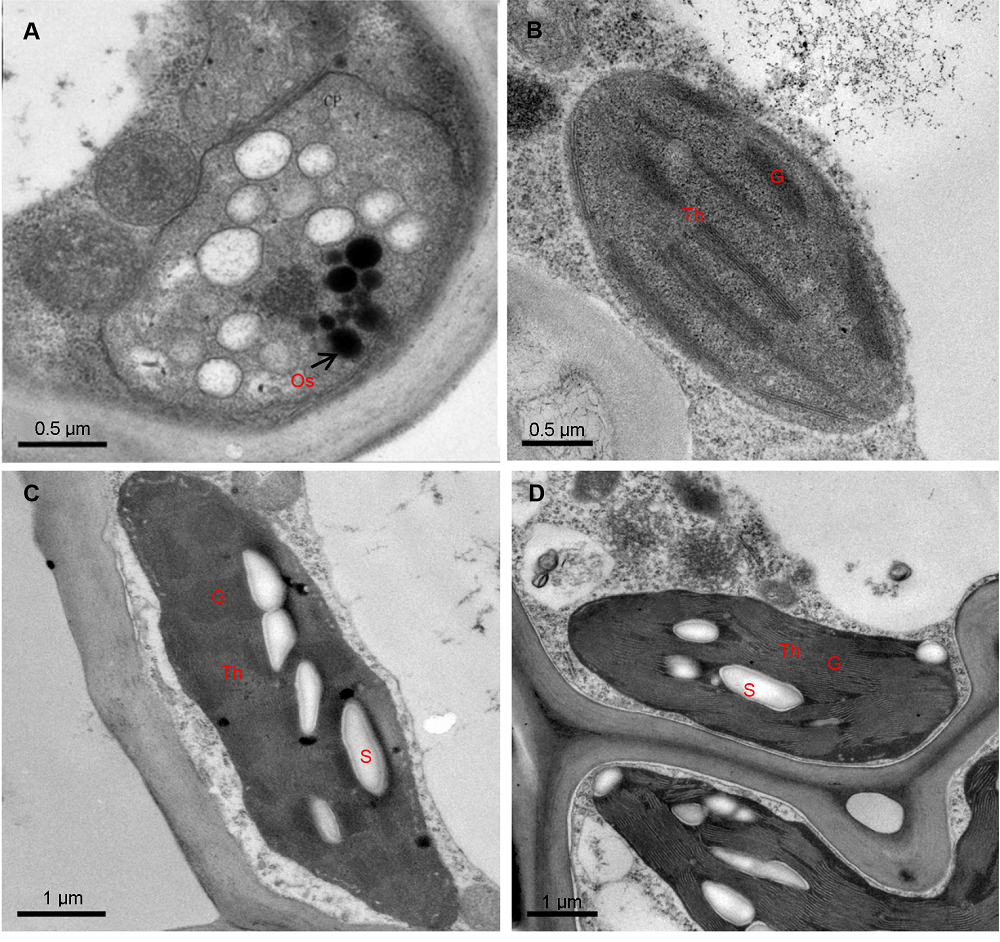
图2 3个竹种叶片叶绿体结构(A) 花叶矢竹白区叶肉细胞; (B) 花叶矢竹绿区叶肉细胞; (C) 曙筋矢竹叶肉细胞; (D) 矢竹叶肉细胞。G: 基粒; Os: 嗜锇小体; S: 淀粉粒; Th: 类囊体膜
Figure 2 Plate chloroplast ultrastructure of three cultivars of Pseudosasa japonica leaves(A) Mesophyll cells in white zones of zebra leaf of P. japonica f. akebonosuji; (B) Mesophyll cells in green zones of P. japonica f. akebonosuji; (C) Mesophyll cells in the leaf of P. japonica f. akebono; (D) Mesophyll cells in the leaf of P. japonica. G: Granum; Os: Osmiophile globule; S: Starch grain; Th: Thylakoid membranes
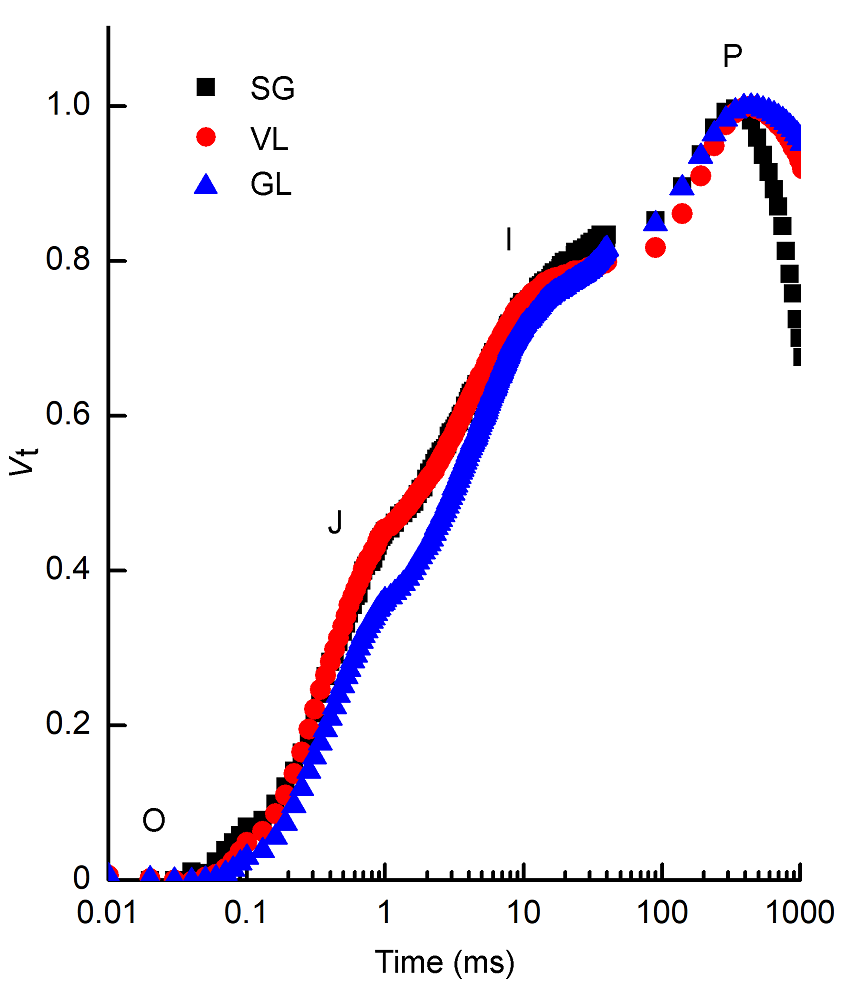
图3 不同种类矢竹叶片相对可变荧光强度(Vt)随时间的变化SG、VL和GL同表1。
Figure 3 Relative variable fluorescence (Vt) with the time change of different cultivars of Pseudosasa japonica leavesSG, VL and GL see Table 1.
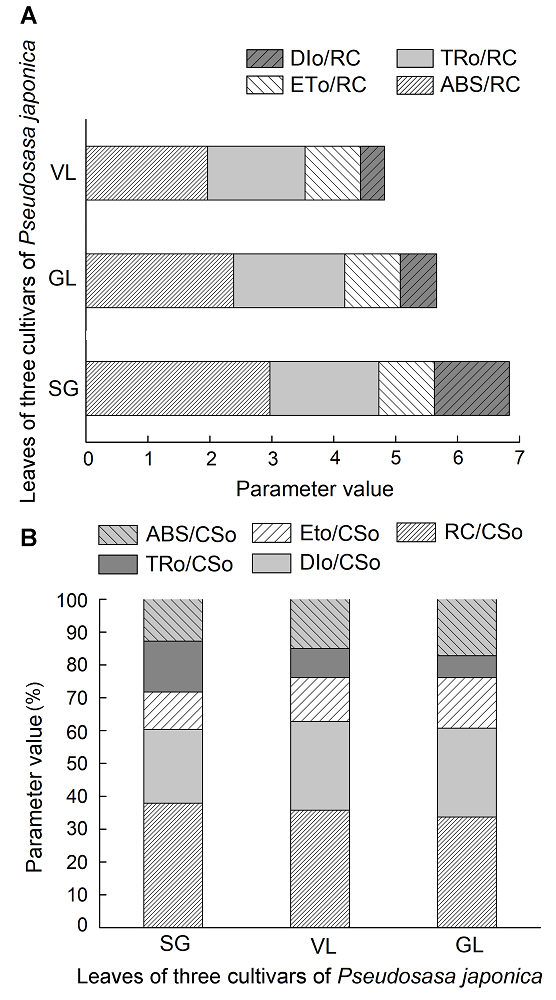
图4 不同种类矢竹叶片比活性参数VL、GL和SG同表1。ABS/RC: 单位反应中心吸收的光能; TRo/ RC: PSII的最大捕获量; ETo/RC: 单位反应中心用于电子传递的能量; DIo/RC: 单位反应中心的热耗散; ABS/CSo: 单位面积吸收的光能; TRo/CSo: 单位面积捕获的光能; ETo/CSo: 单位面积的电子传递量子产额; DIo/CSo: 单位面积的热耗散; RC/CSo: 单位面积反应中心的数量
Figure 4 Activity parameters for unit reaction center of different cultivars of Pseudosasa japonica leavesVL, GL and SG see Table 1. ABS/RC: The amount of light absorbed by the unit reaction center; TRo/RC: The large amount of PSII; ETo/RC: The energy of the unit reaction center for electron transfer; DIo/RC: The heat dissipation of the unit reaction center; ABS/CSo: Absorption flux per unit area; TRo/CSo: Trapped energy flux per unit area; ETo/CSo: Electron transport flux per unit area; DIo/CSo: Dissipated energy flux perunit area; RC/CSo: Number of active reaction centers per unit area
| GL | VL | SG | |
|---|---|---|---|
| F0 | 0.40±0.01 b | 0.44±0.03 a | 0.39±0.04 ab |
| Fm | 1.64±0.13 a | 1.35±0.16 a | 1.29±0.17 a |
| Fv/Fm | 0.75±0.02 a | 0.67±0.02 b | 0.63±0.01 b |
| Fv/F0 | 3.11±0.36 a | 2.01±0.19 b | 2.26±0.14 b |
| Y(II) | 0.38±0.04 b | 0.27±0.03 a | 0.31±0.04 a |
| NPQ | 1.27±0.12 b | 1.71±0.21 a | 1.47±0.18 ab |
| qP | 0.77±0.05 a | 0.77±0.03 a | 0.79±0.04 a |
| ETR | 23.00±2.94 a | 16.22±1.64 a | 19.00±2.83 a |
表2 不同种类矢竹叶片荧光参数分析
Table 2 Analysis of fluorescence parameters of different cultivars of Pseudosasa japonica leaves
| GL | VL | SG | |
|---|---|---|---|
| F0 | 0.40±0.01 b | 0.44±0.03 a | 0.39±0.04 ab |
| Fm | 1.64±0.13 a | 1.35±0.16 a | 1.29±0.17 a |
| Fv/Fm | 0.75±0.02 a | 0.67±0.02 b | 0.63±0.01 b |
| Fv/F0 | 3.11±0.36 a | 2.01±0.19 b | 2.26±0.14 b |
| Y(II) | 0.38±0.04 b | 0.27±0.03 a | 0.31±0.04 a |
| NPQ | 1.27±0.12 b | 1.71±0.21 a | 1.47±0.18 ab |
| qP | 0.77±0.05 a | 0.77±0.03 a | 0.79±0.04 a |
| ETR | 23.00±2.94 a | 16.22±1.64 a | 19.00±2.83 a |
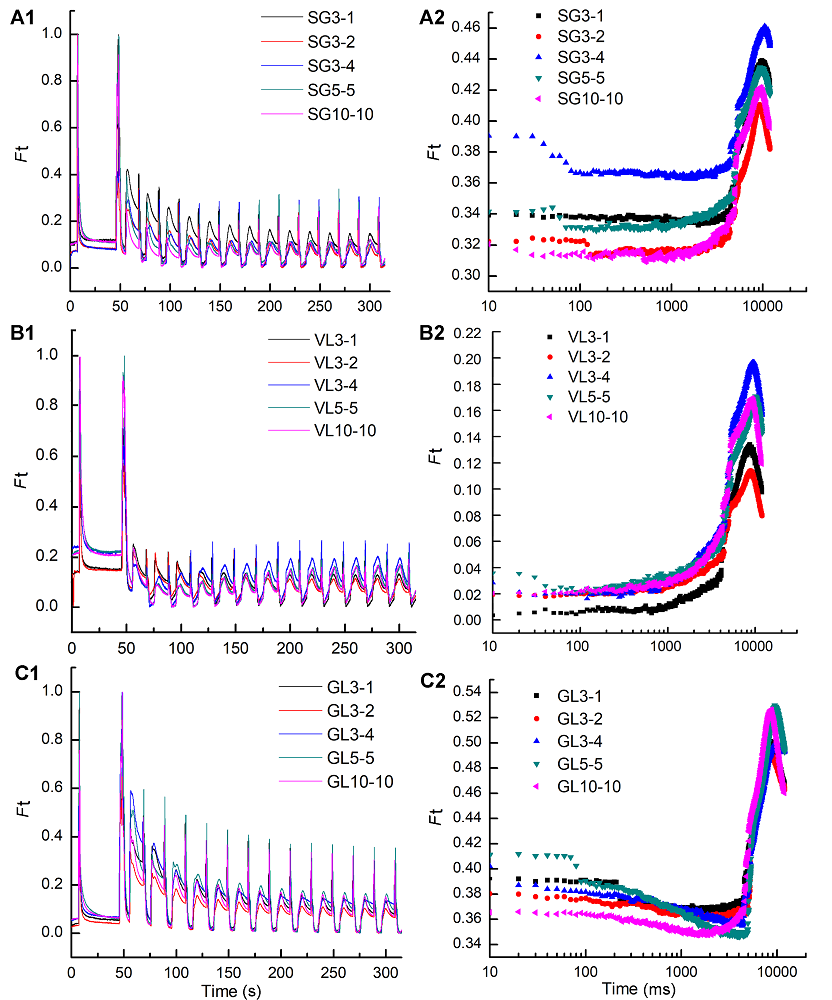
图5 3个竹种在不同远红光强度及时间下荧光动力学曲线变化(A1), (A2) 不同远红光强度及时间下花叶矢竹条纹叶片绿色部分荧光动力学曲线(A1)和稳态荧光(A2); (B1), (B2) 不同远红光强度及时间下曙筋矢竹淡绿色叶片荧光动力学曲线(B1)和稳态荧光(B2); (C1), (C2) 不同远红光强度及时间下矢竹深绿色叶片荧光动力学曲线(C1)和稳态荧光(C2)。SG、VL和GL同表1; Ft: 实时荧光曲线。
Figure 5 The change of fluorescence transients under different intensity and time of three cultivars of Pseudosasa japonica leaves under far-red light treatments(A1), (A2) The change of fluorescence transients (A1) and steady-state fluorescence (A2) of green sector in leaf with strips of P. japonica f. akebonosuji under different intensity and time of far-red light treatments; (B1), (B2) The change of fluorescence transients (B1) and steady-state fluorescence (B2) of the virescent leaves of P. japonica f. akebono under different intensity and time of far-red light treatments; (C1), (C2) The change of fluorescence transients (C1) and steady-state fluorescence (C2) of the green leaves of P. japonica under different intensity and time of far-red light treatments. SG, VL and GL see Table 1; Ft: Real-time fluorescence curve.
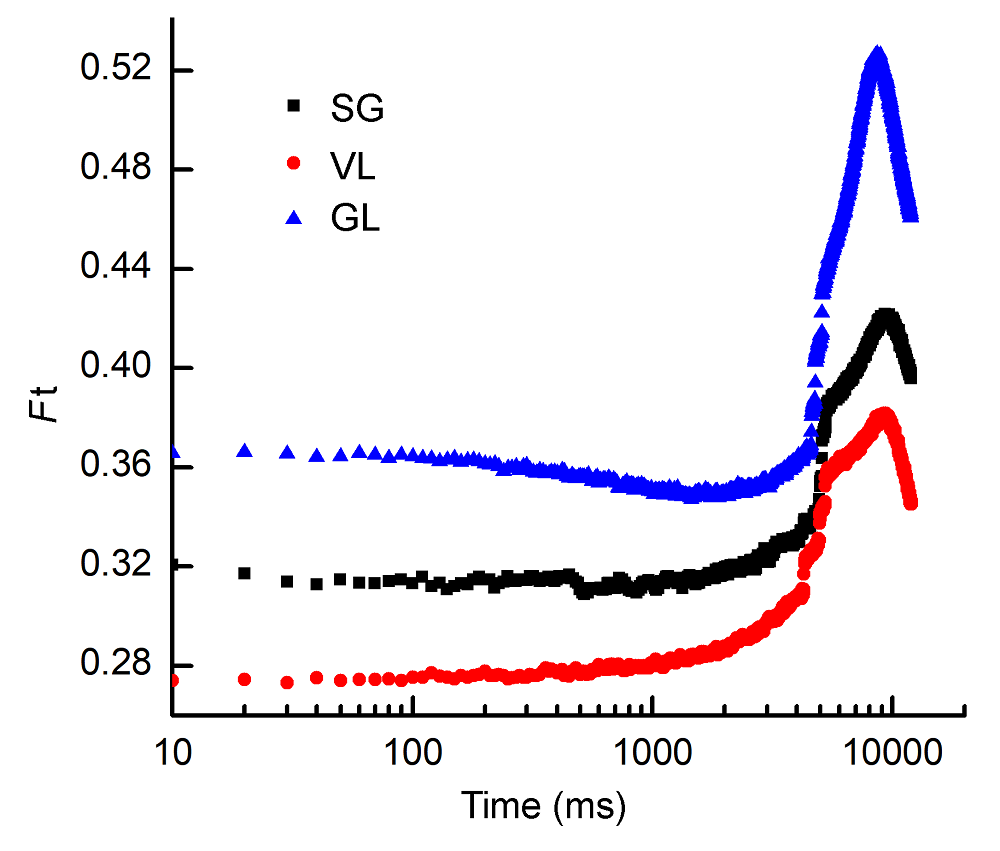
图6 3个竹种在远红光10-10 (强度-时间)组合下稳态荧光动力学曲线变化SG、VL和GL同表1; Ft同图5。
Figure 6 The change of steady-state fluorescence of 10-10 (intensity-time) of three cultivars of Pseudosasa japonica leaves under far-red light treatmentsSG, VL and GL see Table 1; Ft see Figure 5.
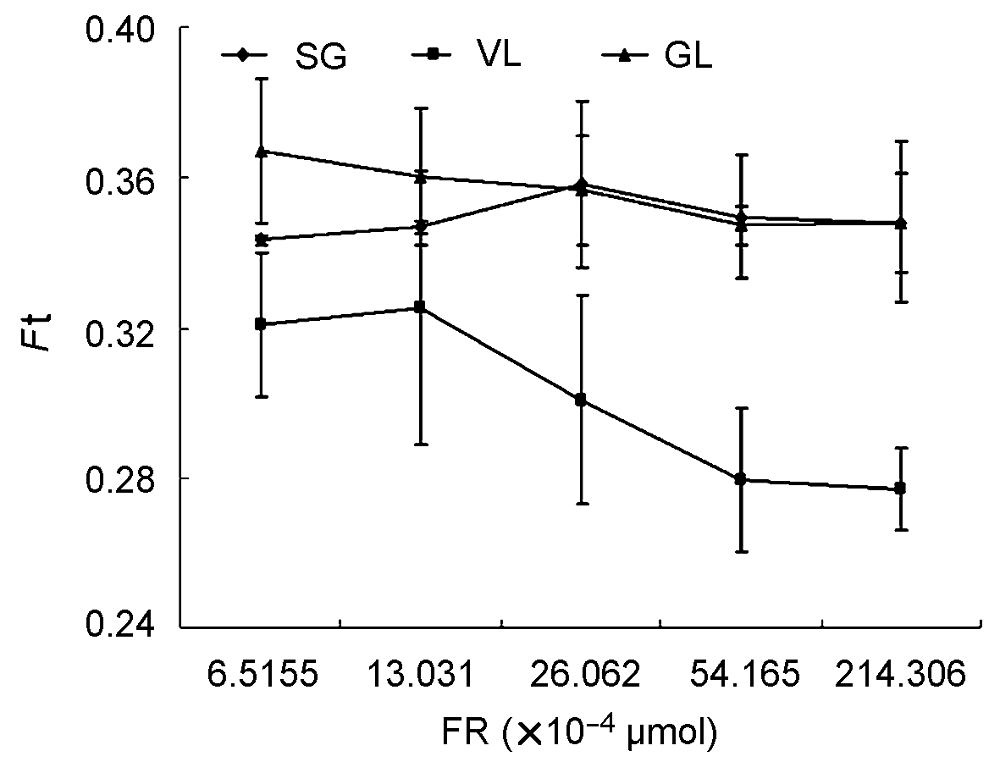
图7 不同远红光强度对3个竹种F0′ (光下最小荧光)的影响SG、VL和GL同表1; Ft同图5; FR: 远红光强度。
Figure 7 The change of F0′ (minimum fluorescence under the light) of three cultivars of Pseudosasa japonica leaves under different intensity of far-red light treatmentsSG, VL and GL see Table 1; Ft see Figure 5; FR: The intensity of far red light.
| 1 | 耿东梅, 单立山, 李毅, Жигунов Анатолий Васильевич (2014). 土壤水分胁迫对红砂幼苗叶绿素荧光和抗氧化酶活性的影响. 植物学报 49, 282-291. |
| 2 | 桂仁意, 刘亚迪, 郭小勤, 季海宝, 贾月, 余明增, 方伟 (2010). 不同剂量137Cs-γ辐射对毛竹幼苗叶片叶绿素荧光参数的影响. 植物学报 45, 66-72. |
| 3 | 何冰, 刘玲珑, 张文伟, 万建民 (2006). 植物叶色突变体. 植物生理学通讯 1, 1-9. |
| 4 | 李鹏民 (2006). 快速叶绿素荧光诱导动力学在植物逆境生理研究中的应用. 博士论文. 泰安: 山东农业大学. pp. 66-73. |
| 5 | 林世青, 许春辉, 张其德, 徐黎, 毛大璋, 匡廷云 (1992). 叶绿素荧光动力学在植物抗性生理学、生态学和农业现代化中的应用. 植物学通报 9, 1-16. |
| 6 | 欧明明, 蔡伟民 (2005). 铁限制对铜绿微囊藻光系统活性变化的影响. 环境化学 24(6), 22-24. |
| 7 | 孙鲁龙, 耿庆伟, 邢浩, 杜远鹏, 翟衡 (2017). 低温处理葡萄根系对叶片PSII活性的影响. 植物学报 52, 159-166. |
| 8 | 唐茜, 施嘉璠 (1997). 川西茶区主栽品种光合强度与叶片结构相关关系的研究. 四川农业大学学报 15(2), 193-198. |
| 9 | 许大全 (2001). 光合作用效率. 上海: 上海科学技术出版社. pp. 136-150. |
| 10 | 杨莉, 郭蔼光, 关旭 (2003). 小麦突变体返白系返白阶段叶绿体超微结构变化研究. 西北农业学报 12(4), 64-67. |
| 11 | 张阿宏, 齐孟文, 张晔晖 (2008). 调制叶绿素荧光动力学参数及其计量关系的意义和公理化讨论. 核农学报 22, 909-912. |
| 12 | 张宪政 (1986). 植物叶绿素含量测定——丙酮乙醇混合液法. 辽宁农业科学 3, 26-28. |
| 13 | 赵云, 王茂林, 李江, 张义正 (2003). 幼叶黄化油菜(Brassica napus L.)突变体Cr3529叶绿体超微结构观察. 四川大学学报(自然科学版) 5, 974-977. |
| 14 | 郑彩霞, 高荣孚 (1999). 光系统I的异质性及其在类囊体膜上分布的研究进展. 北京林业大学学报 21(5), 79-87. |
| 15 | 钟传飞 (2008). 稳态叶绿素荧光动力学理论构建和常绿阔叶植物越冬光合生理生态研究. 博士论文. 北京: 北京林业大学. pp. 47-49. |
| 16 | Deell JR, Murr DP, Wiley L (2003). 1-Methylcyclopropene (1-MCP) increases CO2 injury in apples.Acta Horticul 600, 277-280. |
| 17 | Gilmore AM, Hazlett TL, Govindjee (1997). Xanthophyll cycle-dependent quenching of photosystem II chlorophyll a fluorescence: formation of a quenching complex with a short fluorescence life time.Proc Natl Acad Sci USA 92, 2273-2277. |
| 18 | Heerden PDRV, Strasser RJ, Krüger GHJ (2010). Reduction of dark chilling stress in N2-fixing soybean by nitrate as indicated by chlorophyll a fluorescence kinetics. Physiol Plantarum 121, 239-249. |
| 19 | Lichtenthaler HK (1987). Chlorophylls and carotenoids: pigments of photosynthetic biomembranes.Methods Enzymol 148, 350-382. |
| 20 | Murchie EH, Lawson T (2013). Chlorophyll fluorescence analysis: a guide to good practice and understanding so- me new applications.J Exp Bot 64, 3983-3998. |
| 21 | Papageorgiou GC, Tsimillimichael M, Stamatakis K (2007). The fast and slow kinetics of chlorophyll a fluorescence induction in plants, algae and cyanobacteria: a viewpoint.Photosynth Res 94, 275-290. |
| 22 | Schreiber U (2004). Pulse-amplitude-modulation (PAM) fluo- rometry and saturation pulse method: an overview. In: Papageorgiou GC, Govindjee, eds. Chlorophyll a Fluorescence. Heidelberg: Springer. pp. 279-319. |
| 23 | Strasser RJ, Tsimilli-michael M, Srivastava A (2004). Analysis of the chlorophyll a fluorescence transient. In: Papageorgiou GC, Govindjee, eds. Chlorophyll a Fluorescence: A Signature of Photosynthesis. Dordrecht: Springer. pp. 321-362. |
| 24 | Tsimilli-Michael M, Strasser RJ (2008). In vivo assessment of stress impact on Plant’s Vitality: Applications in Detecting and Evaluating the Beneficial Role of Mycorrhization on Host Plants. In: Varma A, eds. Heidelberg: Springer. pp. 679-703. |
| 25 | Wang Q, Sullivan RW, Kight A, Henry RL, Huang JR, Jones AM, Korth KL (2004). Deletion of the chloroplast- localized Thylakoid formation1 gene product in Arabidopsis leads to deficient thylakoid formation and variegated leaves. Plant Physiol 136, 3594-3604. |
| 26 | Waters MT, Langdale JA (2009). The making of a chloroplast.EMBO J 28, 2861-2873. |
| 27 | Wu JX, Zhang ZG, Zhang Q, Han X, Gu XF, Lu TG (2015). The molecular cloning and clarification of a photorespiratory mutant, oscdm1, using enhancer trapping. Front Ge- net 6, 226. |
| 28 | Zhu XG, Govindjee, Baker NR, deSturler E, Ort DR, Long SP (2005). Chlorophyll a fluorescence induction kinetics in leaves predicted from a model describing each discrete step of excitation energy and electron transfer associated with Photosystem II.Planta 223, 114-133. |
| [1] | 闫小莉, 刘贵梅, 李小玉, 江宇翔, 全小强, 王燕茹, 曲鲁平, 汤行昊. 不同氮添加水平和铵硝态氮配比环境下木荷幼苗光合及叶绿素荧光特性[J]. 植物生态学报, 2025, 49(4): 624-637. |
| [2] | 王贝贝, 吴苏, 王苗苗, 胡锦涛. 日光诱导叶绿素荧光不同组分在作物总初级生产力估算中的贡献比例: 多时间尺度分析[J]. 植物生态学报, 2025, 49(4): 562-572. |
| [3] | 刘柯言, 韩璐, 宋午椰, 张初蕊, 胡旭, 许行, 陈立欣. 基于日光诱导叶绿素荧光探测干旱对黄土高原植被光合稳定性的影响[J]. 植物生态学报, 2025, 49(3): 415-431. |
| [4] | 全小强, 王燕茹, 李小玉, 梁海燕, 王立冬, 闫小莉. 氮添加和铵硝态氮配比对杉木幼苗光合特性及叶绿素荧光参数的影响[J]. 植物生态学报, 2024, 48(8): 1050-1064. |
| [5] | 车佳航, 李纬楠, 秦英之, 陈金焕. 木本植物叶色变异机制研究进展[J]. 植物学报, 2024, 59(2): 319-328. |
| [6] | 高敏, 缑倩倩, 王国华, 郭文婷, 张宇, 张妍. 低温胁迫对不同母树年龄柠条锦鸡儿种子萌发幼苗生理和生长的影响[J]. 植物生态学报, 2024, 48(2): 201-214. |
| [7] | 王妮, 李朝娜, 郑旭理, 姜思成, 杨海芸. 花叶矢竹叶片色素合成和光合特性[J]. 植物生态学报, 2024, 48(11): 1536-1546. |
| [8] | 师生波, 周党卫, 李天才, 德科加, 杲秀珍, 马家麟, 孙涛, 王方琳. 青藏高原高山嵩草光合功能对模拟夜间低温的响应[J]. 植物生态学报, 2023, 47(3): 361-373. |
| [9] | 任培鑫, 李鹏, 彭长辉, 周晓路, 杨铭霞. 洞庭湖流域植被光合物候的时空变化及其对气候变化的响应[J]. 植物生态学报, 2023, 47(3): 319-330. |
| [10] | 师生波, 师瑞, 周党卫, 张雯. 低温对高山嵩草叶片光化学和非光化学能量耗散特征的影响[J]. 植物生态学报, 2023, 47(10): 1441-1452. |
| [11] | 李晨, 刘建廷, 樊永信, 赵雪惠, 肖伟, 陈修德, 付喜玲, 李玲, 李冬梅. UV-B对设施桃叶片光合功能及叶绿体超微结构的影响[J]. 植物学报, 2022, 57(4): 434-443. |
| [12] | 冼应男, 张瑛, 李宝珍, 罗沛, 肖润林, 吴金水. 绿狐尾藻光合色素组成及氮磷化学计量学特征对外源铵的响应[J]. 植物生态学报, 2022, 46(4): 451-460. |
| [13] | 杨凯如, 贾绮玮, 金佳怡, 叶涵斐, 王盛, 陈芊羽, 管易安, 潘晨阳, 辛德东, 方媛, 王跃星, 饶玉春. 水稻黄绿叶调控基因YGL18的克隆与功能解析[J]. 植物学报, 2022, 57(3): 276-287. |
| [14] | 王浩, 王明, 梁婷, 姚玉新, 杜远鹏, 高振. 气温和根区温度对葡萄叶片光合荧光特性的影响[J]. 植物学报, 2022, 57(2): 209-216. |
| [15] | 薛金儒, 吕肖良. 黄土高原生态工程实施下基于日光诱导叶绿素荧光的植被恢复生产力效益评价[J]. 植物生态学报, 2022, 46(10): 1289-1304. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||