芍药科(Paeoniaceae)芍药属(Paeonia)分为牡丹亚属(Subgenus Moutan)、芍药亚属(Subgenus Paeonia)和芍药属亚属间杂交种(Intersubgeneric hybrids of Paeonia) (即伊藤杂种(Itoh hybrids)) (Zhou et al., 2021)。伊藤杂种是以牡丹(Paeonia suffruticosa)和芍药(P. lactiflora)为父母本得到的远缘杂交种, 兼具牡丹与芍药的共同特征和优点(郝青等, 2008)。截至目前, 在美国芍药协会上登记的伊藤品种有162个(
‘和谐’是国内首个伊藤杂种, 由郝青等(2008)发现与命名, 并从形态学和分子生物学两方面证实‘和谐’是紫斑牡丹与芍药远缘杂交形成的新材料, 其成功开花是我国芍药属育种史上的一个里程碑。‘和谐’花单瓣, 呈浅紫红色, 基部有黑紫色花斑(图1A), 花青素和类黄酮的含量较高, 是芍药属花色发育研究的重要模式材料(韩鲲等, 2021; Li et al., 2022)。同时, ‘和谐’的花粉亲和力达4.1%, 是珍贵的育种材料(荆丹丹等, 2011), 具有一定的可育性(Gu et al., 2019)。此外,‘和谐’根、茎和叶的化学成分含量高, 其中, 茎和叶富含单萜苷、酚类和黄酮类物质, 抗氧化能力强; 根部含有较高的没食子酸、肉桂酸和丹皮酚(Tong et al., 2021), 药用价值高, 应用前景广阔。
图1
图1
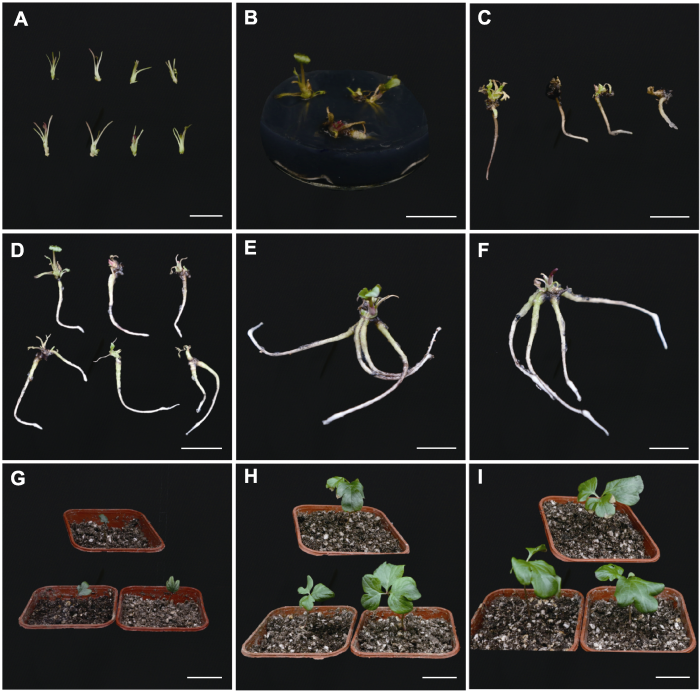
‘和谐’鳞芽启动与单芽增殖
(A) 花; (B) 外植体; (C)-(E) 鳞芽在不同浓度(0.5、1.0和1.5 mg∙L-1) 6-BA启动培养30天后试管苗生长状态; (F) 增殖培养30天后单芽生长状态。Bars=2 cm
Figure 1
Bud initiation and single bud proliferation of 'He Xie'
(A) Flowers; (B) Explants; (C)-(E) The performance of test-tube plantlets after bud initiation at different 6-BA concentrations (0.5, 1.0, and 1.5 mg∙L-1) for 30 days; (F) Growth situation of single shoot after proliferation culture for 30 days. Bars=2 cm
本研究以伊藤杂种‘和谐’鳞芽为外植体, 探究不同灭菌时间、植物生长调节剂(plant growth regulators, PGRs)浓度、根诱导时间对组培苗启动、增殖和生根的影响以及不同生根苗等级的驯化效果, 建立了‘和谐’快繁技术体系, 为其组培快繁技术研究提供理论支撑。
1 植物材料
2021年3月初, 从中国科学院植物研究所植物园(现国家植物园南园)牡丹芍药种质资源圃取伊藤杂种‘和谐’(Itoh hybrids ‘He Xie’)处于萌动期饱满的鳞芽, 用冰盒带回实验室作为外植体材料(图1B)。
2 培养基成分与培养条件
2.1 外植体消毒
剥去鳞芽外层带有泥土以及褐色的2层鳞片, 在超净工作台中使用75%乙醇表面消毒1分钟, 用2%次氯酸钠溶液分别灭菌8、10和12分钟, 再用无菌水清洗5次, 每次1分钟, 最后剥去剩余鳞片及小叶, 接种于MS+1.5 mg∙L-1 6-BA+0.2 mg∙L-1 NAA+0.3 mg∙L-1 GA3培养基上。每处理组9瓶, 每瓶1个芽。培养7天后统计芽污染率及存活率, 筛选出最佳消毒时间。
基础营养培养基为MS+3%蔗糖+7.0 g∙L-1琼脂, pH5.8-6.0, 121°C灭菌20分钟。培养条件: 温度为(24±1)°C, 光照强度为50 µmol∙m-2∙s-1, 光周期为14小时光照/ 10小时黑暗。
2.2 初代培养
将鳞芽接种至添加0.2 mg∙L-1 GA3与不同浓度6-BA的培养基中, 同时添加0.5 mg∙L-1 AgNO3防止褐化(闫晓芳和屈武斐, 2020)。设置不同6-BA浓度(0.5、1.0和1.5 mg∙L-1)。共3个处理组, 每处理组15个外植体, 3次重复。前3天暗培养, 培养条件同2.1节。30天后统计并记录芽诱导率、增殖系数(茎长≥1.0 cm的芽数)、单株茎长、单株叶片数和生长情况。
2.3 增殖培养
选取茎长≥1.0 cm的健壮单芽进行增殖培养, 分离腋芽后接种到添加不同浓度GA3 (0.2、0.5和0.8 mg∙L-1)的培养基中, 另加450 mg∙L-1 CaCl2、0.2 mg∙L-1 IBA、0.5 mg∙L-1 6-BA与0.5 mg∙L-1 AgNO3 (闫晓芳和屈武斐, 2020)。共3个处理组, 每处理24个芽, 培养条件同2.1节。培养35天后, 统计增殖系数与褐化率。继续进行继代(1-5代)培养, 探究不同继代次数对增殖的影响, 每35天继代1次, 统计增殖率。
2.4 生根培养
生根培养采用改良的两步法, 以茎长≥1.0 cm的健壮单芽为材料, 旨在筛选出诱导生根的最佳天数及IBA浓度。
根诱导培养: 将增殖培养35天不保留叶的单芽(图2A)接入添加1/2MS、1.0 mg∙L-1腐胺与不同浓度(0.5、1.0、1.5、2.0和2.5 mg∙L-1) IBA的培养基中。共5个处理组, 每个处理组21株试管苗。先置于4°C冰箱暗处理8天, 再在(24±1)°C下全天暗培养, 分别在30、40和50天调查生根诱导情况。
图2
图2
‘和谐’试管苗生根和驯化移栽的生长表现
(A) 用于生根诱导的单芽(bar=2 cm); (B) 春化30天(冷处理8天, 根诱导30天, 根伸长20天后于4°C冷藏30天)的生根苗(bar= 2 cm); (C)-(F) 不同生根质量的试管苗(C: 三级苗; D: 二级苗; E, F: 一级苗) (bars=2 cm); (G)-(I) 驯化60天不同生根质量的移栽苗(G: 三级苗; H: 二级苗; I: 一级苗) (bars=3 cm)
Figure 2
The growth performance for rooting and domesticated transplanting of ‘He Xie’ tube plantlet
(A) Single shoots used for root induction (bar=2 cm); (B) Rooted seedlings after 30 d of vernalization (cold treatment for 8 days, root induction for 30 days, and root elongation for 20 days, cold storage at 4°C for 30 days) (bar=2 cm); (C)-(F) The test tube plantlets with different rooting qualities (C: Tertiary; D: Secondary; E, F: Primary) (bars=2 cm); (G)-(I) The transplanted seedlings of different rooting quality for domesticating 60 d (G: Tertiary; H: Secondary; I: Primary) (bars=3 cm)
根形成培养: 将根诱导培养各处理的试管苗转入添加1/2MS与1.0 g∙L-1活性炭(AC)的培养基中以促进根的伸长, 培养条件同2.1节。培养20天后统计并记录生根数、根长、生根率与愈伤组织质量。
2.5 驯化与移栽
将根形成20天后的生根苗置于4°C冰箱中暗处理30天(图2B)以解除休眠, (24±1)°C光照下闭瓶适应1周, 然后开瓶炼苗3-5天(Bouza et al., 1992, 1994a)。将生根苗从瓶内取出, 平行于地面放置, 测量最长根的横径, 并结合根茎发育情况将生根苗分为3级。三级苗(图2C): 基部愈伤化严重, 愈伤组织较大; 根数≤1条, 根较短、多呈白色透明状, 茎部褐色。二级苗(图2D): 基部膨大, 愈伤组织较小; 呈绿色或灰绿色, 端白; 根数1-3条, 茎部发育良好, 叶黄色或无叶。一级苗(图2E, F): 基本无愈伤组织, 根数≥3条, 根较长, 呈绿色, 端白; 茎部发育良好, 无茎尖坏死。将生根试管苗移栽至塑料花盆(长×宽×高=8 cm × 8 cm × 9 cm)中, 移栽基质为珍珠岩:蛭石:草炭土=1:1:1 (v/v/v)。移栽苗在光照培养箱中培养, 常规水肥管理。培养条件: 温度为(20±1)°C, 湿度从70%逐渐降至60%, 光照强度为50 µmol∙m-2∙s-1, 光周期为14小时光照/10小时黑暗。每隔10天观察苗的生长状态并调查移栽苗的成活率, 每隔20天拍照并记录生长状况。
2.6 数据处理与分析
利用以下公式进行计算。
芽污染率=(芽污染数/接种外植体数)×100%;
芽褐化率=(芽褐化数/接种外植体数)×100%;
芽诱导率=(芽萌发外植体数/接种外植体数)× 100%;
芽增殖系数=培养末期茎长≥1 cm芽数/接种芽数;
生根率=(生根茎段数/培养茎段数)×100%。
采用SPSS 25.0软件对数据进行方差分析。利用Duncan法检验差异显著性(P≤0.05)。
3 结果与讨论
3.1 不同消毒时间对外植体消毒效果的影响
外植体用2%次氯酸钠溶液进行消毒, 不同处理时间下的污染率见表1。结果表明, 外植体污染率随次氯酸钠灭菌时间的增加呈逐渐下降趋势, 灭菌12分钟效果最好, 此时芽的状态最佳, 污染率为9.09%。在同一灭菌处理下, 外植体从第3天开始出现污染, 培养1周后, 部分外植体长菌, 有的菌呈乳白色黏状, 且随时间的延长逐渐浸满整个培养基; 有的菌为绿色或白色带毛的霉菌。未被污染的外植体在不同处理时间下成活率均达100%。
表1 不同消毒时间下‘和谐’鳞芽的污染率和存活率
Table 1
| Treatments | Time (min) | Sodium hypochlorite | Contamination rate (%) | Survival rate (%) |
|---|---|---|---|---|
| X1 | 8 | 2% | 62.5 | 100 |
| X2 | 10 | 2% | 40.0 | 100 |
| X3 | 12 | 2% | 9.09 | 100 |
3.2 不同浓度6-BA对鳞芽初代培养的影响
将‘和谐’鳞芽接种到启动培养基, 3天后芽开始膨大萌发, 体积变大; 15-20天, 鳞芽的新梢由嫩红色逐渐变为带红褐的绿色, 之后伸长的芽在其节处抽生出芽, 并逐渐展叶, 叶片呈绿色或紫红色, 数量随时间的延长增多。外植体在含不同浓度6-BA的培养基中, 丛生芽的诱导率均达100% (表2)。接种30天, 处理组1的增殖系数显著低于另两个处理组, 各处理组之间的单株茎长与单株复叶数无显著差异。处理组3的单芽数量多, 褐化率低, 单株茎长, 成活率高且增殖系数为2.93, 此时植株生长健壮, 叶面积更大(图1C- E)。因此, 确定添加1.5 mg∙L-1 6-BA最适宜‘和谐’鳞芽启动培养。
表2 不同浓度6-BA对‘和谐’鳞芽初代培养的影响
Table 2
| Treatments | GA3 (mg∙L-1) | 6-BA (mg∙L-1) | Induction rate (%) | Browning rate (%) | Multiplication factor (n) | Stem length (cm) | Leaves per plant (n) |
|---|---|---|---|---|---|---|---|
| 1 | 0.2 | 0.5 | 100 | 20 | 2.40±0.26 b | 2.58±0.60 a | 6.47±1.01 a |
| 2 | 0.2 | 1.0 | 100 | 10 | 2.80±0.10 a | 2.95±0.23 a | 7.80±0.70 a |
| 3 | 0.2 | 1.5 | 100 | 10 | 2.93±0.12 a | 3.05±0.41 a | 6.93±0.21 a |
数据为平均值±标准误。同列不同小写字母表示用邓肯检验法差异显著(P≤0.05)。
Data are means±SE. Different lowercase letters in the same column indicate significant differences based on Duncan’s test (P≤ 0.05).
3.3 不同浓度GA3与继代次数对增殖培养的影响
表3 GA3浓度对‘和谐’试管苗增殖的影响
Table 3
| Treatments | 6-BA (mg∙L-1) | IBA (mg∙L-1) | GA3 (mg∙L-1) | Multiplication factor (n) | Browning rate (%) |
|---|---|---|---|---|---|
| 1 | 0.5 | 0.2 | 0.2 | 3.25±0.33 a | 0.04±0.07 a |
| 2 | 0.5 | 0.2 | 0.5 | 2.67±0.29 ab | 0.08±0.07 a |
| 3 | 0.5 | 0.2 | 0.8 | 2.13±0.33 b | 0.17±0.07 a |
数据为平均值±标准误。同列不同小写字母表示用邓肯检验法差异显著(P≤0.05)。
Data are means±SE. Different lowercase letters in the same column indicate significant differences based on Duncan’s test (P≤0.05).
3.4 不同浓度IBA与诱导时间对生根培养的影响
生根率与IBA浓度及诱导时间显著相关(表4)。IBA浓度为2.5 mg∙L-1 (组合14), 诱导天数为40天时‘和谐’无菌苗生根率最高, 为71.43%, 平均生根数为2.06, 平均根长为5.26 cm; 其次是IBA浓度为2.0 mg∙L-1 (组合10), 诱导30天时生根率为66.67%, 平均生根数为3.33, 根数最多为7条, 平均根长为4.77 cm; 其它IBA浓度及诱导时间组合的生根率和平均生根数均显著低于以上2个组合。组合14和组合10的生根率和平均根长差异不显著, 但组合10的平均根数高于组合14, 且诱导时间更短。综合考虑, 确定IBA浓度为2.0 mg∙L-1、诱导30天最适合生根诱导。
表4 IBA浓度与诱导时间对诱导生根的影响
Table 4
| Treatments | IBA (mg∙L-1) | Induction time (d) | Rooting rate (%) | Rooting number (n) | Root length (cm) |
|---|---|---|---|---|---|
| 1 | 0.5 | 30 | 1.59±2.75 h | 0.67±1.15 cd | 1.53±2.66 bc |
| 2 | 0.5 | 40 | 19.05±2.75 fg | 2.00±1.15 abc | 5.20±2.66 a |
| 3 | 0.5 | 50 | 14.29±0.00 g | 1.33±0.58 cde | 3.87±0.23 ab |
| 4 | 1.0 | 30 | 19.05±8.24 fg | 1.33±0.58 cde | 5.33±1.94 a |
| 5 | 1.0 | 40 | 3.17±5.50 h | 0.67±1.15 cd | 1.53±2.66 bc |
| 6 | 1.0 | 50 | 0.00±0.00 h | 0.00±0.00 d | 0.00±0.00 c |
| 7 | 1.5 | 30 | 14.29±0.00 g | 1.67±1.15 abc | 4.17±2.75 ab |
| 8 | 1.5 | 40 | 33.33±8.25 de | 2.00±0.50 abc | 4.73±0.13 a |
| 9 | 1.5 | 50 | 28.57±0.00 ef | 2.67±1.15 ab | 5.33±0.50 a |
| 10 | 2.0 | 30 | 66.67±8.25 a | 3.33±0.58 a | 4.77±0.65 a |
| 11 | 2.0 | 40 | 42.86±0.00 bcd | 2.78±0.39 ab | 5.33±0.62 a |
| 12 | 2.0 | 50 | 47.62±8.24 bc | 2.33±0.67 abc | 4.95±1.58 a |
| 13 | 2.5 | 30 | 38.10±8.25 cde | 1.72±0.25 abc | 4.85±1.73 a |
| 14 | 2.5 | 40 | 71.43±0.00 a | 2.06±0.42 abc | 5.26±0.52 a |
| 15 | 2.5 | 50 | 52.38±8.24 b | 2.11±0.84 abc | 5.38±0.98 a |
数据为平均值±标准误。同列不同小写字母表示用邓肯检验法差异显著(P≤0.05)。
Data are means±SE. Different lowercase letters in the same column indicate significant differences based on Duncan’s test (P≤0.05).
3.5 生根质量与生根数对驯化移栽的影响
表5 不同生根数与生根质量对不同时间移栽苗成活率的影响
Table 5
| Rooting quality | Survival rate (%) | |||||
|---|---|---|---|---|---|---|
| 10 d | 20 d | 30 d | 40 d | 50 d | 60 d | |
| Level 1 | 96.00 | 92.00 | 72.00 | 72.00 | 64.00 | 52.00 |
| Level 2 | 87.80 | 85.37 | 73.17 | 62.85 | 60.98 | 48.78 |
| Level 3 | 52.38 | 47.62 | 28.57 | 19.05 | 14.29 | 14.29 |
3.6 讨论
伊藤杂种是牡丹和芍药的杂交种, 大部分为三倍体, 不结实, 目前只能采用分株或嫁接的方式进行繁殖, 繁殖效率低, 育种时间长, 导致其价格昂贵(马翔龙等, 2018), 严重制约了产业化发展。因此, 建立植物离体培养体系对种质资源保护、种苗繁殖以及工厂化生产均具有重要意义(唐凤鸾等, 2019; 王亚琴等, 2020)。近年来, 对伊藤杂种的离体快繁技术鲜有研究, 仅有李刘泽木(2016)和孙茂桐等(2022)分别对美国选育的黄色伊藤杂种‘巴茨拉’进行微繁殖技术研究, 后者还建立了‘巴茨拉’愈伤组织诱导体系。目前尚未见对其它伊藤杂种鳞芽离体快繁的研究报道。鳞芽离体培养过程包括灭菌培养、启动培养、增殖培养、生根培养和驯化移栽, 每个步骤的技术体系都是鳞芽离体培养的关键所在。本研究对伊藤杂种‘和谐’离体快繁的各阶段分别进行优化, 解决了伊藤杂种‘和谐’离体培养中增殖率低、生根难和移栽成活率低的难题, 建立了伊藤杂种‘和谐’的离体快繁技术体系。
3.6.1 外植体与消毒剂对鳞芽消毒效果的影响
研究表明, 早春的腋芽是最适宜牡丹繁殖的外植体(孔祥生和张妙霞, 1998)。因此, 本研究选择‘和谐’早春的鳞芽(活动芽)作为外植体。外植体的带菌状况对培养物的建立和生长有重要影响, 因此对外植体采取有效的消毒处理是组织培养中的关键步骤(胡凯等, 2007)。乙醇、升汞和次氯酸钠是植物组织培养中常用的消毒剂(张伟彬, 2022)。用乙醇对外植体进行消毒, 以70%-75%乙醇杀菌60秒效果较好。但乙醇不能彻底消毒, 一般不单独使用, 需与次氯酸钠溶液配合使用。然而, 使用乙醇和次氯酸钠消毒时间并非越长越好, 乙醇和次氯酸钠作用时间过长, 一方面会使外植体表面受损, 破坏植物组织器官; 另一方面可能会使乙醇或次氯酸钠残留在外植体表面。因此在消毒过程中, 需要用灭菌去离子水将外植体冲洗干净, 避免因消毒剂的残留导致外植体染菌(文书生等, 2016)。本研究用2%次氯酸钠溶液对‘和谐’鳞芽进行消毒, 浸泡12分钟时, 液体呈微黄色, 外层鳞片无破损, 萌发率高, 污染率低, 然而具体消毒时间需根据外植体大小和取样时间等确定, 适当增加2-3分钟, 灭菌效果会更好。
3.6.2 植物生长调节剂对初代培养与增殖培养的影响
植物生长调节剂(PGRs)在植物组织培养中发挥至关重要的作用(Murashige, 1974)。生长素和细胞分裂素的比例决定发育的细胞类型, 不同浓度PGRs诱导产生的形态发生过程不同(刘世强等, 1995)。初代培养时, 培养基中添加较多的细胞分裂素和少量的生长素更有利于不定芽的发生与伸长, 此时芽部的细胞会横向分裂与增殖, 从而促进芽的形成(刘东奇, 2013)。李孟悦等(2021)研究表明, 不同种类植物对培养基成分要求不同, 再生能力也存在差异, 原因可能与植物激素含量和植物种类有关。在芍药属组织培养过程中, 适量的植物生长调节剂有利于组培苗的生长, 浓度过高或过低均会对组培苗产生不利影响。通过比较玉米素(ZT)、异戊烯基腺嘌呤(2iP)、激动素(KT)、异戊烯腺苷(iPA)和BA对丛生芽诱导的影响, 发现BA诱导效果最佳(Bouza et al., 1994a)。大量研究表明, BA与GA3配合使用可促进茎段生长, 提高增殖率(文书生等, 2016; 王新等, 2016; 刘政安等, 2021)。因此, 本研究参照李刘泽木(2016)与王新(2016)的配方进行改良与优化, 筛选出1.5 mg∙L-1 6-BA与0.2 mg∙L-1 GA3 组合最适合‘和谐’启动培养, 0.5 mg∙L-1 6-BA、0.2 mg∙L-1 GA3和0.2 mg∙L-1 IBA组合适合‘和谐’增殖培养。但用这种激素组合进行增殖培养时不能连续培养超过3代, 否则易造成茎尖及叶片坏死。研究表明, 将Ca2+浓度提高2倍或将只含6-BA的培养基与含6-BA和GA3的培养基配合使用, 可以减缓此现象(Bouza et al., 1994a)。在植物组织培养中, 芍药属组培苗的增殖和生长除受植物生长调节剂的作用外, 还与外植体类型、不同种及品种的基因型、培养基添加物和培养条件等因素有关, 这些因素对‘和谐’组培苗的影响有待进一步研究。
3.6.3 生根培养基对不定根诱导与根伸长的影响
生根是芍药属离体快繁技术研究的难点, 提高生根率和生根质量是建立‘和谐’离体快繁技术的关键。目前, 最常用于生根的基础培养基为1/2MS, 诱导生根激素为IBA与1.0 mg∙L-1腐胺(李刘泽木, 2016; 文书生, 2016; 王新, 2016)。王金祥等(2005)研究表明, 启动不定根形成的重要因子中, IBA在根原基诱导阶段起重要作用, IBA可促进嫩叶和嫩芽中合成的IAA运至基部, 从而促进生根, 且比IAA生根作用更强更稳定。安佰义(2005)发现IBA对根的分化和生长的效果优于NAA, 因此选用IBA作为诱导生根的PGRs。根据IBA的使用方法不同, 牡丹试管苗生根可分为4种, 分别是一步生根法(孔祥生和张妙霞, 1998)、速蘸法(Bouza et al., 1994b)、两步生根法(Beruto et al., 2004)与三步生根法(贾文庆等, 2012)。
三步生根法亦称改良的两步生根法, 即先将用于生根的无菌试管苗置于2-8°C低温下培养8-14天。低温配合黑暗处理可提高试管苗生根率, 原因可能是低温暗环境抑制一些酶的活性, 减少酚类氧化和PGRs物质分解, 有利于前期组培苗吸收营养物质(殷丽青等, 2012)。根诱导和根伸长培养后, 生根率明显高于未经低温预处理的材料(Beruto et al., 2004; 贾文庆等, 2012)。多数研究表明, 最佳生根方式为改良的两步生根法(Beruto et al., 2004; 邱金梅, 2010)。本实验也采用改良的两步生根法, 使用IBA和腐胺作为根诱导激素, 将试管苗转入根诱导培养基后, 在2-8°C低温下处理8天(王新, 2016), 暗环境下诱导30天, 最后在光下根伸长20天获得生根的幼苗。
根诱导过程中, 由于试管苗小叶会抑制芽的生长, 本研究选取无叶的单芽以利于植株生长(李刘泽木, 2016)。在根伸长过程中, 我们还加入了1.0 mg∙L-1 AC。前期研究表明, AC对芍药属生根苗有一定的影响, Bouza等(1994b)发现AC可提高生根质量。AC促进试管苗生根的原因可能是为根的生长发育创造了近似自然生长条件的黑暗环境, 且吸附了培养基中有毒副作用的物质, 降低了盐离子浓度(张倩和王华芳, 2012)。组培苗自身的生理状态对于生根有重要影响。后续可在诱导生根前先将单芽复壮培养10-20天, 芽健壮更利于生根, 但培养时间过长会使苗发黄老化; 或者增加继代次数和探索更合适的继代周期; 或是先在含有生长素的培养基中培养4-6天, 对新生根的生长发育更为有利。通过促进试管苗的生长来提高生根率和生根数, 还有待进一步研究。
3.6.4 移栽与驯化对幼苗成活率的影响
正确的炼苗移栽方法、上盆时间、栽培基质、环境条件及移栽后的温湿度调控与管理手段, 均是影响生根苗成活的重要技术环节。用于移栽的试管苗先在4°C下暗处理30天, 常温光下适应1周, 有利于打破茎叶休眠, 使茎叶萌发与伸长。安佰义(2005)研究表明, 生根苗移栽前拧松瓶盖, 在培养架上炼苗3-5天, 适当增加光照, 随后放入培养室内培养, 温度(25± 1)°C, 湿度大于80%, 幼苗成活率可达80%。本研究将生根苗按生根数与愈伤组织质量分成3个等级, 移栽60天后, 一级苗成活率为52.0%, 根数≥3条, 无愈伤组织, 生根苗成活率更高, 移栽苗的长势更好。本研究成功实现伊藤杂种‘和谐’生根移栽, 移植30天是移栽苗成活的关键时期, 这段时间应注重管理养护, 加强光照(40%)、温度((21±1)°C)和湿度(60%-80%)等环境条件的控制, 防止幼苗因管理不善导致萎蔫。李志军等(2006)及文书生等(2016)研究发现, 移栽前使用多菌灵灭菌可提高幼苗的成活率并加速生根苗移栽后的生长, 为进一步提高伊藤‘和谐’生根移栽成活率提供了可行思路。
作者贡献声明
康敏: 完成实验与数据分析, 撰写论文初稿; 张美莹: 参与实验并分析数据; 齐秀双, 佟宁宁, 李旸, 舒庆艳, 刘政安: 参与实验设计, 提供技术支持; 吕长平, 彭丽平: 构思并设计实验, 指导数据分析、论文写作与修改。
参考文献

我国首次发现并鉴定芍药牡丹远缘杂交种的过程及方法,并将该杂种命名为‘和谐’。通过对牡丹、芍药栽培品种及杂交种‘和谐’的观察、研究发现:‘和谐’的形态兼具有芍药与牡丹且多趋于芍药的特征,从DNA水平上检测到了与牡丹、芍药共有的特征条带。从形态学和分子生物学两方面证明了‘和谐’为芍药和牡丹远缘杂交形成的宿根类植物。

以毛报春(Primula × pubescens)无菌腋芽为外植体, 分析不同浓度激素配比对愈伤组织诱导和分化以及不定芽增殖和生根的影响, 筛选出不同阶段的最适培养基, 优化毛报春的组织培养再生体系。结果表明, 毛报春腋芽愈伤组织诱导及分化的最适培养基为MS+0.2 mg∙L<sup>-1</sup> NAA+1.0 mg∙L<sup>-1</sup> 6-BA, 诱导率达84%, 出芽率达67%; 不定芽增殖最适培养基为MS+0.5 mg∙L<sup>-1</sup> NAA+0.2 mg∙L<sup>-1</sup> 6-BA, 增殖率可达67%, 苗绿且健壮; MS+0.2 mg∙L<sup>-1</sup> NAA培养基最有利于组培苗的生根及伸长, 平均单株生根数为9条, 生根率高达70%。该研究建立了毛报春的组织培养再生体系, 可为报春属其它植物的遗传研究及种质创新提供参考。

以走马胎(Ardisia gigantifolia)幼嫩茎段为外植体, 通过腋芽增殖的方式进行组织培养和快速繁殖研究。结果表明, 培养基MS+1.0 mg·L <sup>-1</sup> 6-BA+0.2 mg·L <sup>-1</sup>NAA和MS+0.5 mg·L <sup>-1</sup> ZT均可用于腋芽的诱导和前期继代培养, 诱导率分别为89.3%和85.7%; 芽增殖最佳培养基为MS+0.5 mg·L <sup>-1</sup>6-BA+0.1 mg·L <sup>-1</sup>ZT+0.1 mg·L <sup>-1</sup>NAA, 增殖系数为4.3倍; 根诱导最佳培养基为1/2MS+1.5 mg·L <sup>-1</sup> IAA+1.0 mg·L <sup>-1</sup> NAA, 生根率达92.3%, 且根系发达, 植株健壮; 生根苗在混合基质园土:泥炭:珍珠岩=3:1:1 (v/v/v )中移栽成活率为82%。该研究建立了走马胎种苗的组织培养快速繁殖技术体系, 且可应用于规模化生产。

采用常规压片法,对5个芍药属伊藤杂种进行了核型分析。结果表明:5个芍药属伊藤杂种的品种均为三倍体(2n=3x=15),核型不对称系数为61.02%~62.41%,核型类型均属于2A型,所有品种的核型均由中部(m)、近中部(sm)和近端部(st)的着丝粒染色体组成。本研究首次摸清了芍药属伊藤杂种的核型背景,为品种改良提供了细胞学资料。

牡丹组织培养从1984 年报道至今,试管苗生根率低和小植株移栽成活率低的问题还没有得到很好的解决,还不能用于苗木生产和生物育种。根据植物组织培养程序综述了牡丹试管苗生根和移栽研究进展,分析影响试管苗生根的主要因素,阐述诱导生根的有效方法;分析小植株移栽成活的影响因素,总结提高移栽成活率的关键技术和方法,为组织培养技术用于牡丹科学研究、细胞与分子育种和种苗生产提供参考。

 首页
首页