
|
|
||
|
硝酸盐转运蛋白NRT2在植物中的功能及分子机制研究进展
植物学报
2023, 58 (5):
783-798.
DOI: 10.11983/CBB22134
氮素作为植物生长发育所需的大量元素, 对植物生长发育及作物产量具有重要作用。施入氮肥是植物及作物的主要氮素来源。面对当下过度施肥造成面源污染加剧的现状, 提高作物氮素利用效率, 实现“减肥增产”的绿色增产增效模式, 是促进我国农业可持续发展及保障国家粮食安全的重要措施。当土壤氮匮缺时, 硝酸盐转运蛋白NRT2家族成员对根系吸收及转运硝酸盐至关重要, 其中NRT2.1在植物缺氮时主要负责根部的硝酸根吸收。该文重点总结了模式植物拟南芥(Arabidopsis thaliana)及重要粮油作物中NRT2家族蛋白特别是NRT2.1的功能及调控机理研究进展, 旨在为后续挖掘NRT2在提高作物产量方面的潜力及分子调控机制研究提供重要依据。
 View image in article
图2
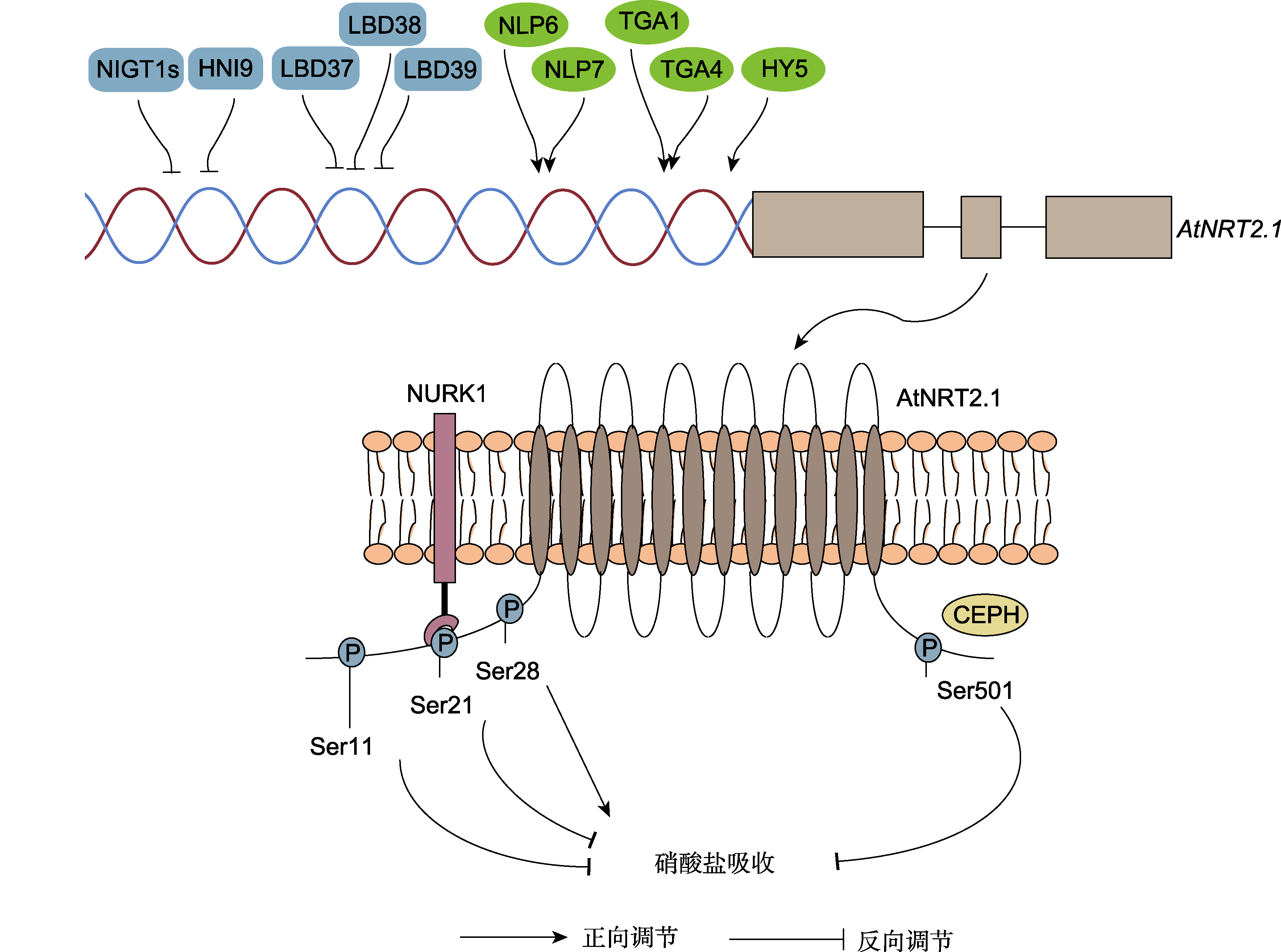
拟南芥硝酸盐转运蛋白AtNRT2.1的分子调控机制总结
双螺旋表示AtNRT2.1的启动子区域, 受到多个转录因子的直接调控。其中蓝色矩形代表转录抑制子, 绿色椭圆形代表转录激活子。定位在质膜上的AtNRT2.1蛋白通过与NURK1激酶或CEPH磷酸酶的互作发生磷酸化或去磷酸化修饰。目前明确调控硝酸根吸收活性的磷酸化位点包括N端Ser11、Ser21、Ser28及C端Ser501。
正文中引用本图/表的段落
众所周知, 根系对硝酸盐的吸收受植物体内氮饱和的系统性反馈抑制, 从而调整根系对氮的需求。目前, 普遍认为这一机制涉及由韧皮部从茎向根传递的长距离信号, 如氮同化产物谷氨酰胺对根系NO3-吸收系统的反馈抑制(Cooper and Clarkson, 1989), 而NRT2.1被认为是这一反馈机制的主要调控靶点(Widiez et al., 2011)。如图2所示, Widiez等(2011)报道了1个编码拟南芥RNA聚合酶II复合体组分蛋白(AtIWS1) INTERACT WITH SPT6的基因HNI9 (HIGH NITROGEN INSENSITIVE 9), 在高氮处理下, HNI9/AtIWS1在根中抑制AtNRT2.1的转录, 初步研究显示, 高氮抑制AtNRT2.1的转录与AtNRT2.1位点组蛋白H3第27位赖氨酸的三甲基化修饰(H3K27me3)有关, 而HNI9/AtIWS1特异性参与H3K27me3的沉积。相关研究结果为揭示NRT2.1受高氮抑制的分子机制提供了新思路。近年来, 研究人员发现拟南芥光响应转录因子HY5 (ELONGATED HYPOCOTYL 5)可以从茎移动到根部, 并激活根部的HY5, 从而激活AtNRT2.1的表达, 进而促进根中硝酸盐的吸收(Chen et al., 2016b), 表明NRT2.1也可以接受来自地上部的信号因子。
其次, 该领域的一些研究证明, 拟南芥AtNRT2.1蛋白的磷酸化和去磷酸化是调控其HATS活性的重要机制, 同时AtNRT2.1也是目前唯一被报道具有磷酸化修饰的NRT2家族成员(图2)。蛋白质磷酸化组学鉴定到拟南芥NRT2.1蛋白的N端和C端域(不包含跨膜域)存在磷酸化位点, 如Ser11、Ser21、Ser28、Ser501和Thr521, 不同位点的磷酸化水平随外界氮环境发生变化(Menz et al., 2016; Li et al., 2020; Jacquot et al., 2020)。低氮诱导拟南芥AtNRT2.1蛋白第28位丝氨酸残基(Ser28)磷酸化并使得蛋白的稳定性增强, 通过将模拟磷酸化失活的NRT2.1S28A以及组成型磷酸化状态的NRT2.1S28E回补拟南芥Atnrt2.1突变体, 发现Ser28位点失活突变导致其生长表型与Atnrt2.1突变体相似, 而NRT2.1S28E的地上部鲜重和NO3-吸收能力均恢复至野生型水平(Zou et al., 2020)。Li等(2020)同样证明AtNRT2.1蛋白Ser28的磷酸化促进NO3-内流, 与之相反, AtNRT2.1蛋白第11位丝氨酸残基(Ser11)磷酸化则起抑制作用, 表明Ser28是一个NO3-吸收的正调控位点, 而Ser11是一个负调控位点。此外, 另一个负调控位点AtNRT2.1蛋白第501位丝氨酸残基(Ser501)的磷酸化导致AtNRT2.1失活, 从而减少NO3-向根系的转运(Jacquot et al., 2020)。上述结果表明, 在感应外界不同环境的刺激下, NRT2.1蛋白不同位点的磷酸化具有正向或负向调节NO3-吸收的作用, 说明在翻译后水平NRT2.1受到了非常精密且复杂的调控。
与其它NRT2定位于质膜不同, AtNRT2.7定位于液泡膜, 在干种子中的表达量很高, 并介导种子中NO3-的积累(Chopin et al., 3 2020 ... 其次, 该领域的一些研究证明, 拟南芥AtNRT2.1蛋白的磷酸化和去磷酸化是调控其HATS活性的重要机制, 同时AtNRT2.1也是目前唯一被报道具有磷酸化修饰的NRT2家族成员(
本文的其它图/表
|