
|
|
||
|
植物NLR免疫受体的识别、免疫激活与信号调控
植物学报
2022, 57 (1):
12-23.
DOI: 10.11983/CBB21159
高等植物进化出大量膜表面和胞内免疫受体以感知各种病原信号, 抵御病原物入侵。其中, 细胞表面的模式识别受体感知模式分子后激活基础免疫反应, 核苷酸结合和富亮氨酸重复蛋白(NLRs)则通过感知病原微生物分泌的效应蛋白激活特异免疫反应, 导致超敏反应与细胞死亡。该文主要综述了NLRs对效应蛋白的识别、植物免疫激活及下游信号调控的最新研究进展。 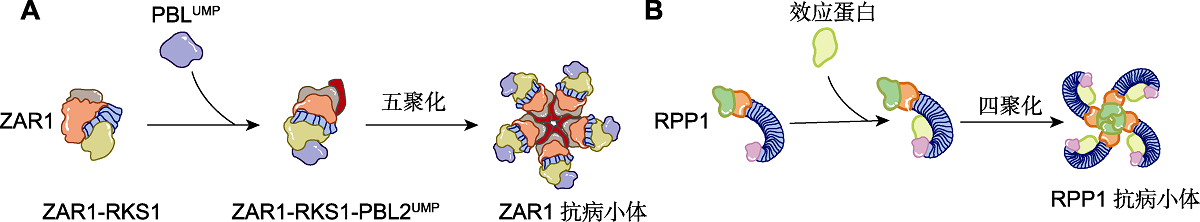 View image in article
图2
两类NLRs的激活方式(改自Duxbury et al.,
(A) CNL (ZAR1)抗病小体形成示意图。黄单胞菌效应蛋白AvrAC尿苷酸化拟南芥激酶PBL2。尿苷化的PBL2 (PBL2UMP)与胞内预先形成的ZAR1-RKS1二聚体结合, 导致ZAR1的构象发生变化, 并在ZAR1 NBD核苷酸结合位点以三磷酸腺苷或脱氧三磷酸腺苷((d)ATP)替换二磷酸腺苷(ADP)。最终, 5个ZAR1-RKS1-PBL2UMP单体形成1个五聚轮状ZAR1抗病小体。(B) TNL (RPP1)抗病小体形成示意图。胞内典型TIR-type NLR通过富亮氨酸重复序列(LRR)和羧基末端结构域(C-JID)直接识别病原体无病毒效应器, 形成具有烟酰胺腺嘌呤二核苷酸糖水解酶(NADase)活性的四聚体结构。
正文中引用本图/表的段落
植物NLRs被激活后形成寡聚复合物, 该结构类似动物中的炎症小体(Davis et al., 2011; Wang et al., 2019; Ma et al., 2020; Martin et al., 2020)。例如, CNL型抗病小体ZAR1包含了ZAR1、受体样胞质激酶(RLCKs) RKS1以及PBL2。来自野油菜黄单胞菌分泌的效应蛋白AvrAC通过其尿苷酰转移酶功能将PBL2转化为PBL2UMP, ZAR1与RKS1形成复合物并招募PBL2UMP形成有活性的PBLUMP-ZAR1-RKS1复合体, 从而完成对AvrAC的特异性识别。该复合物组装成五聚轮状, 并在其平面上形成由5个CC域的N端α-螺旋构成的漏斗状结构(Wang et al., 2019), 用作通道孔开启植物的防御之门(图2A) (Wang et al., 2019; 夏石头和李昕, 2019)。然而, 天然ZAR1寡聚体是否也采用五聚体构型并在植物细胞膜上形成孔结构, 这种孔结构如何调节膜的通透性和底物的选择性, 以及这种活性如何触发细胞死亡和免疫反应目前尚不清楚。
已报道的多数植物TNL在细胞核中定位或发挥作用, TIR极少可能采用与CC结构域相同的机制诱导细胞死亡。通过对动物中含TIR结构域的SARM1 (sterile alpha and TIR motif-containing 1)进行研究, 发现SARM1的TIR结构域具有寡聚依赖性NADase活性。体外生化分析中, 纯化的SARM1 TIR结构域(SARM1TIR)将NAD+切割成二磷酸腺苷核糖(ADPR)、环状二磷酸腺苷核糖(cADPR)和烟酰胺(NAM) (Essuman et al., 2017), 为植物TNL研究奠定了重要基础。近期, 一项突破性研究是利用杆状病毒表达系统在昆虫细胞中共表达TNL类抗病蛋白RPP1及其对应的效应蛋白ATR1, 纯化并通过冷冻电镜单颗粒重构技术, 成功解析了RPP1抗病小体的结构, 发现RPP1-ATR1形成了四聚体(Ma et al., 2020) (图2B)。同时, 另一研究组解析了ROQ1-XopQ类似的四聚体结构(Martin et al., 2020), 表明TNL可能存在共同的激活机制。这些抗病小体的结构解析为揭示RPP1和ROQ1直接识别其同源效应蛋白并四聚化以提高NADase活性, 从而激活下游免疫反应的关键机制奠定了基础。有研究表明, 在RPP1和ROQ1的羧基末端存在1个不同的结构域, 称为C-JID (C-terminal jelly-roll and Ig-like domain) (Ma et al., 2020; Martin et al., 2020)。该结构域与LRR协同介导与效应蛋白的特异性结合, 其残基的突变会破坏其与效应蛋白的互作结构区域, 减轻ETI介导的宿主细胞死亡现象。对于RPP1和ROQ1而言, 效应子与LRR和C-JID的直接结合可能会释放NBD, NBD构象发生变化并寡聚化为四聚体。四聚体环使TIR结构域紧密接触, 形成具有NADase全酶活性的TNL抗病小体。
(A) CNL (ZAR1)抗病小体形成示意图。黄单胞菌效应蛋白AvrAC尿苷酸化拟南芥激酶PBL2。尿苷化的PBL2 (PBL2UMP)与胞内预先形成的ZAR1-RKS1二聚体结合, 导致ZAR1的构象发生变化, 并在ZAR1 NBD核苷酸结合位点以三磷酸腺苷或脱氧三磷酸腺苷((d)ATP)替换二磷酸腺苷(ADP)。最终, 5个ZAR1-RKS1-PBL2UMP单体形成1个五聚轮状ZAR1抗病小体。(B) TNL (RPP1)抗病小体形成示意图。胞内典型TIR-type NLR通过富亮氨酸重复序列(LRR)和羧基末端结构域(C-JID)直接识别病原体无病毒效应器, 形成具有烟酰胺腺嘌呤二核苷酸糖水解酶(NADase)活性的四聚体结构。
(A) CNL (ZAR1)抗病小体形成示意图.黄单胞菌效应蛋白AvrAC尿苷酸化拟南芥激酶PBL2.尿苷化的PBL2 (PBL2UMP)与胞内预先形成的ZAR1-RKS1二聚体结合, 导致ZAR1的构象发生变化, 并在ZAR1 NBD核苷酸结合位点以三磷酸腺苷或脱氧三磷酸腺苷((d)ATP)替换二磷酸腺苷(ADP).最终, 5个ZAR1-RKS1-PBL2UMP单体形成1个五聚轮状ZAR1抗病小体.(B) TNL (RPP1)抗病小体形成示意图.胞内典型TIR-type NLR通过富亮氨酸重复序列(LRR)和羧基末端结构域(C-JID)直接识别病原体无病毒效应器, 形成具有烟酰胺腺嘌呤二核苷酸糖水解酶(NADase)活性的四聚体结构. ...
(A) Schematic diagram of CNL (ZAR1) resistosome formation. The Xanthomonas effector AvrAC uridylates the Arabidopsis thaliana kinase PBL2. Uridylated PBL2 (PBL2UMP) associates with the intracellular pre-formed ZAR1-RKS1 dimer. This leads to a conformational change of ZAR1 and replacement of adenosine diphosphate (ADP) by adenosine triphosphate or deoxyadenosine triphosphate ((d)ATP) in the nucleotide-binding site of the NBD of ZAR1. Ultimately, this results in the formation of a pentameric wheel-like ZAR1 resistosome, which is composed of five ZAR1-RKS1-PBL2UMPprotomers. (B) Schematic diagram of TNL (RPP1) resistosome formation. Direct recognition of a pathogen avirulence effector by the leucine-rich repeat (LRR) and carboxy-terminal domains (C-JID) of a canonical Toll/interleukin-1 receptor (TIR) domain-containing intracellular nucleotide- binding domain (NBD)-like receptor (TIR-type NLR) leads to the formation of a tetrameric structure with nicotinamide adenine dinucleotide glycohydrolase (NADase) activity. ... The SARM1 Toll/interleukin-1 re-ceptor domain possesses intrinsic NAD+cleavage activity that promotes pathological axonal degeneration 1 2017 ... 已报道的多数植物TNL在细胞核中定位或发挥作用, TIR极少可能采用与CC结构域相同的机制诱导细胞死亡.通过对动物中含TIR结构域的SARM1 (sterile alpha and TIR motif-containing 1)进行研究, 发现SARM1的TIR结构域具有寡聚依赖性NADase活性.体外生化分析中, 纯化的SARM1 TIR结构域(SARM1TIR)将NAD+切割成二磷酸腺苷核糖(ADPR)、环状二磷酸腺苷核糖(cADPR)和烟酰胺(NAM) (Essuman et al., A Xanthomonas uridine 5'-monophosphate transferase inhibits plant immune kinases 1 2012 ... 其二是诱饵假说模式.该模式是保卫假说模式的衍生, 指当受NLRs保护的诱饵蛋白除作为效应蛋白识别诱饵外, 在免疫中不具备有其它功能(Zhou and Chai, An EDS1-SAG101 complex is essential for TNL-mediated immunity in Nicotiana benthamiana 1 2019 ... 研究表明, NRG1与EDS1和SAG101在TNL诱导的HR激活中发挥作用(Qi et al., Plant intracellular innate immune receptor resistance to Pseudo-monas syringae pv. maculicola 1 (RPM1) is activated at, and functions on, the plasma membrane 1 2011 ... NLRs广泛分布于细胞质、细胞核、质膜(plasma membrane, PM)、液泡膜和内质网等亚细胞结构(Chiang and Coaker, Bacterial effectors in-duce oligomerization of immune receptor ZAR1 in vivo 1 2020 ... CNL和TNL激活后, 最终产生相似的转录表达, 引发局部和系统抗性(Bartsch et al., A dominant-interfering camta3 muta-tion compromises primary transcriptional outputs mediated by both cell surface and intracellular immune recep-tors in Arabidopsis thaliana 1 2018 ... 近年来, NLRs介导的植物免疫相关重大进展和里程碑式发现, 加深了人们对植物免疫系统感知和调控病原体的理解, 为作物抗病改良提供了新思路.NLRs结构和功能的解析也为揭示CC及TIR结构域的信号转导机制提供了新线索, 使人能更好地理解NLRs如何特异性识别效应蛋白, 及设计新颖特异的NLRs.尽管如此, 仍有许多悬而未决的问题需要进一步探索.例如, 其它CNL或TNL是否形成类似ZAR1、Roq1或RPP1抗病小体结构? 成对的NLRs (如RRS1/RPS4)或形成网络的NLRs是否也能形成类似抗病小体或炎症小体结构以激活免疫反应? 其它hNLR是否可被TNL激活形成类似ADR1/NRG1钙通道以介导细胞死亡和其它下游信号? 是否存在其它被忽视的机制? 另外, TNL-NADase活性如何与下游信号(如转录激活或辅助型NLR激活(如ADR1/NRG1))联系起来也不十分清楚.TNL和CNL激活可导致类似的转录重编程(Jacob et al., Plant ‘helper' im-mune receptors are Ca2+-permeable nonselective cation channels 3 2021 ... 最近的2项突破性研究表明, ZAR1、NRG1a和ADR1均可在质膜形成可供钙渗透的阳离子选择性通道(Bi et al.,
Upon an infection of a plant cell by a pathogen, some pathogens can secrete effectors to break through the immune defense line of plants. In the process of long-term evolution, plants have evolved many intracellular receptors to recognize these effectors, so as to promote resistance to pathogens. CNLs triggers pentamerization and resistosome formation on the plasma membrane (PM) through sensing effector (The example here depicts a ZAR1 resistosome which indirect recognition effector assembly). The pore formed by the N-terminal CC α1 helices serves as a Ca2+ influx channel, mediating increase of cytosolic Ca2+ concentration and turning on cell death and defense responses. TNLs, upon perception of effectors (the model here depicts an example of direct effector-receptor recognition as with RPP1), formation of the TNL resistosome leads to activation of TIR NADase activity, triggering assembly of oligomeric complexes presumably containing EDS1-PAD4-ADR1s or EDS1-SAG101-NRG1s. The oligomerization of the helper NLRs enables a similar pore formation as CNLs, serving as Ca2+ influx channels to mediate downstream immunity and cell death.The red arrows indicate CNL signal, and the blue arrows indicate TNL and RNL signals. ... Direct pathogen-induced assembly of an NLR immune receptor complex to form a holoenzyme 3 2020 ... 植物NLRs被激活后形成寡聚复合物, 该结构类似动物中的炎症小体(Davis et al.,
本文的其它图/表
|