
|
|
||
|
植物NLR免疫受体的识别、免疫激活与信号调控
植物学报
2022, 57 (1):
12-23.
DOI: 10.11983/CBB21159
高等植物进化出大量膜表面和胞内免疫受体以感知各种病原信号, 抵御病原物入侵。其中, 细胞表面的模式识别受体感知模式分子后激活基础免疫反应, 核苷酸结合和富亮氨酸重复蛋白(NLRs)则通过感知病原微生物分泌的效应蛋白激活特异免疫反应, 导致超敏反应与细胞死亡。该文主要综述了NLRs对效应蛋白的识别、植物免疫激活及下游信号调控的最新研究进展。 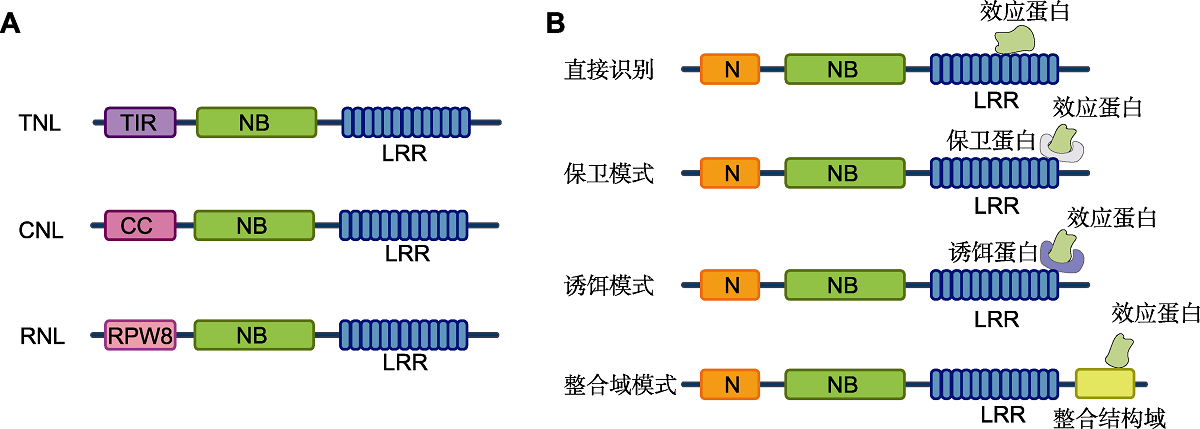 View image in article
图1
NLRs的结构组成及与效应蛋白的识别模式(改自Duxbury et al.,
(A) 植物NLRs的结构域分为3类, 包括中间部位的核苷酸结合域(NBD)和C端的富含亮氨酸重复序列(LRR)结构域以及N端的TIR、CC或类RPW8的CC结构域; (B) 植物NLRs识别效应蛋白的不同模式: 一些植物NLR直接与相应的效应蛋白结合, 或通过保卫蛋白或诱饵蛋白间接检测病原体效应蛋白; 此外, 一些植物NLRs具有特异的整合结构域(ID), 介导效应蛋白的识别。
正文中引用本图/表的段落
根据N末端的不同, 典型的植物NLRs分为2种主要类型: TIR型和CC型。TIR型NLR (TIR-type NLRs, TNL)的特征是其N端具有Toll/白介素1受体(Toll/interleukin-1 receptor, TIR)结构域, 而CC型NLR (CC-type NLRs, CNL)具有卷曲螺旋(coiled-coil, CC)结构域(Tamborski and Krasileva, 2020; Saur et al., 2021) (图1A)。大多数动物中NLRs数目较少, 而高等植物中NLRs数目可达数百个, 除负责病原体效应蛋白识别的免疫受体(sensor NLRs, sNLR)外, 还存在对下游免疫信号起转导功能的辅助免疫受体(helper NLRs, hNLR), 如NRG1以及ADR1蛋白家族中的hNLR, 作用于TNL的下游(Peart et al., 2005; Bonar-di et al., 2011; Dong et al., 2016)。由于ADR1以及NRG1的N端携带RPW8 (Resistance to Powdery Mildew 8)类CC域, 而不是典型的CC域(Jubic et al., 2019), 故也称为RNLs (RPW8-type NLRs)。
NLRs感知效应蛋白最简单且最直观的机制是直接结合识别模式(图1B)。直接识别的一个典型例子是亚麻(Linum usitatissimum) L位点编码的TNL L5、L6和L7 对亚麻栅锈菌(Melampsora lini)效应蛋白AvrL567不同变体的感知(Dodds et al., 2006)。然而, 直接相互作用的识别可能推动了AvrL567基因座多样化衍变, 从而产生12个变体, 其中5个变体具有逃避NLRs结合和阻碍NLRs识别的能力(Dodds et al., 2006)。这种协同进化的“军备竞赛”也推动了亚麻L基因座的多样化, 该基因座含有13个等位基因, 其中包括3个识别单个效应蛋白变体的NLR。同时, L蛋白LRR结构域的高度多态性赋予其对多个AvrL567变体的识别, 因此L6 LRR中11个氨基酸的替换会导致其特异性识别效应蛋白数从多个减少至1个(Dodds et al., 2006; Rayamajhi et al., 2013)。
许多植物NLRs特异性识别时不与效应蛋白直接结合(图1B), 而是以一种间接的识别模式, 该模式可分为2种。其一是保卫假说模式, 是指通过间接配体-受体互作识别效应蛋白(Dangl and Jones, 2001)。NLRs监测效应蛋白(或受保护靶标蛋白)的完整性, 并在感知到受保护蛋白结构或功能发生变化时激活免疫反应。拟南芥中, 多个效应蛋白靶向RIN4 (RPM1-interacting protein 4), 而RPS2 (Resistance to P. syringae 2)和RPM1 (Resistance to P. syringae pv. maculicola 1)则通过蛋白互作监测RIN4, 从而识别效应蛋白。丁香假单胞菌(Pseudomonas syringae)可通过其三型分泌系统(type III secretion system, T3SS)分泌蛋白酶AvrRpt2, 随后AvrRpt2裂解RIN4从而触发RPS2依赖型免疫反应(Axtell and Staskawicz, 2003; Mackey et al., 2003)。此外, 丁香假单胞菌效应因子AvrRpm1诱导RIN4腺苷二磷酸(ADP)核糖基化, 进而导致宿主激酶对RIN4磷酸化, 触发RPM1介导的免疫反应(Chung et al., 2011; Liu et al., 2011; Redditt et al., 2019)。近期的研究结果表明, 病原效应蛋白HopZ5和AvrBst能对RIN4 T166保守位点乙酰化, 从而触发RPM1依赖型免疫反应。需要指出的是, 植物内源性去乙酰化酶SOBER1能够对RIN4 T166去乙酰化, 从而抑制免疫反应的发生。这可能是植物为实现免疫反应的精细调控, 避免免疫过度(Choi et al., 2021)。
一些NLRs包含源于效应蛋白靶向的其它蛋白结构域, 被称为整合结构域(integrated domains, ID), 可识别相应的病原体效应蛋白(图1B)。为此, 一些ID直接与其匹配的效应蛋白互作, 甚至被效应蛋白酶所修饰。这与保卫模式识别类似, ID和NLR之间就像受保卫蛋白与NLR的融合。事实上, ID与NLR融合后导致的遗传连锁带来了诸多好处。例如, 在长期进化过程中, 受保卫蛋白与其对应NLR的突变或等位基因所造成的差异可能导致二者之间失去相容性, 而在整合的NLR-ID中, 这种可能性要小很多。说明NLR和ID的融合可能通过反转录转位或异位重组发生(Bailey et al., 2018)。目前, 已有几个通过NLR-ID模式识别效应蛋白的机制被揭示。研究得最为透彻的实例之一是RRS1 (Resistance to Ralstonia solanacearum 1)介导的青枯菌抗性, 其以C末端的WRKY结构域作为ID (Le Roux et al., 2015; Sarris et al., 2015)。青枯菌分泌的效应蛋白PopP2是一种乙酰转移酶, 能结合并乙酰化WRKY转录因子, 破坏其与DNA的结合以提高致病力(Le Roux et al., 2015; Sarris et al., 2015)。然而, 在超表达RRS1植株中, RRS1的WRKY结构域被PopP2乙酰化, 而WRKY结构域乙酰化足以激活RPS1及RPS4 (Resistance to P. syringae 4)介导的免疫应答(Le Roux et al., 2015; Sarris et al., 2015)。同时, RRS1还具有识别其它效应蛋白的功能。例如, 效应蛋白AvrRps4也能够结合RRS1的WRKY结构域(Sarris et al., 2015)。此外, 包括水稻NLRs RGA5和Pik-1的其它已知植物NLR-ID, 都含有重金属相关(heavy metal-associated, HMA)的整合结构域, 从而识别稻瘟病菌效应蛋白AVR-PikD (Césari et al., 2014)。
本文的其它图/表
|