
|
|
||
|
MBF1调控植物热应答与生长发育分子机制研究进展
植物学报
2022, 57 (1):
56-68.
DOI: 10.11983/CBB21220
MBF1是一种进化上高度保守的转录共激活因子, 存在于所有真核生物中, 可通过连接基础转录机器组分与转录因子来激活基因转录。植物MBF1具有多种重要生物学功能, 包括调控植物生长发育和逆境适应等。该文综述了植物MBF1分子结构与调控机制相关研究进展, 重点总结了AtMBF1c参与植物热胁迫应答调控的分子机制。 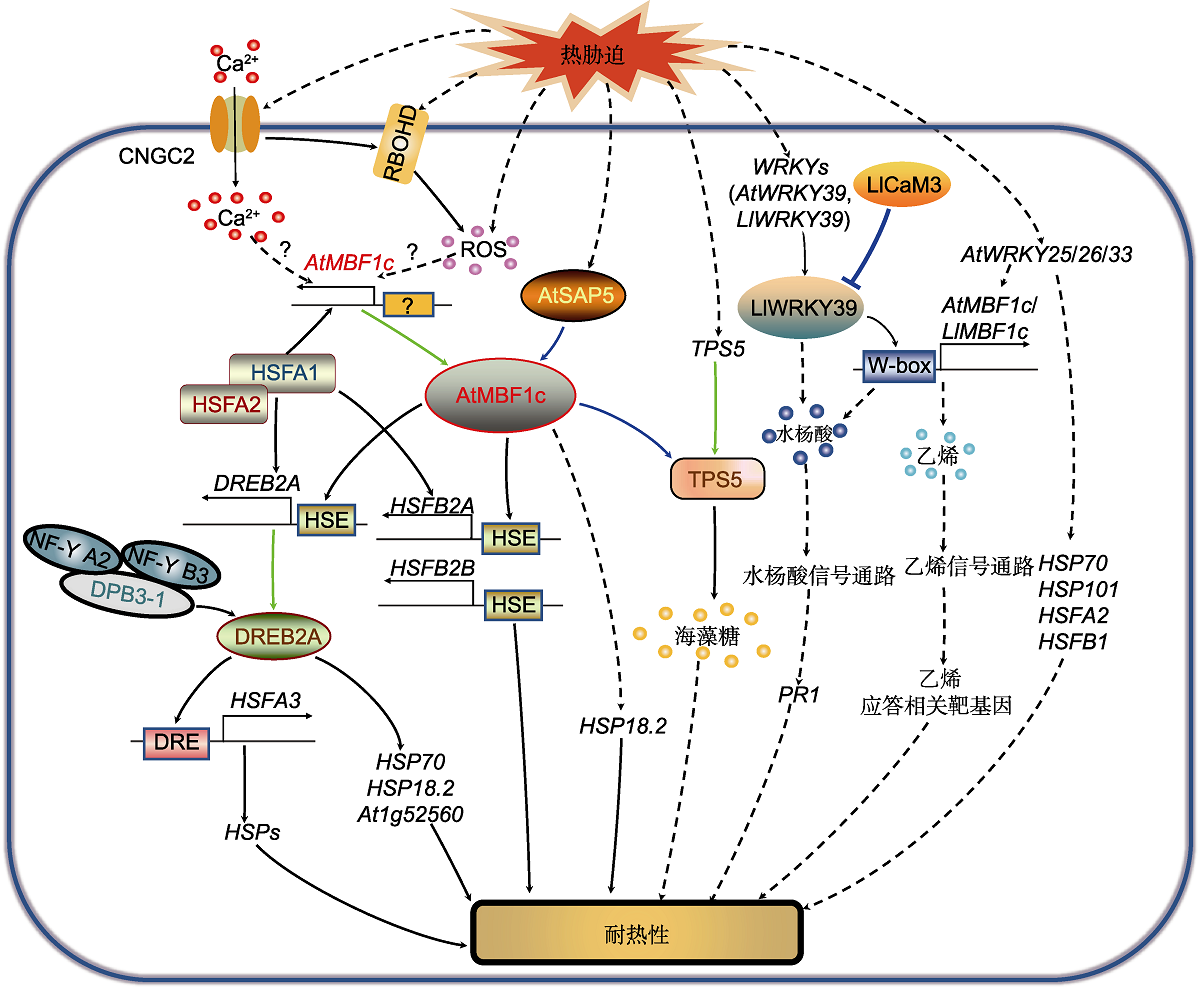 View image in article
图3
MBF1调控热胁迫应答信号通路
热胁迫通过激活质膜CNGC2引起Ca2+内流, 通过激活质膜结合的RBOHD导致ROS积累。而Ca2+信号和ROS信号通过未知途径激活AtMBF1c及其下游靶基因调节的热胁迫应答。热激转录因子HSFA1与HSFA2相互作用, 直接调控AtMBF1c、HSFA2、HSFBs和DREB2A的表达。同时, AtMBF1c通过与DREB2A、HSFB2A和HSFB2B的启动子HSE元件结合, 调控其基因表达, 提高热胁迫耐受性。DREB2A与DPB3-1、NF-Y A2和NF-Y B3形成的三聚体共激活复合物互作, 增强其对下游靶基因HSFA3的转录激活, 提高植物的耐热性。DREB2A也促进HSP70、HSP18.2和At1g52560的表达, 增强植株耐热性。AtSAP5作为上游调控因子与AtMBF1c发生互作并激活AtMBF1c, 调节细胞核中HSP18.2的表达, 提高植物耐热性。热胁迫诱导TPS5的表达, AtMBF1c与TPS5互作, 通过促进海藻糖的合成和积累提高耐热性。热胁迫诱导AtWRKY39、AtWRKY25、AtWRKY26和AtWRKY33的表达。AtWRKY39通过AtMBF1c调节水杨酸(SA)信号通路下游PR1基因表达, 提高耐热性。AtWRKY25、AtWRKY26和AtWRKY33通过AtMBF1c调节乙烯信号通路下游基因的表达提高耐热性, 同时通过促进HSP70、HSP101、HSFA2和HSFB1的表达提高耐热性。CNGC2: 环核苷酸门控离子通道2; DPB3-1 (NF-YC10): DNA聚合酶II亚基B3-1; DRE: 脱水应答元件; DREB2A: 干旱应答元件结合蛋白2A; HSE: 热休克响应元件; HSFA1/2/3: 热激转录因子A1/2/3; HSFB2A/B: 热激转录因子B2A/B; HSP18.2/70/101: 热激蛋白18.2/70/101; MBF1c: 多蛋白桥梁因子1c; NF-Y A2/B3: 核因子-Y A2/B3; PR1: 病程相关因子1; RBOHD: 呼吸爆发氧化同源蛋白D; ROS: 活性氧; SAP5: 胁迫相关蛋白5; TPS5: 海藻糖磷酸合成酶5。蓝色实线箭头表示蛋白互作; 绿色实线箭头表示基因编码蛋白; 黑色实线箭头表示直接转录激活; 黑色虚线箭头表示间接转录激活。
正文中引用本图/表的段落
AtMBF1c响应热胁迫引起的Ca2+和ROS信号, 激活其下游靶基因表达。热胁迫导致质膜(plasma membrane, PM)流动性增强, 激活定位于PM上的特定Ca2+通道——环核苷酸门控通道2 (cyclic nucleotide-gated channel 2, CNGC2), 引起Ca2+内流, 从而启动热胁迫信号转导(图3) (Finka et al., 2012; Gao et al., 2012; Mittler et al., 2012; Li et al., 2018; Sajid et al., 2018)。Ca2+通道介导的Ca2+内流也可以直接激活PM结合的NADPH氧化酶RBOHD, 导致ROS积累(Katano et al., 2018b)。胞内Ca2+浓度和ROS累积都可通过AtMBF1c激活下游靶基因调节的热胁迫应答, 但具体机制尚不清楚(图3) (Miller et al., 2009; Mittler et al., 2012; Katano et al., 2018b)。
热激转录因子(heat shock transcription factors, HSFs)家族的部分成员在AtMBF1c通路中发挥重要作用。HSFs是一类重要的热胁迫响应转录因子, 分为A、B和C三类, 通过与靶基因启动子中高度保守的HSE结合发挥作用。HSFA1是热胁迫转录激活网络中的基本调节因子, HSFA2位于HSFA1的下游, 两者之间通过很强的相互作用来调节热胁迫响应途径(图3) (Higashi et al., 2013; Ohama et al., 2017)。HSFA1可直接调控AtMBF1c、HSFA2、HSFBs和DREB2A (dehydration responsive element-binding protein 2A)等多个基因的表达, 进而提高植物的耐热性(Higashi et al., 2013; Ohama et al., 2017)。有意思的是, HSFB2A、HSFB2B和DREB2A是AtMBF1c的直接靶基因, AtMBF1c通过与DREB2A、HSFB2A和HSFB2B的启动子顺式作用元件结合, 调控其表达, 提高热胁迫的耐受性(Sakuma et al., 2006; Suzuki et al., 2011)。DREB2A是AP2/ERF (APETALA2/ ethylene-responsive element-binding factor, AP2/ ERF)转录因子家族成员, 参与干旱和热胁迫响应(Sakuma et al., 2006)。热胁迫能快速瞬时诱导DREB2A的表达, 过表达DREB2A导致热胁迫相关基因HSFA3、HSP70、HSP18.2和At1g52560 (CPsHSP)的表达水平升高, 植株耐热性增强; 而dreb2a突变体中HSFA3、HSP70、HSP18.2和At1g52560 (CPsHSP)的表达水平显著降低, 植物耐热性下降。DREB2A直接与下游HSFA3启动子的顺式作用元件DRE (dehydration-responsive element)结合, 促进HSFA3调控的一系列HSPs等热胁迫响应基因的表达, 提高耐热性(Schramm et al., 2008)。这表明DREB2A通过调节其下游HSFs和HSPs家族的多个成员的表达, 提高植物的耐热性(Sakuma et al., 2006)。此外, 在热胁迫条件下, DNA聚合酶II亚基3-1 (DNA polymerase II subunit B3-1, DPB3-1)、核因子-Y A2 (nuclear factor Y A2, NF-Y A2)和核因子-Y B3 (nuclear factor Y B3, NF-Y B3)形成三聚体共激活复合物(coactivator complex), 进而与DREB2A互作, 增强其转录激活活性, 促进其下游靶基因HSFA3的表达, 提高植物耐热性(Schramm et al., 2008; Yoshida et al., 2008; Sato et al., 2014; Ohama et al., 2017; Sajid et al., 2018)。
拟南芥胁迫相关蛋白5 (stress-associated protein 5, SAP5)作为AtMBF1c上游因子参与热应答调控(图3)。AtSAP5是AN1/A20-like Zinc finger (AN1/ A20-like ZnF)蛋白家族成员之一, 可调控多种胁迫应答基因的表达, 在调节植物应对各种非生物胁迫响应方面发挥重要作用(Hozain et al., 2012; Kim et al., 2015)。热胁迫条件下, AtSAP5在细胞核内与AtMBF1c发生互作并激活AtMBF1c, 调节细胞核中HSP18.2的表达, 提高植物耐热性(Kim et al., 2015; Jaimes-Miranda and Montes, 2020)。
细胞质定位的AtMBF1c参与调节海藻糖(trehalose)的积累(图3)。海藻糖是一种非还原性二糖, 在各种非生物胁迫条件下作为渗透保护剂在植物体内积累, 通过直接清除ROS增强植物耐受性(Avonce et al., 2004; Grennan, 2007)。海藻糖-6-磷酸合成酶(trehalose-6-phosphate synthase, TPS)是海藻糖生物合成途径中第1步催化合成海藻糖-6-磷酸(trehalose 6-phosphate, T6P)的关键酶。TPS5的表达受热胁迫诱导, 2个TPS5无义突变体(SALK_144791, tps5-1; SALK_007952, tps5-2)呈现基础性耐热(45°C)缺陷, 而非获得性耐热(38→45°C)缺陷(Suzuki et al., 2008)。酵母双杂交实验表明, AtMBF1c可能与TPS5互作。过表达AtMBF1c的转基因植株热应答过程中2个TPS基因(At2g18700和At1g70290)的转录水平升高, 海藻糖含量也显著上升。此外, 在水稻中过表达小麦TaMBF1c基因, 植株中2个OsTPSs (OsTPS7和OsTPS10)在热应答过程中转录水平均明显高于野生型植株(Qin et al., 2015)。这表明MBF1c通过与TPS5互作调节海藻糖代谢, 参与植物基础性耐热调控(Suzuki et al., 2005)。
AtMBF1c参与调控水杨酸(salicylic acid, SA)的积累, 有利于提高植物的耐热性(图3) (Larkindale et al., 2005; Suzuki et al., 2005, 2008)。多个WRKYs转录因子通过调节SA积累调控热应答(Eulgem and Somssich, 2007)。其中AtWRKY39受热诱导效应最显著, 其转录水平在热处理后1-2小时增加5.3倍, AtWRKY39过表达植株的耐热性显著高于野生型和wrky39突变体(SALK_073483c)植株(Li et al., 2010)。AtWRKY39过表达植株中AtMBF1c的表达量明显高于野生型, 而wrky39突变体中的AtMBF1c的表达量下降, 暗示AtMBF1c位于WRKYs下游发挥作用(Li et al., 2010)。此外, 酵母单杂交与凝胶阻滞实验(electrophoresis mobility-shift assay, EMSA)表明, 麝香百合(Lilium longiflorum) LlWRKY39通过与LlMBF1c启动子中的W-box元件结合激活LlMBF1c表达(Ding et al., 2021)。此过程中, 钙调蛋白LlCaM3通过与LlWRKY39互作, 抑制LlWRKY39对LlMBF1c的转录激活, 这可能是热胁迫响应(HSR)中LlMBF1c转录激活的重要反馈调节途径(Ding et al., 2021)。拟南芥mbf1c突变体在热应答过程中不能积累SA, 而外源施加SA可以拯救mbf1c突变体热敏感表型, 暗示AtMBF1c作用于SA的上游(Suzuki et al., 2008)。此外, SA信号通路中的下游基因PR1在AtWRKY39过表达植株中的表达量高于野生型, 在wrky39突变体中的表达量明显降低(Li et al., 2010), AtMBF1c过表达植株中PR1的表达量也明显升高(Suzuki et al., 2008)。有意思的是, 过表达AtMBF1c也响应引起多个WRKYs (AtWRKY18、AtWRKY33、AtWRKY40和AtWRKY46)转录本的积累, 其反馈调节机制有待进一步研究(Suzuki et al., 2005)。上述结果表明, AtMBF1c作为WRKYs信号通路的重要成员通过调节SA积累应答热胁迫。
AtMBF1c在乙烯调节的热应答过程中发挥作用 (图3) (Müller and Munné-Bosch, 2015)。研究表明, 拟南芥多个WRKY家族成员(AtWRKY25、AtWRKY26和AtWRKY33)通过乙烯信号通路参与植物热胁迫应答(Li et al., 2011)。AtWRKY25、AtWRKY26或AtWRKY33过表达拟南芥植株的耐热性增强, 同时热胁迫响应基因AtMBF1c、HSP70、HSP101、HSFA2和HSFB1的表达也增强。wrky25/wrky26和wrky25/wrky33双突变体, 以及wrky25/wrky26/ wrky33三突变体的热敏感性增强, 同时突变体中MBF1c的表达量下降。外源施加乙烯前体1-氨基环丙烷-1-羧酸(1-aminocyclopropane-1-carboxylic acid, ACC)可部分回补AtWRKY25、AtWRKY26和AtWRKY33单突变体、双突变体及三突变体的热敏感表型。这表明三者在耐热性方面表现出部分功能冗余性, 通过协同调节AtMBF1c介导的信号通路和乙烯依赖性响应提高拟南芥的耐热性(Li et al., 2011)。
此外, AtMBF1c可能参与ABA (abscisic acid)信号通路介导的热应答(图3)。热胁迫引起植物生理干旱, 热与缺水是自然条件下最常见的非生物胁迫组合之一(Mittler, 2006; De Boeck et al., 2016)。ABA通过调节气孔关闭和一系列下游基因表达调节植物的热应答(Suzuki et al., 2016)。研究表明, 与缺水胁迫或热胁迫单独处理相比, 两种胁迫同时处理导致ABA信号通路中关键调节基因ABI1的突变体abi1-1植株存活率显著下降, ABA含量升高, ABA响应基因表达量明显增加, AtMBF1c的蛋白质积累显著低于野生型(Zandalinas et al., 2016)。这表明AtMBF1c可能参与ABA信号通路介导的热应答过程, 其具体调节机制有待进一步研究。
(A) 植物MBF1的系统发育关系、基因结构和保守基序分布图.11个物种MBF1蛋白的全长蛋白质序列来自JGI数据库( Functional analysis of an Arabidopsis heat-shock transcription factor HsfA3 in the transcriptional cascade downstream of the DREB2A stress-regulatory system 1 2008 ... 热激转录因子(heat shock transcription factors, HSFs)家族的部分成员在AtMBF1c通路中发挥重要作用.HSFs是一类重要的热胁迫响应转录因子, 分为A、B和C三类, 通过与靶基因启动子中高度保守的HSE结合发挥作用.HSFA1是热胁迫转录激活网络中的基本调节因子, HSFA2位于HSFA1的下游, 两者之间通过很强的相互作用来调节热胁迫响应途径( StMBF1c positively regulates disease resistance to Ralstonia solanacearum via its primary and secondary upregulation combining expression of StTPS5 and resistance marker genes in potato 1 2021 ... Members of the MBF1 protein family in different plant species
本文的其它图/表
|