MBF1调控植物热应答与生长发育分子机制研究进展
秦怡, 刘艳爽, 仇柳柳, 周敏, 杜小杉, 戴绍军, 孙美红
植物学报
2022, 57 ( 1):
56-68.
DOI: 10.11983/CBB21220
MBF1是一种进化上高度保守的转录共激活因子, 存在于所有真核生物中, 可通过连接基础转录机器组分与转录因子来激活基因转录。植物MBF1具有多种重要生物学功能, 包括调控植物生长发育和逆境适应等。该文综述了植物MBF1分子结构与调控机制相关研究进展, 重点总结了AtMBF1c参与植物热胁迫应答调控的分子机制。
| 物种 | 拉丁名 | 蛋白名 | 蛋白编号(JGI数据库) | 参考文献 | | 拟南芥 | Arabidopsis thaliana | AtMBF1a | AT2G42680.1 | Tsuda et al., 2004 | | AtMBF1b | AT3G58680.1 | | AtMBF1c | AT3G24500.1 | | 番茄 | Solanum lycopersicum | SlMBF1a | Solyc10g007350.3.1 | Zhang et al., 2019 | | SlMBF1b | Solyc12g014290.2.1 | | SlMBF1c | Solyc07g062400.3.1 | | SlMBF1d | Solyc09g055470.1.1 | | SlER24 | Solyc01g104740.3.1 | | 水稻 | Oryza sativa | OsMBF1a | LOC_Os08g27850.1 | Zhang et al., 2019 | | OsMBF1c | LOC_Os06g39240.1 | | 菠菜 | Spinacia oleracea | SoMBF1b | Spov3_C0009.00073 | Xu et al., 2017 | | SoMBF1c | Spov3_C0062.00022 | | 马铃薯 | S. tuberosum | StMBF1a | PGSC0003DMP400012592 | Yu et al., 2021 | | StMBF1b | PGSC0003DMP400026892 | | StMBF1c | PGSC0003DMP400051869 | | StMBF1d | PGSC0003DMP400051868 | | 小麦 | Triticum aestivum | TaMBF1a-1 | Traes_2AL_A9D390619.1 | Qin et al., 2015; Tian et al., 2021 | | TaMBF1a-2 | Traes_2BL_4F31B5695.1 | | TaMBF1a-3 | Traes_2DL_D4AB94C53.1 | | TaMBF1a-4 | Traes_3AS_719D37CCA.1 | | TaMBF1a-5 | Traes_3B_EC2B74116.1 | | TaMBF1b | Traes_4DS_F1C77E7B0.1 | | TaMBF1c-7A | Traes_7AL_FA77CC1F41.1 | | TaMBF1c-7B | Traes_7BL_A002364C5.1 | | TaMBF1c-7C | Traes_7DL_D5AD8EB4B.1 | | 葡萄 | Vitis vinifera | VvMBF1a | VIT_212s0028g02020.1 | Yan et al., 2014 | | VvMBF1a-like | VIT_219s0014g01260.1 | | VvMBF1c | VIT_211s0016g04080.1 | | 大豆 | Glycine max | GmMBF1a-1 | Glyma.06G276200.1.p | Tsuda et al., 2004 | | GmMBF1a-2 | Glyma.06G276300.1.p | | GmMBF1a-3 | Glyma.12G129100.1.p | | 玉米 | Zea mays | ZmMBF1a | ZmPHB47.01G345100.1.p | Tsuda et al., 2004 | | ZmMBF1b | ZmPHB47.04G054300.1.p | | ZmMBF1c | ZmPHB47.09G119100.1.p | | 蓖麻 | Ricinus communis | RcMBF1b | 27894.m000799 | Tsuda et al., 2004 | | RcMBF1c | 29912.m005549 | | 蒺藜苜蓿 | Medicago truncatula | MtMBF1b-1 | Medtr2g084220.1 | Tsuda et al., 2004 | | MtMBF1b-2 | Medtr4g080090.1 | | MtMBF1b-3 | Medtr6g018330.1 | | MtMBF1c | Medtr6g086280.1 |
View table in article
表1
不同植物物种中MBF1蛋白家族成员
正文中引用本图/表的段落
MBF1 (multiprotein bridging factor 1)家族是一个在进化上高度保守的转录共激活因子家族, 属于HTH超家族(helix-turn-helix superfamily) (Jaimes-Miranda and Montes, 2020)。编码MBF1的cDNA首次在家蚕(Bombyx mori)后部丝腺中被克隆到(Takemaru et al., 1997), 随后在所有真核生物中都鉴定到了其同源基因。对真菌、昆虫、酵母以及拟南芥(Arabidopsis thaliana)和人(Homo sapiens)的研究表明, MBF1可以将通用转录因子TATA-box结合蛋白(TATA-box binding protein, TBP)与多种转录因子桥接(bridging), 从而激活基因转录(Takemaru et al., 1997, 1998; Busk et al., 2003; Tsuda et al., 2004; Song et al., 2015)。与真菌和动物的MBF1不同, 植物MBF1能直接与DNA结合, 推测MBF1c的DNA结合元件为CTAGA (Suzuki et al., 2011)。MBF1可以提高植物对多种非生物胁迫(热、盐、干旱、渗透和氧化胁迫)的耐受性(Suzuki et al., 2005; Yan et al., 2014; Wang et al., 2017; Katano et al., 2018a; Zou et al., 2019), 增强植物对病原菌侵染的防御能力(Godoy et al., 2001; Wang et al., 2019), 调节植物激素响应和种子萌发过程(Di Mauro et al., 2012; Zandalinas et al., 2016)。大量研究聚焦MBF1的热应答功能, 发现MBF1c是调控植物耐热性的关键调节因子(Ohama et al., 2017; Jaimes-Miranda and Montes, 2020)。本文综述了植物MBF1进化特征、分子结构和胁迫应答作用机制相关研究进展, 重点总结了MBF1c对热信号感知与信号转导通路的调节作用。
利用JGI数据库(https://phytozome-next.jgi.doe.gov/) 对11种已有功能研究报道的高等维管植物中的MBF1蛋白序列信息进行Blast分析, 共获得40种MBF1蛋白(表1)。对40种MBF1蛋白进行系统进化分析, 表明这些蛋白质分为2类(图1A): I类含有27种MBF1, 包括15种MBF1a、10种MBF1b、1种MBF1c (SlMBF1c)和1种MBF1d (SlMBF1d); II类含有13种MBF1, 包括11种MBF1c、1种MBF1d (StMBF1d)和1种SlER24。
(A) 植物MBF1的系统发育关系、基因结构和保守基序分布图。11个物种MBF1蛋白的全长蛋白质序列来自JGI数据库(https:// phytozome-next.jgi.doe.gov/) (表1)。用MEGA7.0软件基于邻接法构建同源系统进化树, 绿色背景表示I类MBF1蛋白亚家族, 红色背景表示II类MBF1蛋白亚家族。利用GSDS2.0软件(http://gsds.cbi.pku.edu.cn/)在线绘制基因结构图, 上游5'非编码区/下游3'非编码区用蓝色方框表示, 外显子用黄色方框表示, 内含子用黑色直线显示。使用MEME网站(https://meme-suite.org/meme/ tools/meme)在线预测保守基序。通过NCBI网站CDD数据库(https://www.ncbi.nlm.nih.gov/cdd)鉴定蛋白质序列的保守结构域及功能。利用Tbtools软件绘制保守基序分布图, 5个保守基序用不同颜色方框表示。(B) 11个物种MBF1蛋白中预测到的保守基序序列。
基因结构分析表明, I类MBF1成员中, 除TaMBF1b和SlMBF1d只有1个外显子外, 其它成员都含有3-4个外显子; II类MBF1成员没有内含子或者只有1个内含子(MtMBF1c) (图1A)。拟南芥有3个MBF1基因, 即AtMBF1a、AtMBF1b和AtMBF1c。AtMBF1a和AtMBF1b基因结构相似, 均包含3个内含子和4个外显子, 属于I类MBF1; 而AtMBF1c没有内含子, 属于II类MBF1 (Tsuda and Yamazaki, 2004)。对这些蛋白质的保守基序分析表明, 多数I类MBF1成员含有4个基序(基序1-4), 而TaMBF1b只含有2个基序(基序1和3); II类MBF1成员在含有I类基序(3个或4个)的基础上, 在N端还含有1个基序5 (图1)。
通过对酿酒酵母(Saccharomyces cerevisiae)的yMBF1、家蚕的BmMBF1、拟南芥的3个AtMBF1s, 以及水稻(Oryza sativa)的2个OsMBF1s进行氨基酸序列比对, 我们发现从酵母到高等动、植物中的MBF1在进化上均高度保守(表1; 图2) (Takemaru et al., 1997, 1998; Tsuda et al., 2004; Zhang et al., 2019)。功能结构域分析表明, 真核生物MBF1都包含1个保守的N-端结构域MBF1-N和1个保守的C-端结构域HTH_3 (Ozaki et al., 1999; Blombach et al., 2014; Jaimes-Miranda and Montes, 2020)。MBF1-N是与其它转录激活因子结合的区域, HTH_3是与TBP结合的区域(Ozaki et al., 1999; Blombach et al., 2014; Jaimes-Miranda and Montes, 2020)。其中, Motif1和Motif4属于HTH_3结构域, 保守基序Motif2和Motif3属于MBF1-N结构域, 而Motif5只出现在II类MBF1的N端。
家蚕BmMBF1和酿酒酵母yMBF1蛋白质序列从Ensembl数据库(https://ensemblgenomes.org/)下载, 蛋白编号分别为BGIBMGA 007702和YOR298C-A。利用DNAMAN软件对蛋白序列进行比对。紫色框表示N端MBF1结构域, 蓝色框表示C端HTH_3结构域。拟南芥和水稻MBF1蛋白质序列及蛋白编号见表1。
拟南芥含有3个AtMBF1s (AtMBF1a、AtMBF1b和AtMBF1c) (Tsuda et al., 2004)。3个AtMBF1s都能回补酵母yMBF1突变体对3-氨基-1,2,4-三唑(3- aminotriazole, 3-AT)敏感的表型, 这表明AtMBF1s参与转录因子GCN4 (general control nonderepressible 4)依赖的HIS3基因的激活(Tsuda et al., 2004)。3个AtMBF1s的功能不完全相同, AtMBF1a和AtMBF1b主要参与植物生长发育调控, 而AtMBF1c是热胁迫信号转导过程中的关键调控因子, 通过调节不同热胁迫响应基因表达提高植物的耐热性(Tsuda and Yamazaki, 2004; Gong et al., 2020)。正常条件下, 定位于细胞质的AtMBF1c受热胁迫迅速在细胞核中积累。因此, AtMBF1c可能介导了热胁迫信号由细胞质向细胞核的传递(Suzuki et al., 2008)。研究发现, AtMBF1c启动子区含多个热休克响应元件(heat shock element, HSE)和其它胁迫响应元件(Qin et al., 2015; Zou et al., 2019), 能够受热胁迫的快速诱导。过表达AtMBF1c拟南芥幼苗的基础耐热性(45°C, 2小时)明显高于野生型(wild type) (Suzuki et al., 2005); 而AtMBF1c敲除突变体mbf1c (SALK_083813)表现出基础耐热性缺陷表型, 在mbf1c中低水平过表达AtMBF1c可回补其热敏感表型(Suzuki et al., 2008)。此外, 将芥蓝(Brassica oleracea var. chinensis) BocMBF1c在拟南芥中过表达, 可明显提高植株的耐热性(Zou et al., 2019)。番茄(Solanum lycopersicum)中有5个SlMBF1蛋白(SlMBF1a、SlMBF1b、SlMBF1c、SlMBF1d和SlER24) (Zhang et al., 2019), 其中SlMBF1c对番茄花粉耐热性起正调控作用(Jegadeesan et al., 2018)。
热胁迫通过激活质膜CNGC2引起Ca2+内流, 通过激活质膜结合的RBOHD导致ROS积累。而Ca2+信号和ROS信号通过未知途径激活AtMBF1c及其下游靶基因调节的热胁迫应答。热激转录因子HSFA1与HSFA2相互作用, 直接调控AtMBF1c、HSFA2、HSFBs和DREB2A的表达。同时, AtMBF1c通过与DREB2A、HSFB2A和HSFB2B的启动子HSE元件结合, 调控其基因表达, 提高热胁迫耐受性。DREB2A与DPB3-1、NF-Y A2和NF-Y B3形成的三聚体共激活复合物互作, 增强其对下游靶基因HSFA3的转录激活, 提高植物的耐热性。DREB2A也促进HSP70、HSP18.2和At1g52560的表达, 增强植株耐热性。AtSAP5作为上游调控因子与AtMBF1c发生互作并激活AtMBF1c, 调节细胞核中HSP18.2的表达, 提高植物耐热性。热胁迫诱导TPS5的表达, AtMBF1c与TPS5互作, 通过促进海藻糖的合成和积累提高耐热性。热胁迫诱导AtWRKY39、AtWRKY25、AtWRKY26和AtWRKY33的表达。AtWRKY39通过AtMBF1c调节水杨酸(SA)信号通路下游PR1基因表达, 提高耐热性。AtWRKY25、AtWRKY26和AtWRKY33通过AtMBF1c调节乙烯信号通路下游基因的表达提高耐热性, 同时通过促进HSP70、HSP101、HSFA2和HSFB1的表达提高耐热性。CNGC2: 环核苷酸门控离子通道2; DPB3-1 (NF-YC10): DNA聚合酶II亚基B3-1; DRE: 脱水应答元件; DREB2A: 干旱应答元件结合蛋白2A; HSE: 热休克响应元件; HSFA1/2/3: 热激转录因子A1/2/3; HSFB2A/B: 热激转录因子B2A/B; HSP18.2/70/101: 热激蛋白18.2/70/101; MBF1c: 多蛋白桥梁因子1c; NF-Y A2/B3: 核因子-Y A2/B3; PR1: 病程相关因子1; RBOHD: 呼吸爆发氧化同源蛋白D; ROS: 活性氧; SAP5: 胁迫相关蛋白5; TPS5: 海藻糖磷酸合成酶5。蓝色实线箭头表示蛋白互作; 绿色实线箭头表示基因编码蛋白; 黑色实线箭头表示直接转录激活; 黑色虚线箭头表示间接转录激活。
细胞质定位的AtMBF1c参与调节海藻糖(trehalose)的积累(图3)。海藻糖是一种非还原性二糖, 在各种非生物胁迫条件下作为渗透保护剂在植物体内积累, 通过直接清除ROS增强植物耐受性(Avonce et al., 2004; Grennan, 2007)。海藻糖-6-磷酸合成酶(trehalose-6-phosphate synthase, TPS)是海藻糖生物合成途径中第1步催化合成海藻糖-6-磷酸(trehalose 6-phosphate, T6P)的关键酶。TPS5的表达受热胁迫诱导, 2个TPS5无义突变体(SALK_144791, tps5-1; SALK_007952, tps5-2)呈现基础性耐热(45°C)缺陷, 而非获得性耐热(38→45°C)缺陷(Suzuki et al., 2008)。酵母双杂交实验表明, AtMBF1c可能与TPS5互作。过表达AtMBF1c的转基因植株热应答过程中2个TPS基因(At2g18700和At1g70290)的转录水平升高, 海藻糖含量也显著上升。此外, 在水稻中过表达小麦TaMBF1c基因, 植株中2个OsTPSs (OsTPS7和OsTPS10)在热应答过程中转录水平均明显高于野生型植株(Qin et al., 2015)。这表明MBF1c通过与TPS5互作调节海藻糖代谢, 参与植物基础性耐热调控(Suzuki et al., 2005)。
AtMBF1c参与调控水杨酸(salicylic acid, SA)的积累, 有利于提高植物的耐热性(图3) (Larkindale et al., 2005; Suzuki et al., 2005, 2008)。多个WRKYs转录因子通过调节SA积累调控热应答(Eulgem and Somssich, 2007)。其中AtWRKY39受热诱导效应最显著, 其转录水平在热处理后1-2小时增加5.3倍, AtWRKY39过表达植株的耐热性显著高于野生型和wrky39突变体(SALK_073483c)植株(Li et al., 2010)。AtWRKY39过表达植株中AtMBF1c的表达量明显高于野生型, 而wrky39突变体中的AtMBF1c的表达量下降, 暗示AtMBF1c位于WRKYs下游发挥作用(Li et al., 2010)。此外, 酵母单杂交与凝胶阻滞实验(electrophoresis mobility-shift assay, EMSA)表明, 麝香百合(Lilium longiflorum) LlWRKY39通过与LlMBF1c启动子中的W-box元件结合激活LlMBF1c表达(Ding et al., 2021)。此过程中, 钙调蛋白LlCaM3通过与LlWRKY39互作, 抑制LlWRKY39对LlMBF1c的转录激活, 这可能是热胁迫响应(HSR)中LlMBF1c转录激活的重要反馈调节途径(Ding et al., 2021)。拟南芥mbf1c突变体在热应答过程中不能积累SA, 而外源施加SA可以拯救mbf1c突变体热敏感表型, 暗示AtMBF1c作用于SA的上游(Suzuki et al., 2008)。此外, SA信号通路中的下游基因PR1在AtWRKY39过表达植株中的表达量高于野生型, 在wrky39突变体中的表达量明显降低(Li et al., 2010), AtMBF1c过表达植株中PR1的表达量也明显升高(Suzuki et al., 2008)。有意思的是, 过表达AtMBF1c也响应引起多个WRKYs (AtWRKY18、AtWRKY33、AtWRKY40和AtWRKY46)转录本的积累, 其反馈调节机制有待进一步研究(Suzuki et al., 2005)。上述结果表明, AtMBF1c作为WRKYs信号通路的重要成员通过调节SA积累应答热胁迫。
AtMBF1c在乙烯调节的热应答过程中发挥作用 (图3) (Müller and Munné-Bosch, 2015)。研究表明, 拟南芥多个WRKY家族成员(AtWRKY25、AtWRKY26和AtWRKY33)通过乙烯信号通路参与植物热胁迫应答(Li et al., 2011)。AtWRKY25、AtWRKY26或AtWRKY33过表达拟南芥植株的耐热性增强, 同时热胁迫响应基因AtMBF1c、HSP70、HSP101、HSFA2和HSFB1的表达也增强。wrky25/wrky26和wrky25/wrky33双突变体, 以及wrky25/wrky26/ wrky33三突变体的热敏感性增强, 同时突变体中MBF1c的表达量下降。外源施加乙烯前体1-氨基环丙烷-1-羧酸(1-aminocyclopropane-1-carboxylic acid, ACC)可部分回补AtWRKY25、AtWRKY26和AtWRKY33单突变体、双突变体及三突变体的热敏感表型。这表明三者在耐热性方面表现出部分功能冗余性, 通过协同调节AtMBF1c介导的信号通路和乙烯依赖性响应提高拟南芥的耐热性(Li et al., 2011)。
此外, AtMBF1c可能参与ABA (abscisic acid)信号通路介导的热应答(图3)。热胁迫引起植物生理干旱, 热与缺水是自然条件下最常见的非生物胁迫组合之一(Mittler, 2006; De Boeck et al., 2016)。ABA通过调节气孔关闭和一系列下游基因表达调节植物的热应答(Suzuki et al., 2016)。研究表明, 与缺水胁迫或热胁迫单独处理相比, 两种胁迫同时处理导致ABA信号通路中关键调节基因ABI1的突变体abi1-1植株存活率显著下降, ABA含量升高, ABA响应基因表达量明显增加, AtMBF1c的蛋白质积累显著低于野生型(Zandalinas et al., 2016)。这表明AtMBF1c可能参与ABA信号通路介导的热应答过程, 其具体调节机制有待进一步研究。
为了探明AtMBF1s对种子萌发的影响, Di Mauro等(2012)分别获得了拟南芥3个AtMBF1s基因的knock-down三突变体(abc-), 以及AtMBF1c回补突变体abc-的植株(abc-+c)。在未春化条件下, abc-突变体种子萌发率降低, 而abc-+c种子可以恢复到野生型的萌发率水平。外源添加ABA时, abc-突变体种子的萌发率显著低于野生型, 而abc-+c种子萌发率与野生型相似; 外源添加乙烯前体ACC时, ACC对abc-突变体种子萌发的促进作用弱于野生型和abc-+c回补株系, 并且ACC可以部分减弱ABA对野生型种子萌发的抑制效果。这表明AtMBF1c通过正调节乙烯信号来负调节ABA依赖的种子萌发抑制过程(Di Mauro et al., 2012)。
乙烯反应元件结合因子相关的双亲性抑制基序(ethylene-responsive element-binding associated amphiphilic repression, EAR)可以抑制其融合蛋白的表达。利用EAR的这一特性, Hommel等(2008)将EAR分别与拟南芥AtMBF1c及其在番茄中的同源基因SlER24融合, 结果表明, 拟南芥AtMBF1c-EAR融合蛋白可以引起种子萌发率降低、植株矮化; 番茄SlER24-EAR融合蛋白也会导致种子萌发延迟(Hommel et al., 2008)。这表明AtMBF1c和SlER24对植物种子萌发具有正调控作用。此外, 在种子萌发过程中, AtMBF1s调节其对渗透胁迫的耐受性(Arce et al., 2010)。在正常生长和胁迫条件下, 拟南芥AtMBF1s通过调节ABR1 (AP2-like ABA repressor 1)的表达影响胁迫条件下的种子萌发。ABR1是ABA的阻遏因子, 其缺失可以引起种子萌发和根生长对ABA高度敏感, 并导致拟南芥幼苗对渗透胁迫的超敏反应, 这表明AtMBF1s可能作为ABA、乙烯和胁迫信号通路间相互作用的调节元件, 在拟南芥种子萌发与早期发育过程中发挥重要作用(Pandey et al., 2005; Arce et al., 2010)。
植物MBF1s是重要的转录共激活因子, 两类MBF1s在基因结构、表达模式以及生物学功能上存在显著差异。I类MBF1s (MBF1a和MBF1b)主要调控植物生长发育, 但其分子调控机理目前还不清楚(Tsuda and Yamazaki, 2004)。II类MBF1s参与多种胁迫应答调控, 其中MBF1c参与植物热应答过程, 胞内Ca2+信号通路和ROS信号通路激活MBF1c及其下游靶基因表达, 但不同信号的激活是否存在特异性调控或者通路整合有待深入研究。
在热应答过程中, MBF1c可从细胞质向细胞核内转运, 转录因子直接结合HSFs和DREB2A基因的启动子并促进其表达, 但其转运机制并不清楚。今后, 利用RNA测序(RNA sequences, RNA-seq)和染色质免疫沉淀测序(chromatin immunoprecipitation sequencing, ChIP-seq), 并结合生物信息学分析, 发掘受MBF1调控的下游靶基因, 对于深入认识MBF1调控的下游通路十分必要。
此外, 对不同物种中MBF1同源基因的研究表明, 植物MBF1s参与盐、干旱、氧化和冷胁迫等多种非生物胁迫应答, 在这些胁迫应答过程中MBF1的具体靶基因和调控的分子机制也有待进一步研究。
(A) 植物MBF1的系统发育关系、基因结构和保守基序分布图.11个物种MBF1蛋白的全长蛋白质序列来自JGI数据库(https:// phytozome-next.jgi.doe.gov/) (表1).用MEGA7.0软件基于邻接法构建同源系统进化树, 绿色背景表示I类MBF1蛋白亚家族, 红色背景表示II类MBF1蛋白亚家族.利用GSDS2.0软件(http://gsds.cbi.pku.edu.cn/)在线绘制基因结构图, 上游5'非编码区/下游3'非编码区用蓝色方框表示, 外显子用黄色方框表示, 内含子用黑色直线显示.使用MEME网站(https://meme-suite.org/meme/ tools/meme)在线预测保守基序.通过NCBI网站CDD数据库(https://www.ncbi.nlm.nih.gov/cdd)鉴定蛋白质序列的保守结构域及功能.利用Tbtools软件绘制保守基序分布图, 5个保守基序用不同颜色方框表示.(B) 11个物种MBF1蛋白中预测到的保守基序序列. ...
(A) 植物MBF1的系统发育关系、基因结构和保守基序分布图.11个物种MBF1蛋白的全长蛋白质序列来自JGI数据库(https:// phytozome-next.jgi.doe.gov/) (表1).用MEGA7.0软件基于邻接法构建同源系统进化树, 绿色背景表示I类MBF1蛋白亚家族, 红色背景表示II类MBF1蛋白亚家族.利用GSDS2.0软件(http://gsds.cbi.pku.edu.cn/)在线绘制基因结构图, 上游5'非编码区/下游3'非编码区用蓝色方框表示, 外显子用黄色方框表示, 内含子用黑色直线显示.使用MEME网站(https://meme-suite.org/meme/ tools/meme)在线预测保守基序.通过NCBI网站CDD数据库(https://www.ncbi.nlm.nih.gov/cdd)鉴定蛋白质序列的保守结构域及功能.利用Tbtools软件绘制保守基序分布图, 5个保守基序用不同颜色方框表示.(B) 11个物种MBF1蛋白中预测到的保守基序序列. ... Three Arabidopsis MBF1 homologs with distinct expression profiles play roles as transcriptional co-activators 9 2004 ... MBF1 (multiprotein bridging factor 1)家族是一个在进化上高度保守的转录共激活因子家族, 属于HTH超家族(helix-turn-helix superfamily) (Jaimes-Miranda and Montes, 2020).编码MBF1的cDNA首次在家蚕(Bombyx mori)后部丝腺中被克隆到(Takemaru et al., 1997), 随后在所有真核生物中都鉴定到了其同源基因.对真菌、昆虫、酵母以及拟南芥(Arabidopsis thaliana)和人(Homo sapiens)的研究表明, MBF1可以将通用转录因子TATA-box结合蛋白(TATA-box binding protein, TBP)与多种转录因子桥接(bridging), 从而激活基因转录(Takemaru et al., 1997, 1998; Busk et al., 2003; Tsuda et al., 2004; Song et al., 2015).与真菌和动物的MBF1不同, 植物MBF1能直接与DNA结合, 推测MBF1c的DNA结合元件为CTAGA (Suzuki et al., 2011).MBF1可以提高植物对多种非生物胁迫(热、盐、干旱、渗透和氧化胁迫)的耐受性(Suzuki et al., 2005; Yan et al., 2014; Wang et al., 2017; Katano et al., 2018a; Zou et al., 2019), 增强植物对病原菌侵染的防御能力(Godoy et al., 2001; Wang et al., 2019), 调节植物激素响应和种子萌发过程(Di Mauro et al., 2012; Zandalinas et al., 2016).大量研究聚焦MBF1的热应答功能, 发现MBF1c是调控植物耐热性的关键调节因子(Ohama et al., 2017; Jaimes-Miranda and Montes, 2020).本文综述了植物MBF1进化特征、分子结构和胁迫应答作用机制相关研究进展, 重点总结了MBF1c对热信号感知与信号转导通路的调节作用. ...
(A) 植物MBF1的系统发育关系、基因结构和保守基序分布图.11个物种MBF1蛋白的全长蛋白质序列来自JGI数据库(https:// phytozome-next.jgi.doe.gov/) (表1).用MEGA7.0软件基于邻接法构建同源系统进化树, 绿色背景表示I类MBF1蛋白亚家族, 红色背景表示II类MBF1蛋白亚家族.利用GSDS2.0软件(http://gsds.cbi.pku.edu.cn/)在线绘制基因结构图, 上游5'非编码区/下游3'非编码区用蓝色方框表示, 外显子用黄色方框表示, 内含子用黑色直线显示.使用MEME网站(https://meme-suite.org/meme/ tools/meme)在线预测保守基序.通过NCBI网站CDD数据库(https://www.ncbi.nlm.nih.gov/cdd)鉴定蛋白质序列的保守结构域及功能.利用Tbtools软件绘制保守基序分布图, 5个保守基序用不同颜色方框表示.(B) 11个物种MBF1蛋白中预测到的保守基序序列. ...
(A) 植物MBF1的系统发育关系、基因结构和保守基序分布图.11个物种MBF1蛋白的全长蛋白质序列来自JGI数据库(https:// phytozome-next.jgi.doe.gov/) (表1).用MEGA7.0软件基于邻接法构建同源系统进化树, 绿色背景表示I类MBF1蛋白亚家族, 红色背景表示II类MBF1蛋白亚家族.利用GSDS2.0软件(http://gsds.cbi.pku.edu.cn/)在线绘制基因结构图, 上游5'非编码区/下游3'非编码区用蓝色方框表示, 外显子用黄色方框表示, 内含子用黑色直线显示.使用MEME网站(https://meme-suite.org/meme/ tools/meme)在线预测保守基序.通过NCBI网站CDD数据库(https://www.ncbi.nlm.nih.gov/cdd)鉴定蛋白质序列的保守结构域及功能.利用Tbtools软件绘制保守基序分布图, 5个保守基序用不同颜色方框表示.(B) 11个物种MBF1蛋白中预测到的保守基序序列. ...
(A) 植物MBF1的系统发育关系、基因结构和保守基序分布图.11个物种MBF1蛋白的全长蛋白质序列来自JGI数据库(https:// phytozome-next.jgi.doe.gov/) (表1).用MEGA7.0软件基于邻接法构建同源系统进化树, 绿色背景表示I类MBF1蛋白亚家族, 红色背景表示II类MBF1蛋白亚家族.利用GSDS2.0软件(http://gsds.cbi.pku.edu.cn/)在线绘制基因结构图, 上游5'非编码区/下游3'非编码区用蓝色方框表示, 外显子用黄色方框表示, 内含子用黑色直线显示.使用MEME网站(https://meme-suite.org/meme/ tools/meme)在线预测保守基序.通过NCBI网站CDD数据库(https://www.ncbi.nlm.nih.gov/cdd)鉴定蛋白质序列的保守结构域及功能.利用Tbtools软件绘制保守基序分布图, 5个保守基序用不同颜色方框表示.(B) 11个物种MBF1蛋白中预测到的保守基序序列. ...
(A) 植物MBF1的系统发育关系、基因结构和保守基序分布图.11个物种MBF1蛋白的全长蛋白质序列来自JGI数据库(https:// phytozome-next.jgi.doe.gov/) (表1).用MEGA7.0软件基于邻接法构建同源系统进化树, 绿色背景表示I类MBF1蛋白亚家族, 红色背景表示II类MBF1蛋白亚家族.利用GSDS2.0软件(http://gsds.cbi.pku.edu.cn/)在线绘制基因结构图, 上游5'非编码区/下游3'非编码区用蓝色方框表示, 外显子用黄色方框表示, 内含子用黑色直线显示.使用MEME网站(https://meme-suite.org/meme/ tools/meme)在线预测保守基序.通过NCBI网站CDD数据库(https://www.ncbi.nlm.nih.gov/cdd)鉴定蛋白质序列的保守结构域及功能.利用Tbtools软件绘制保守基序分布图, 5个保守基序用不同颜色方框表示.(B) 11个物种MBF1蛋白中预测到的保守基序序列. ...
(A) 植物MBF1的系统发育关系、基因结构和保守基序分布图.11个物种MBF1蛋白的全长蛋白质序列来自JGI数据库(https:// phytozome-next.jgi.doe.gov/) (表1).用MEGA7.0软件基于邻接法构建同源系统进化树, 绿色背景表示I类MBF1蛋白亚家族, 红色背景表示II类MBF1蛋白亚家族.利用GSDS2.0软件(http://gsds.cbi.pku.edu.cn/)在线绘制基因结构图, 上游5'非编码区/下游3'非编码区用蓝色方框表示, 外显子用黄色方框表示, 内含子用黑色直线显示.使用MEME网站(https://meme-suite.org/meme/ tools/meme)在线预测保守基序.通过NCBI网站CDD数据库(https://www.ncbi.nlm.nih.gov/cdd)鉴定蛋白质序列的保守结构域及功能.利用Tbtools软件绘制保守基序分布图, 5个保守基序用不同颜色方框表示.(B) 11个物种MBF1蛋白中预测到的保守基序序列. ...
(A) 植物MBF1的系统发育关系、基因结构和保守基序分布图.11个物种MBF1蛋白的全长蛋白质序列来自JGI数据库(https:// phytozome-next.jgi.doe.gov/) (表1).用MEGA7.0软件基于邻接法构建同源系统进化树, 绿色背景表示I类MBF1蛋白亚家族, 红色背景表示II类MBF1蛋白亚家族.利用GSDS2.0软件(http://gsds.cbi.pku.edu.cn/)在线绘制基因结构图, 上游5'非编码区/下游3'非编码区用蓝色方框表示, 外显子用黄色方框表示, 内含子用黑色直线显示.使用MEME网站(https://meme-suite.org/meme/ tools/meme)在线预测保守基序.通过NCBI网站CDD数据库(https://www.ncbi.nlm.nih.gov/cdd)鉴定蛋白质序列的保守结构域及功能.利用Tbtools软件绘制保守基序分布图, 5个保守基序用不同颜色方框表示.(B) 11个物种MBF1蛋白中预测到的保守基序序列. ... The grape VvMBF1 gene improves drought stress tolerance in transgenic Arabidopsis thaliana 2 2014 ... MBF1 (multiprotein bridging factor 1)家族是一个在进化上高度保守的转录共激活因子家族, 属于HTH超家族(helix-turn-helix superfamily) (Jaimes-Miranda and Montes, 2020).编码MBF1的cDNA首次在家蚕(Bombyx mori)后部丝腺中被克隆到(Takemaru et al., 1997), 随后在所有真核生物中都鉴定到了其同源基因.对真菌、昆虫、酵母以及拟南芥(Arabidopsis thaliana)和人(Homo sapiens)的研究表明, MBF1可以将通用转录因子TATA-box结合蛋白(TATA-box binding protein, TBP)与多种转录因子桥接(bridging), 从而激活基因转录(Takemaru et al., 1997, 1998; Busk et al., 2003; Tsuda et al., 2004; Song et al., 2015).与真菌和动物的MBF1不同, 植物MBF1能直接与DNA结合, 推测MBF1c的DNA结合元件为CTAGA (Suzuki et al., 2011).MBF1可以提高植物对多种非生物胁迫(热、盐、干旱、渗透和氧化胁迫)的耐受性(Suzuki et al., 2005; Yan et al., 2014; Wang et al., 2017; Katano et al., 2018a; Zou et al., 2019), 增强植物对病原菌侵染的防御能力(Godoy et al., 2001; Wang et al., 2019), 调节植物激素响应和种子萌发过程(Di Mauro et al., 2012; Zandalinas et al., 2016).大量研究聚焦MBF1的热应答功能, 发现MBF1c是调控植物耐热性的关键调节因子(Ohama et al., 2017; Jaimes-Miranda and Montes, 2020).本文综述了植物MBF1进化特征、分子结构和胁迫应答作用机制相关研究进展, 重点总结了MBF1c对热信号感知与信号转导通路的调节作用. ...
(A) 植物MBF1的系统发育关系、基因结构和保守基序分布图.11个物种MBF1蛋白的全长蛋白质序列来自JGI数据库(https:// phytozome-next.jgi.doe.gov/) (表1).用MEGA7.0软件基于邻接法构建同源系统进化树, 绿色背景表示I类MBF1蛋白亚家族, 红色背景表示II类MBF1蛋白亚家族.利用GSDS2.0软件(http://gsds.cbi.pku.edu.cn/)在线绘制基因结构图, 上游5'非编码区/下游3'非编码区用蓝色方框表示, 外显子用黄色方框表示, 内含子用黑色直线显示.使用MEME网站(https://meme-suite.org/meme/ tools/meme)在线预测保守基序.通过NCBI网站CDD数据库(https://www.ncbi.nlm.nih.gov/cdd)鉴定蛋白质序列的保守结构域及功能.利用Tbtools软件绘制保守基序分布图, 5个保守基序用不同颜色方框表示.(B) 11个物种MBF1蛋白中预测到的保守基序序列. ... Functional analysis of an Arabidopsis heat-shock transcription factor HsfA3 in the transcriptional cascade downstream of the DREB2A stress-regulatory system 1 2008 ... 热激转录因子(heat shock transcription factors, HSFs)家族的部分成员在AtMBF1c通路中发挥重要作用.HSFs是一类重要的热胁迫响应转录因子, 分为A、B和C三类, 通过与靶基因启动子中高度保守的HSE结合发挥作用.HSFA1是热胁迫转录激活网络中的基本调节因子, HSFA2位于HSFA1的下游, 两者之间通过很强的相互作用来调节热胁迫响应途径(图3) (Higashi et al., 2013; Ohama et al., 2017).HSFA1可直接调控AtMBF1c、HSFA2、HSFBs和DREB2A (dehydration responsive element-binding protein 2A)等多个基因的表达, 进而提高植物的耐热性(Higashi et al., 2013; Ohama et al., 2017).有意思的是, HSFB2A、HSFB2B和DREB2A是AtMBF1c的直接靶基因, AtMBF1c通过与DREB2A、HSFB2A和HSFB2B的启动子顺式作用元件结合, 调控其表达, 提高热胁迫的耐受性(Sakuma et al., 2006; Suzuki et al., 2011).DREB2A是AP2/ERF (APETALA2/ ethylene-responsive element-binding factor, AP2/ ERF)转录因子家族成员, 参与干旱和热胁迫响应(Sakuma et al., 2006).热胁迫能快速瞬时诱导DREB2A的表达, 过表达DREB2A导致热胁迫相关基因HSFA3、HSP70、HSP18.2和At1g52560 (CPsHSP)的表达水平升高, 植株耐热性增强; 而dreb2a突变体中HSFA3、HSP70、HSP18.2和At1g52560 (CPsHSP)的表达水平显著降低, 植物耐热性下降.DREB2A直接与下游HSFA3启动子的顺式作用元件DRE (dehydration-responsive element)结合, 促进HSFA3调控的一系列HSPs等热胁迫响应基因的表达, 提高耐热性(Schramm et al., 2008).这表明DREB2A通过调节其下游HSFs和HSPs家族的多个成员的表达, 提高植物的耐热性(Sakuma et al., 2006).此外, 在热胁迫条件下, DNA聚合酶II亚基3-1 (DNA polymerase II subunit B3-1, DPB3-1)、核因子-Y A2 (nuclear factor Y A2, NF-Y A2)和核因子-Y B3 (nuclear factor Y B3, NF-Y B3)形成三聚体共激活复合物(coactivator complex), 进而与DREB2A互作, 增强其转录激活活性, 促进其下游靶基因HSFA3的表达, 提高植物耐热性(Schramm et al., 2008; Yoshida et al., 2008; Sato et al., 2014; Ohama et al., 2017; Sajid et al., 2018). ... StMBF1c positively regulates disease resistance to Ralstonia solanacearum via its primary and secondary upregulation combining expression of StTPS5 and resistance marker genes in potato 1 2021 ... Members of the MBF1 protein family in different plant species
(A) 植物MBF1的系统发育关系、基因结构和保守基序分布图.11个物种MBF1蛋白的全长蛋白质序列来自JGI数据库(https:// phytozome-next.jgi.doe.gov/) (表1).用MEGA7.0软件基于邻接法构建同源系统进化树, 绿色背景表示I类MBF1蛋白亚家族, 红色背景表示II类MBF1蛋白亚家族.利用GSDS2.0软件(http://gsds.cbi.pku.edu.cn/)在线绘制基因结构图, 上游5'非编码区/下游3'非编码区用蓝色方框表示, 外显子用黄色方框表示, 内含子用黑色直线显示.使用MEME网站(https://meme-suite.org/meme/ tools/meme)在线预测保守基序.通过NCBI网站CDD数据库(https://www.ncbi.nlm.nih.gov/cdd)鉴定蛋白质序列的保守结构域及功能.利用Tbtools软件绘制保守基序分布图, 5个保守基序用不同颜色方框表示.(B) 11个物种MBF1蛋白中预测到的保守基序序列. ... ABA is required for the accumulation of APX1 and MBF1c during a combination of water deficit and heat stress 2 2016 ... MBF1 (multiprotein bridging factor 1)家族是一个在进化上高度保守的转录共激活因子家族, 属于HTH超家族(helix-turn-helix superfamily) (Jaimes-Miranda and Montes, 2020).编码MBF1的cDNA首次在家蚕(Bombyx mori)后部丝腺中被克隆到(Takemaru et al., 1997), 随后在所有真核生物中都鉴定到了其同源基因.对真菌、昆虫、酵母以及拟南芥(Arabidopsis thaliana)和人(Homo sapiens)的研究表明, MBF1可以将通用转录因子TATA-box结合蛋白(TATA-box binding protein, TBP)与多种转录因子桥接(bridging), 从而激活基因转录(Takemaru et al., 1997, 1998; Busk et al., 2003; Tsuda et al., 2004; Song et al., 2015).与真菌和动物的MBF1不同, 植物MBF1能直接与DNA结合, 推测MBF1c的DNA结合元件为CTAGA (Suzuki et al., 2011).MBF1可以提高植物对多种非生物胁迫(热、盐、干旱、渗透和氧化胁迫)的耐受性(Suzuki et al., 2005; Yan et al., 2014; Wang et al., 2017; Katano et al., 2018a; Zou et al., 2019), 增强植物对病原菌侵染的防御能力(Godoy et al., 2001; Wang et al., 2019), 调节植物激素响应和种子萌发过程(Di Mauro et al., 2012; Zandalinas et al., 2016).大量研究聚焦MBF1的热应答功能, 发现MBF1c是调控植物耐热性的关键调节因子(Ohama et al., 2017; Jaimes-Miranda and Montes, 2020).本文综述了植物MBF1进化特征、分子结构和胁迫应答作用机制相关研究进展, 重点总结了MBF1c对热信号感知与信号转导通路的调节作用. ...
(A) 植物MBF1的系统发育关系、基因结构和保守基序分布图.11个物种MBF1蛋白的全长蛋白质序列来自JGI数据库(https:// phytozome-next.jgi.doe.gov/) (表1).用MEGA7.0软件基于邻接法构建同源系统进化树, 绿色背景表示I类MBF1蛋白亚家族, 红色背景表示II类MBF1蛋白亚家族.利用GSDS2.0软件(http://gsds.cbi.pku.edu.cn/)在线绘制基因结构图, 上游5'非编码区/下游3'非编码区用蓝色方框表示, 外显子用黄色方框表示, 内含子用黑色直线显示.使用MEME网站(https://meme-suite.org/meme/ tools/meme)在线预测保守基序.通过NCBI网站CDD数据库(https://www.ncbi.nlm.nih.gov/cdd)鉴定蛋白质序列的保守结构域及功能.利用Tbtools软件绘制保守基序分布图, 5个保守基序用不同颜色方框表示.(B) 11个物种MBF1蛋白中预测到的保守基序序列. ...
(A) 植物MBF1的系统发育关系、基因结构和保守基序分布图.11个物种MBF1蛋白的全长蛋白质序列来自JGI数据库(https:// phytozome-next.jgi.doe.gov/) (表1).用MEGA7.0软件基于邻接法构建同源系统进化树, 绿色背景表示I类MBF1蛋白亚家族, 红色背景表示II类MBF1蛋白亚家族.利用GSDS2.0软件(http://gsds.cbi.pku.edu.cn/)在线绘制基因结构图, 上游5'非编码区/下游3'非编码区用蓝色方框表示, 外显子用黄色方框表示, 内含子用黑色直线显示.使用MEME网站(https://meme-suite.org/meme/ tools/meme)在线预测保守基序.通过NCBI网站CDD数据库(https://www.ncbi.nlm.nih.gov/cdd)鉴定蛋白质序列的保守结构域及功能.利用Tbtools软件绘制保守基序分布图, 5个保守基序用不同颜色方框表示.(B) 11个物种MBF1蛋白中预测到的保守基序序列. ...
本文的其它图/表
-
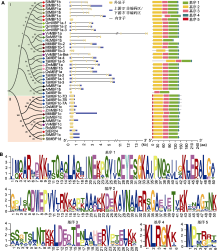 图1
植物MBF1系统发育关系、基因结构和保守基序分析
图1
植物MBF1系统发育关系、基因结构和保守基序分析
(A) 植物MBF1的系统发育关系、基因结构和保守基序分布图。11个物种MBF1蛋白的全长蛋白质序列来自JGI数据库(https:// phytozome-next.jgi.doe.gov/) (表1)。用MEGA7.0软件基于邻接法构建同源系统进化树, 绿色背景表示I类MBF1蛋白亚家族, 红色背景表示II类MBF1蛋白亚家族。利用GSDS2.0软件(http://gsds.cbi.pku.edu.cn/)在线绘制基因结构图, 上游5'非编码区/下游3'非编码区用蓝色方框表示, 外显子用黄色方框表示, 内含子用黑色直线显示。使用MEME网站(https://meme-suite.org/meme/ tools/meme)在线预测保守基序。通过NCBI网站CDD数据库(https://www.ncbi.nlm.nih.gov/cdd)鉴定蛋白质序列的保守结构域及功能。利用Tbtools软件绘制保守基序分布图, 5个保守基序用不同颜色方框表示。(B) 11个物种MBF1蛋白中预测到的保守基序序列。
-
 图2
不同物种MBF1s同源序列比对分析
图2
不同物种MBF1s同源序列比对分析
家蚕BmMBF1和酿酒酵母yMBF1蛋白质序列从Ensembl数据库(https://ensemblgenomes.org/)下载, 蛋白编号分别为BGIBMGA 007702和YOR298C-A。利用DNAMAN软件对蛋白序列进行比对。紫色框表示N端MBF1结构域, 蓝色框表示C端HTH_3结构域。拟南芥和水稻MBF1蛋白质序列及蛋白编号见表1。
-
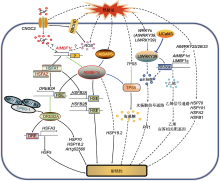 图3
MBF1调控热胁迫应答信号通路
图3
MBF1调控热胁迫应答信号通路
热胁迫通过激活质膜CNGC2引起Ca2+内流, 通过激活质膜结合的RBOHD导致ROS积累。而Ca2+信号和ROS信号通过未知途径激活AtMBF1c及其下游靶基因调节的热胁迫应答。热激转录因子HSFA1与HSFA2相互作用, 直接调控AtMBF1c、HSFA2、HSFBs和DREB2A的表达。同时, AtMBF1c通过与DREB2A、HSFB2A和HSFB2B的启动子HSE元件结合, 调控其基因表达, 提高热胁迫耐受性。DREB2A与DPB3-1、NF-Y A2和NF-Y B3形成的三聚体共激活复合物互作, 增强其对下游靶基因HSFA3的转录激活, 提高植物的耐热性。DREB2A也促进HSP70、HSP18.2和At1g52560的表达, 增强植株耐热性。AtSAP5作为上游调控因子与AtMBF1c发生互作并激活AtMBF1c, 调节细胞核中HSP18.2的表达, 提高植物耐热性。热胁迫诱导TPS5的表达, AtMBF1c与TPS5互作, 通过促进海藻糖的合成和积累提高耐热性。热胁迫诱导AtWRKY39、AtWRKY25、AtWRKY26和AtWRKY33的表达。AtWRKY39通过AtMBF1c调节水杨酸(SA)信号通路下游PR1基因表达, 提高耐热性。AtWRKY25、AtWRKY26和AtWRKY33通过AtMBF1c调节乙烯信号通路下游基因的表达提高耐热性, 同时通过促进HSP70、HSP101、HSFA2和HSFB1的表达提高耐热性。CNGC2: 环核苷酸门控离子通道2; DPB3-1 (NF-YC10): DNA聚合酶II亚基B3-1; DRE: 脱水应答元件; DREB2A: 干旱应答元件结合蛋白2A; HSE: 热休克响应元件; HSFA1/2/3: 热激转录因子A1/2/3; HSFB2A/B: 热激转录因子B2A/B; HSP18.2/70/101: 热激蛋白18.2/70/101; MBF1c: 多蛋白桥梁因子1c; NF-Y A2/B3: 核因子-Y A2/B3; PR1: 病程相关因子1; RBOHD: 呼吸爆发氧化同源蛋白D; ROS: 活性氧; SAP5: 胁迫相关蛋白5; TPS5: 海藻糖磷酸合成酶5。蓝色实线箭头表示蛋白互作; 绿色实线箭头表示基因编码蛋白; 黑色实线箭头表示直接转录激活; 黑色虚线箭头表示间接转录激活。
|
