
|
|
||
|
质膜蛋白动力学的调控及其研究方法
植物学报
2023, 58 (4):
590-601.
DOI: 10.11983/CBB22102
质膜蛋白是细胞膜的重要组分之一, 在细胞的物质转运、离子交换、信号转导以及代谢过程中起着重要作用。质膜蛋白在膜上是运动的, 生长发育和环境因素均可改变其运动方式。因此, 研究影响质膜蛋白运动的因素及调控机制对于理解植物生长发育和应对环境改变至关重要。近年来, 显微技术发展迅速, 使得关于质膜蛋白动力学调控机制的研究逐步深入。该文详细介绍了质膜蛋白动力学及其影响因素, 概述了近几年在质膜蛋白动力学研究中常用的显微成像技术, 以期为深入研究质膜蛋白的生物学功能提供参考。 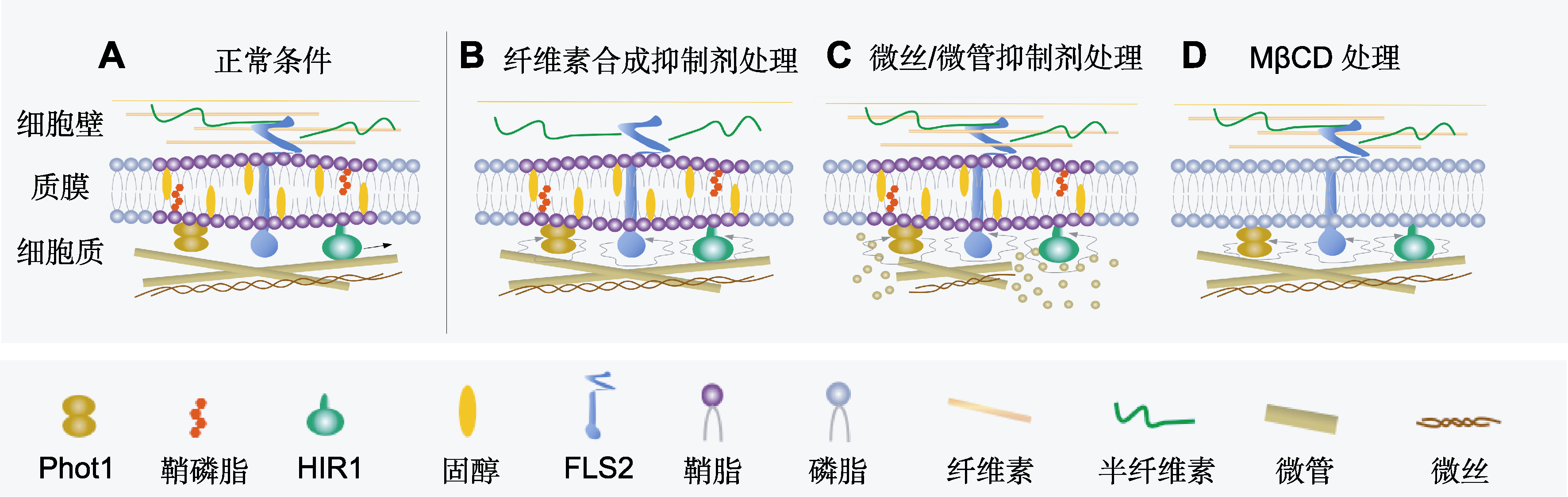 View image in article
图1
质膜蛋白动力学影响因素
(A) 正常条件下, 质膜蛋白在膜上运动; (B) 纤维素合成抑制剂处理改变质膜蛋白的横向扩散; (C) 微丝/微管抑制剂处理改变质膜蛋白的横向扩散; (D) MβCD处理改变质膜蛋白的横向扩散。
正文中引用本图/表的段落
细胞壁是植物细胞特有的一种多糖基细胞外结构, 其主要成分是纤维素微纤丝与半纤维素(原生质体向外运输物质并在胞外沉积的产物) (Hoffmann et al., 2021)。细胞壁可为植物细胞提供外部支撑结构, 并参与调控植物细胞的大小和形状, 同时也在生物与非生物胁迫中起防御作用(Somerville et al., 2004; Malinovsky et al., 2014; Le Gall et al., 2015)。研究表明, 细胞壁可限制质膜蛋白的扩散(Martinière et al., 2012), 通过缩短PM与细胞壁之间的距离使部分质膜蛋白运动减慢(Li et al., 2013)。例如, McKenna等(2019)对细胞壁调节质膜纳米结构域的大小和动力学特征进行了研究, 分别用纤维素抑制剂DCB和果胶合成抑制剂EGCG处理植物, 结果发现质膜蛋白(如PIN3-GFP和FLS2-GFP) (图1B)的动力学行为发生显著变化, 即扩散速率和运动范围明显增大, 再次证明细胞壁限制质膜蛋白在质膜内的横向迁移。Cui等(2021)在对拟南芥水通道蛋白AtPIP2;1研究中得出相似的结论, 纤维素酶处理后, 膜上AtPIP2;1的侧向运动加快, 表明细胞壁参与限制质膜蛋白的侧向运动。有研究表明, 细胞壁中果胶等成分的沉积也会影响质膜蛋白扩散的速度以及轨迹。例如, Martinière等(2012)研究细胞壁对paGFP-LTI6运动状态的影响时, 使用纤维素合成酶抑制剂isoxabe处理拟南芥幼苗中的paGFP-LTI6蛋白, 结果表明isoxabe处理明显抑制paGFP-LTI6蛋白的运动。综上所述, 植物细胞特有结构细胞壁会对质膜蛋白的运动产生影响, 而探索细胞壁对质膜蛋白动态的调节, 可为揭示物质运输和信号转导等过程中蛋白质互作机制提供新见解。
此外, 在植物细胞中的一些研究也证实, 细胞骨架网络可通过界定微米尺度上的膜微域来限定PM蛋白的侧向运动。例如, Lv等(2017)使用双通道VA- TIRFM成像和单颗粒示踪技术对AtHIR1蛋白进行观察, 发现大部分AtHIR1仅在微管骨架形成的隔区内运动, 少部分AtHIR1蛋白直接锚定在微管骨架上; 使用抑制剂解聚微管后, AtHIR1的扩散系数和运动范围显著增大, 说明微管骨架可以分隔膜微区形成边界, 间接或直接与AtHIR1结合, 限制膜上AtHIR1的侧向扩散(图1C)。Cui等(2021)使用微管抑制剂oryzalin和微丝抑制剂Lat B研究细胞骨架对AtPIP2;1动力学的影响, 结果表明细胞骨架破坏后能显著增加保卫细胞和副卫细胞中AtPIP2;1的扩散速度与扩散系数; 并发现在保卫细胞中, 微管调节AtPIP2;1动力学的作用比肌动蛋白丝更明显, 而在副卫细胞中, 肌动蛋白丝比微管对AtPIP2;1扩散的调节作用更强。上述结果表明, 细胞骨架可影响膜蛋白的运动, 且PM蛋白的寡聚化和信号转导均需完整的细胞骨架。
膜筏(membrane raft) (大小介于10-200 nm之间的动态结构)是细胞膜上富含鞘脂类和胆固醇的一类膜微区(membrane microdomain)。膜蛋白存在于质膜上, 不同的质膜蛋白其动力学特征不同。有研究表明, 膜蛋白扩散的不均一性及表现出的受限运动均与膜筏相关(Cui et al., 2018a)。对动物细胞的研究表明, 膜筏微区能够区隔化(compartmentalize)膜蛋白的扩散, 而膜蛋白进筏和出筏的运动过程对蛋白的聚合及激活均起一定的作用(Douglass and Vale, 2005; Pinaud et al., 2009)。在植物细胞中的研究也表明, 膜筏会对质膜蛋白的运动产生影响。例如, Xue等(2018)采用双通道VA-TIRFM观察phot1-GFP和AtRem1.3-mCherry在质膜上的分布情况, 并以此来确定phot1-GFP运动是否与膜微区有关, 共定位结果显示, phot1-GFP定位在膜筏上, 当用MβCD处理后, phot1-GFP在膜上的扩散面积及速率均发生明显改变, 而添加β-谷甾醇进行回补实验时, 发现phot1动力学可以恢复, 证明膜筏确实限制phot1在膜上的运动(图1D)。同样, Hao等(2014)采用MβCD处理的方法研究膜微结构域在GFP-RbohD动力学中的作用, 发现MβCD处理可促进GFP-RbohD聚集并重新分布到团簇结构(clusters)中, 且其扩散系数发生明显改变, 表明膜微区影响GFP-RbohD的定位和动力学。此外, 为进一步研究RbohD与膜微结构域之间的关系, 他们还对RbohD与膜微结构域标记物Flot1的共定位情况进行了分析, PPI (protein proximity indexes)数据结果再次证明RbohD的横向扩散与膜微区相关。与此同时, 膜筏作为众多生物学过程的重要反应平台(reaction platform), 在胞吞以及膜信号传递过程中也发挥重要的作用。在对BRI1蛋白的运动和胞吞研究中发现, 当用外源油菜素内酯(BR)处理植物后, BRI1-GFP与AtFlot1-mCherry存在共定位现象, 这些共定位的荧光点可在质膜上共扩散, 且BR处理能增加BRI1-GFP与AtFlot1-mCherry的结合, 这些结果表明膜微区的确参与了BRI1在质膜上的胞吞过程, 并揭示了BRI1的胞吞可通过2条途径进行, 即网格蛋白介导的胞吞途径和膜筏介导的胞吞途径(Wang et al., 2015)。此外, 膜筏可通过参与FLS2的胞吞过程影响信号传递。Cui等(2018a)研究发现当固醇发生突变时, flg22诱导的FLS2胞吞途径被显著抑制, 且固醇突变体也显著影响flg22诱导的信号传递。可见, 膜微区可调控质膜蛋白在膜上的动态, 破坏膜筏将影响质膜蛋白的动力学行为, 暗示膜微区是质膜蛋白正常发挥作用所必需的重要平台。
(A) 由折射到全内反射(total internal reflection, TIR): 1束光在2种不同的介质中传播, 介质的折射率分别为n1和n2, 入射角为α, 由Snell定律可知, 光会发生折射进入另一种介质, 且在另一种介质中的传播角度与原介质不同, 当入射角α1等于甚至大于临界角α2时, 光就不会进入到较小折射率的介质中, 而是完全被反射到原来的介质中, 即发生全内反射; (B) 在荧光相关光谱法(FCS)中, 单个标记分子在焦体积内外的扩散会引起荧光随时间的波动, 通过将荧光涨落曲线拟合到适当的扩散模型, 可计算粒子数及其扩散系数; (C) 选择感兴趣区域(ROI), 用强激光束漂白, 并测量ROI中的荧光恢复时间; (D) 超分辨显微成像技术的原理示意图。FCS、SIM、STED、PALM和STORM同
本文的其它图/表
|