
|
|
||
|
表观遗传调控植物分枝/分蘖研究进展
植物学报
2022, 57 (4):
532-548.
DOI: 10.11983/CBB22027
分蘖是禾本科植物特有的分枝类型, 是影响作物产量的关键因素之一。分枝/分蘖数由叶腋处侧生分生组织的数量和侧芽的活性共同决定。表观遗传修饰调控植物生长发育的各个方面, 但是如何调控植物的分枝/分蘖数还未见系统报道。该综述归纳了表观遗传调控侧生分生组织的形成和侧芽向外生长两个方面, 并展望了表观遗传在调控植物分枝/分蘖中的研究方向, 以期为通过表观遗传修饰改良作物品种的育种途径提供理论指导。 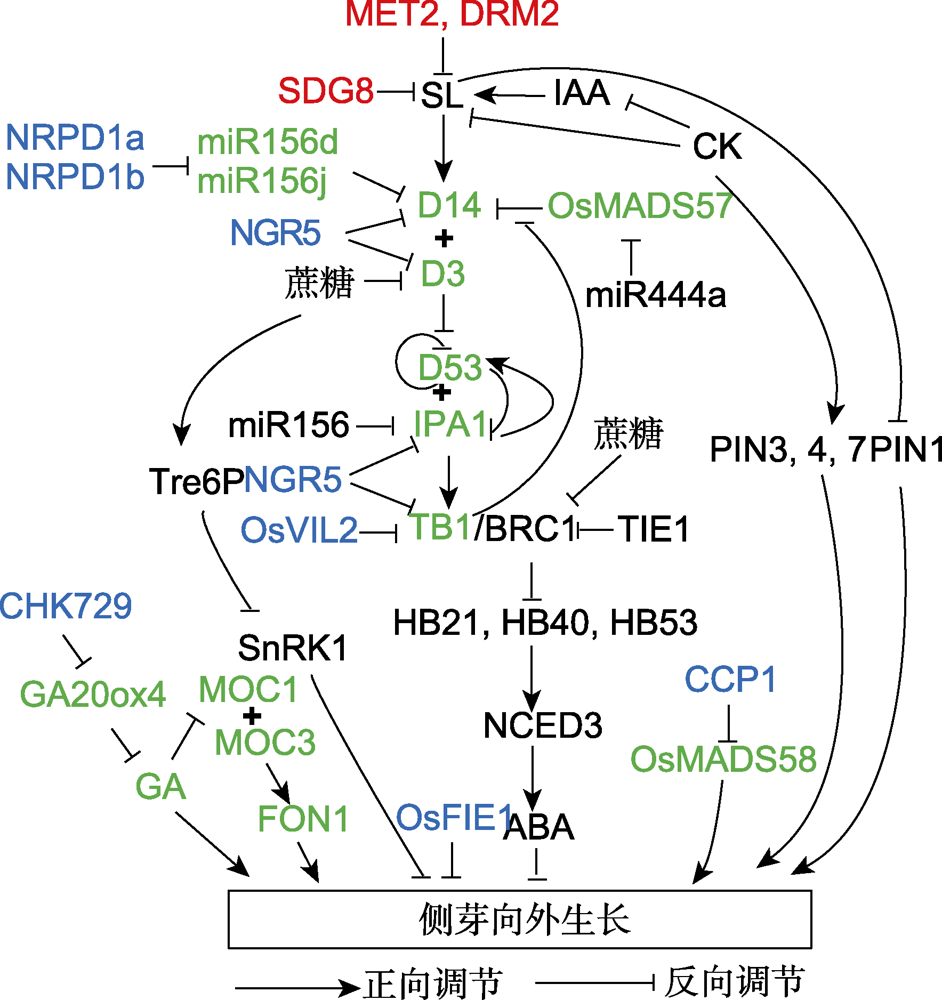 View image in article
图2
参与调控侧芽向外生长的关键因子
拟南芥中调控因子用黑色标示; 拟南芥中表观遗传因子用红色标示; 水稻中调控因子用绿色标示; 水稻中表观遗传调控因子用蓝色标示。SL: 独脚金内酯; IAA: 生长素; CK: 细胞分裂素; GA: 赤霉素; ABA: 脱落酸
正文中引用本图/表的段落
TCP转录因子包含bHLH结构域, 该结构域可结合DNA及介导蛋白互作。研究发现BRC1可结合并激活3个HD-ZIP I转录因子(HB21、HB40和HB53), 这3个转录因子基因可促进脱落酸(ABA)生物合成基因NCED3 (9-CIS-EPOXICAROTENOID DIOXYGENASE 3)的表达, 导致ABA水平升高(图2), 而ABA能够增强侧芽的休眠(González-Grandío et al., 2017)。这些HD-ZIP I转录因子基因可能是BRC1调控侧芽向外生长的靶基因。此外, Van Es等(2020)发现, BRC1对ABA信号具有更广泛的调控作用, 可直接调控参与ABA代谢、运输、感知、信号转导和响应的基因表达。
由AM形成的侧芽受顶端分生组织的调控而维持休眠状态, 该现象称为顶端优势。研究表明IAA、SL、糖及环境因素均能影响顶端优势(图2)。目前, 侧芽打破休眠向外生长主要有两种假说, 分别是营养假说和IAA运输渠化假说(Phillips, 1975; Balla et al., 2011, 2016)。
有研究表明, 蔗糖至少部分作为信号调控侧芽的生长。首先, 几乎不能被降解的糖类似物可诱发侧芽生长(Loreti et al., 2000; Wu and Birch, 2011)。其次, 海藻糖-6-磷酸(trehalose 6-phosphate, Tre6P)参与蔗糖信号途径诱发豌豆侧芽的早期释放(Fichtner et al., 2017)。Tre6P是在植物体内以微摩尔浓度(0.1- 10 µmol·L-1)存在的一种糖, 可正向反应组织内蔗糖的水平(Figueroa and Lunn, 2016; Griffiths et al., 2016)。豌豆中, 去除顶部和蔗糖处理后, 侧芽中的Tre6P含量快速升高(Fichtner et al., 2017)。高粱(Sorghum bicolor)中Tre6P合成基因的表达与侧芽生长也具相关性(Tarancón et al., 2017)。拟南芥过量积累Tre6P的植株表现出分枝增多(Schluepmann et al., 2003), 支持Tre6P调控分枝的结论。Tre6P可以抑制生长抑制因子SnRK1 (sucrose non-fermenting kinase 1)的活性。SnRK1可激活营养饥饿响应基因的表达, 导致细胞生长受限(Margalha et al., 2016)。最近, 在一年生和多年生木本植物中的转录组分析揭示了SnRK1与碳饥饿调控基因在侧芽休眠中的相关性, 说明SnRK1在侧芽休眠过程中具潜在作用(Tarancón et al., 2017)。Patil等(2022)研究表明, 蔗糖能抑制D3基因的表达, 促进D53蛋白积累, 进而促进水稻分蘖芽的生长(图2)。
CK和SL被认为是调控侧芽生长的重要植物激素。CK促进芽的生长, 而SL起抑制作用。在顶端合成并在主茎中运输的IAA能够促进SL生物合成基因的表达(Domagalska and Leyser, 2011; Rameau et al., 2014)。与IAA不同, CK以及SL可进入侧芽(Teichmann and Muhr, 2015)。把CK和SL施加到主茎上可调控侧芽的生长(Dun et al., 2012), 且侧芽的向外生长与其中CK和SL信号基因的表达密切相关, 说明侧芽可能是SL和CK行使功能的场所(Mason et al., 2014; Dierck et al., 2016; Roman et al., 2016)。SL和CK被认为是通过控制侧芽中IAA的向外运输来调控侧芽生长(Crawford et al., 2010; Shinohara et al., 2013; Bennett et al., 2016; Waldie and Leyser, 2018)。事实上, SL能诱发IAA外排转运体PIN的胞吞(Shinohara et al., 2013; Rameau et al., 2014); 抑制IAA的生物合成(Ligerot et al., 2017)。max2的多分枝表型在PIN1、PIN3以及PIN7发生突变后得到部分恢复, 说明SL部分通过IAA的极性运输行使功能(Van Rongen et al., 2019)。但在SL缺陷豌豆突变体rms1中, IAA外排运输受到抑制后外源施加SL仍可以抑制侧芽的向外生长(Gomez-Roldan et al., 2008; Chabikwa et al., 2019), 说明SL抑制侧芽生长还有其它机制。在拟南芥CK信号相关突变体中, IAA外输转运体在质膜的极性分布降低, 说明CK促进IAA外输转运体的极性分布, 调控侧芽生长(Waldie and Leyser, 2018) (图2)。
SL的感知需要α/β水解酶D14 (DWARF14)。D14 既是受体又是一种酶, 具有非常保守的Ser-His-Asp 催化三联体, 该三联体为SL水解和信号传递所必需。D14水解SL形成的中间产物可与D14共价结合, 此过程能诱导D14的构象发生改变(Yao et al., 2016; Seto et al., 2019)。MAX2 (MORE AXILLARY GROWTH2)/ D3 (DWARF3)属于F-box蛋白, 可以与OSKs和CULLIN1蛋白形成SCF复合体, 具有E3泛素连接酶的功能(Stirnberg et al., 2007; Zhao et al., 2014)。D53蛋白是位于D14和D3下游的SL信号关键负调节因子, 具有转录抑制活性(Jiang et al., 2013; Zhou et al., 2013; Wang et al., 2020)。D14以依赖SL的方式与D3和D53互作, 泛素化D53及拟南芥中D53的同源蛋白SMXL6 (SMAX1-LIKE6)、SMXL7和SMXL8, 并招募26S蛋白酶体进行降解(Jiang et al., 2013; Zhou et al., 2013; Soundappan et al., 2015; Wang et al., 2015; Waters et al., 2017) (图2)。最近研究表明, D3的构象决定着其活性状态, 一种状态促进D3与D14及水解的SL中间产物结合, 招募D53蛋白; 另一种状态抑制D14的酶活(Shabek et al., 2018)。
水稻中D53可与SPL家族转录因子IPA1相互作用(Song et al., 2017)。IPA1转录因子能直接结合OsTB1的启动子区并激活其表达, 从而抑制水稻分蘖(Lu et al., 2013)。D53蛋白可与IPA1直接互作并抑制其转录活性, SL诱导D53蛋白降解后, IPA1激活下游基因的表达。此外, IPA1可直接结合D53的启动子反馈调节其表达(Song et al., 2017)。D53可以抑制自身的表达以及下游BRANCHED 1、TCP DOMAIN PROTEIN 1和PRODUCTION OF ANTHOCYANIN PIGMENT 1的表达, 分别调控突变体的分蘖、叶型和花青素含量(Wang et al., 2020) (图2)。
目前, 有关表观遗传调控植物侧芽生长的报道主要在以下几个方面(表2; 图2)。
本文的其它图/表
|