

植物学报 ›› 2018, Vol. 53 ›› Issue (5): 643-652.DOI: 10.11983/CBB17173 cstr: 32102.14.CBB17173
吕秀立1,2,3†, 张群1†, 陈香波1, 李圃锦1, 吴伟4, 关媛5,6,*
收稿日期:2017-09-10
接受日期:2018-03-13
出版日期:2018-09-01
发布日期:2018-11-29
通讯作者:
关媛
作者简介:† 共同第一作者。
基金资助:Lü Xiuli1,2,3†, Zhang Qun1†, Chen Xiangbo1, Li Pujin1, Wu Wei4, Guan Yuan5,6,*
Received:2017-09-10
Accepted:2018-03-13
Online:2018-09-01
Published:2018-11-29
Contact:
Guan Yuan
About author:† These authors contributed equally to this paper
摘要: 根据市场需求和野生资源现存状况, 筛选厚叶岩白菜(Bergenia crassifolia)、秦岭岩白菜(B. scopulosa)和岩白菜(B. purpurascens)进行规模化繁殖, 并利用ISSR分子标记对组培苗进行遗传稳定性分析。以顶芽为外植体, 筛选出MS+0.5 mg·L-1 6-BA+0.01 mg·L-1 NAA+2.0 mg·L-1 VC为最佳增殖培养基, 3种岩白菜属植物增殖系数分别为3.10、2.50和2.10; 在1/2MS+1.0 mg·L-1 IBA+2.0 mg·L-1 VC培养基上, 3种岩白菜属植物生根率分别为85%、80%和75%; 在腐殖土:黄沙:珍珠岩=2:1:1 (v/v/v)的混合基质中, 移栽成活率分别为90%、85%和80%。规模化繁殖厚叶岩白菜20万株, 秦岭岩白菜2万株, 岩白菜1万株, 目前还在持续生产中。ISSR分子标记结果表明, 岩白菜后代遗传变异较大, 秦岭岩白菜后代遗传变异较小, 3个种在继代至第20代时出现了遗传变异; 岩白菜和秦岭岩白菜的平均遗传变异率随继代次数的增加而增加, 厚叶岩白菜的平均遗传变异率随继代次数的增加呈现不规律变化。
吕秀立, 张群, 陈香波, 李圃锦, 吴伟, 关媛. 岩白菜属植物规模化繁殖及遗传稳定性. 植物学报, 2018, 53(5): 643-652.
Lü Xiuli, Zhang Qun, Chen Xiangbo, Li Pujin, Wu Wei, Guan Yuan. Mass Propagation and Genetic Stability of Bergenia Species. Chinese Bulletin of Botany, 2018, 53(5): 643-652.
| Name of primers | Sequence of primers (5'-3') | Annealing temperature (°C) |
|---|---|---|
| UBC815 | CTCTCTCTCTCTCTCTG | 50.6 |
| UBC845 | CTCTCTCTCTCTCTCTRG | 51.8 |
| UBC852 | TCTCTCTCTCTCTCTCRA | 51.6 |
| UBC853 | TCTCTCTCTCTCTCTCRT | 50.9 |
| UBC854 | TCTCTCTCTCTCTCTCRG | 53.4 |
表1 ISSR分析所用的引物序列
Table 1 The sequence of ISSR primers
| Name of primers | Sequence of primers (5'-3') | Annealing temperature (°C) |
|---|---|---|
| UBC815 | CTCTCTCTCTCTCTCTG | 50.6 |
| UBC845 | CTCTCTCTCTCTCTCTRG | 51.8 |
| UBC852 | TCTCTCTCTCTCTCTCRA | 51.6 |
| UBC853 | TCTCTCTCTCTCTCTCRT | 50.9 |
| UBC854 | TCTCTCTCTCTCTCTCRG | 53.4 |
| VC (mg·L-1) | Aseptic seedling (individual) | Sterile seedling rate (%) | Browning condition |
|---|---|---|---|
| 0.1 | 0±0 e | 0±0 e | Browning |
| 0.2 | 0±0 e | 0±0 e | Browning |
| 0.5 | 8±2 c | 40±10 c | No browning |
| 1.0 | 13±1 b | 65±5 b | No browning |
| 2.0 | 15±0 a | 75±0 a | No browning |
| 4.0 | 14±1 ab | 70±5 ab | No browning |
| 5.0 | 13±0 b | 65±0 b | No browning |
| 6.0 | 4±0 d | 20±0 d | No browning |
| 8.0 | 0±0 e | 0±0 e | Death |
表2 不同浓度VC对无菌苗获得的影响
Table 2 Effects of different concentrations of VC on the ste- rile seedlings
| VC (mg·L-1) | Aseptic seedling (individual) | Sterile seedling rate (%) | Browning condition |
|---|---|---|---|
| 0.1 | 0±0 e | 0±0 e | Browning |
| 0.2 | 0±0 e | 0±0 e | Browning |
| 0.5 | 8±2 c | 40±10 c | No browning |
| 1.0 | 13±1 b | 65±5 b | No browning |
| 2.0 | 15±0 a | 75±0 a | No browning |
| 4.0 | 14±1 ab | 70±5 ab | No browning |
| 5.0 | 13±0 b | 65±0 b | No browning |
| 6.0 | 4±0 d | 20±0 d | No browning |
| 8.0 | 0±0 e | 0±0 e | Death |
| Explant | Inoculation No. (individual) | Septic seedling No. (individual) | Sterile seedling rate (%) |
|---|---|---|---|
| Top bud of mother plant | 30 | 4±1 a | 13.33±0.03 a |
| Shoot apical bud of ramet | 30 | 25±2 b | 83.33±0.07 b |
表3 不同外植体对无菌苗获得的影响
Table 3 Effects of different explants on the sterile seedlings
| Explant | Inoculation No. (individual) | Septic seedling No. (individual) | Sterile seedling rate (%) |
|---|---|---|---|
| Top bud of mother plant | 30 | 4±1 a | 13.33±0.03 a |
| Shoot apical bud of ramet | 30 | 25±2 b | 83.33±0.07 b |
| Concentration (mg·L-1) | No. of germination (individual) | Germination rate (%) | Other condition | |
|---|---|---|---|---|
| 6-BA | NAA | |||
| 0.01 | 0.01 | 5±0 d | 25±0 d | No callus, undifferentiated |
| 0.01 | 0.02 | 12±1 b | 60±5 b | No callus, undifferentiated |
| 0.01 | 0.04 | 10±0 c | 50±0 c | Callus, undifferentiated |
| 0.01 | 0.08 | 10±1 c | 50±5 c | Callus, undifferentiated |
| 0.01 | 0.1 | 10±0 c | 50±0 c | Callus, undifferentiated |
| 0.01 | 0.2 | 10±1 c | 50±5 c | Callus, undifferentiated |
| 0.01 | 0.5 | 10±2 c | 50±10 c | Callus, undifferentiated |
| 0.02 | 0.02 | 15±1 a | 75±5 a | No callus, undifferentiated |
| 0.05 | 0.02 | 15±2 a | 75±10 a | No callus, undifferentiated |
| 0.1 | 0.02 | 15±0 a | 75±0 a | No callus, undifferentiated |
表4 不同激素及不同激素水平对3种岩白菜属植物外植体萌发的影响
Table 4 The effects of different hormone and hormone concentrations on the germination of bud of 3 Bergenia species
| Concentration (mg·L-1) | No. of germination (individual) | Germination rate (%) | Other condition | |
|---|---|---|---|---|
| 6-BA | NAA | |||
| 0.01 | 0.01 | 5±0 d | 25±0 d | No callus, undifferentiated |
| 0.01 | 0.02 | 12±1 b | 60±5 b | No callus, undifferentiated |
| 0.01 | 0.04 | 10±0 c | 50±0 c | Callus, undifferentiated |
| 0.01 | 0.08 | 10±1 c | 50±5 c | Callus, undifferentiated |
| 0.01 | 0.1 | 10±0 c | 50±0 c | Callus, undifferentiated |
| 0.01 | 0.2 | 10±1 c | 50±5 c | Callus, undifferentiated |
| 0.01 | 0.5 | 10±2 c | 50±10 c | Callus, undifferentiated |
| 0.02 | 0.02 | 15±1 a | 75±5 a | No callus, undifferentiated |
| 0.05 | 0.02 | 15±2 a | 75±10 a | No callus, undifferentiated |
| 0.1 | 0.02 | 15±0 a | 75±0 a | No callus, undifferentiated |

图1 3种岩白菜属植物组培快繁过程(A)-(C) 厚叶岩白菜(A)、秦岭岩白菜(B)和岩白菜(C)的增殖培养; (D)-(F) 厚叶岩白菜(D)、秦岭岩白菜(E)和岩白菜(F)的生根培养; (G)-(I) 厚叶岩白菜(G)、秦岭岩白菜(H)和岩白菜(I)的植株移栽
Figure 1 Tissue culture and rapid propagation of 3 Bergenia species(A)-(C) Multiplication culture of B. crassifolia (A), B. scopulosa (B) and B. purpurascens (C); (D)-(F) Rooting culture of B. crassifolia (D), B. scopulosa (E) and B. purpurascens (F); (G)-(I) Transplanting of B. crassifolia (G), B. scopulosa (H) and B. purpurascens (I)
| Concentration (mg·L-1) | No. of multiplication bud (individual) | Multiplication coefficien | Browning condition | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 6-BA | NAA | VC | A | B | C | A | B | C | A | B | C | |||
| 0.1 | 0.01 | 24±1 g | 29±2 e | 23±0 de | 1.20±0.03 g | 1.45±0.07 e | 1.15±0 de | + | - | - | ||||
| 0.1 | 0.01 | 2.0 | 33±2 f | 27±1 e | 22±2 e | 1.65±0.07 f | 1.35±0.03 e | 1.10±0 e | - | - | - | |||
| 0.25 | 0.01 | 31±1 f | 33±2 d | 25±1 d | 1.55±0.03 f | 1.65±0.07 d | 1.25±0.03 d | + | - | - | ||||
| 0.25 | 0.01 | 2.0 | 45±2 d | 36±1 c | 31±2 c | 2.25±0.07 d | 1.80±0.03 c | 1.55±0.07 c | - | - | - | |||
| 0.5 | 0.01 | 48±1 c | 51±2 a | 41±1 a | 2.40±0.03 c | 2.55±0.07 a | 2.05±0.03 a | + | - | - | ||||
| 0.5 | 0.01 | 2.0 | 62±1 a | 50±1 a | 42±2 a | 3.10±0.03 a | 2.50±0.03 a | 2.10±0.07 a | - | - | - | |||
| 0.75 | 0.01 | 52±2 b | 49±3 a | 43±2 a | 2.60±0.07 b | 2.45±0.1 a | 2.15±0.07 a | + | - | - | ||||
| 0.75 | 0.01 | 2.0 | 62±2 a | 50±3 a | 42±2 a | 3.10±0.07 a | 2.50±0.1 a | 2.10±0.07 a | - | - | - | |||
| 1.0 | 0.01 | 37±2 e | 45±4 b | 37±2 b | 1.85±0.07 e | 2.25±0.13 b | 1.85±0.07 b | + | - | - | ||||
| 1.0 | 0.01 | 2.0 | 45±2 d | 43±3 b | 35±2 b | 2.25±0.07 d | 2.15±0.1 b | 1.75±0.07 b | - | - | - | |||
表5 不同激素及不同激素水平对3种岩白菜属植物增殖的影响
Table 5 The effects of different hormone and hormone concentrations on shoot multiplication of 3 Bergenia species
| Concentration (mg·L-1) | No. of multiplication bud (individual) | Multiplication coefficien | Browning condition | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 6-BA | NAA | VC | A | B | C | A | B | C | A | B | C | |||
| 0.1 | 0.01 | 24±1 g | 29±2 e | 23±0 de | 1.20±0.03 g | 1.45±0.07 e | 1.15±0 de | + | - | - | ||||
| 0.1 | 0.01 | 2.0 | 33±2 f | 27±1 e | 22±2 e | 1.65±0.07 f | 1.35±0.03 e | 1.10±0 e | - | - | - | |||
| 0.25 | 0.01 | 31±1 f | 33±2 d | 25±1 d | 1.55±0.03 f | 1.65±0.07 d | 1.25±0.03 d | + | - | - | ||||
| 0.25 | 0.01 | 2.0 | 45±2 d | 36±1 c | 31±2 c | 2.25±0.07 d | 1.80±0.03 c | 1.55±0.07 c | - | - | - | |||
| 0.5 | 0.01 | 48±1 c | 51±2 a | 41±1 a | 2.40±0.03 c | 2.55±0.07 a | 2.05±0.03 a | + | - | - | ||||
| 0.5 | 0.01 | 2.0 | 62±1 a | 50±1 a | 42±2 a | 3.10±0.03 a | 2.50±0.03 a | 2.10±0.07 a | - | - | - | |||
| 0.75 | 0.01 | 52±2 b | 49±3 a | 43±2 a | 2.60±0.07 b | 2.45±0.1 a | 2.15±0.07 a | + | - | - | ||||
| 0.75 | 0.01 | 2.0 | 62±2 a | 50±3 a | 42±2 a | 3.10±0.07 a | 2.50±0.1 a | 2.10±0.07 a | - | - | - | |||
| 1.0 | 0.01 | 37±2 e | 45±4 b | 37±2 b | 1.85±0.07 e | 2.25±0.13 b | 1.85±0.07 b | + | - | - | ||||
| 1.0 | 0.01 | 2.0 | 45±2 d | 43±3 b | 35±2 b | 2.25±0.07 d | 2.15±0.1 b | 1.75±0.07 b | - | - | - | |||
| Concentration (mg·L-1) | Average height before culture (cm) | Average height after culture (cm) | Adding average height (cm) | Other condition | |
|---|---|---|---|---|---|
| 6-BA | IBA | ||||
| 0.01 | 0.01 | 1.1 | 1.9 | 0.8±0.1 e | Undifferentiated, no root |
| 0.02 | 0.01 | 1.2 | 2.1 | 0.98±0 e | Undifferentiated, no root |
| 0.03 | 0.01 | 1.1 | 2.0 | 0.98±0 e | Undifferentiated, no root |
| 0.04 | 0.01 | 1.3 | 2.5 | 1.28±0.1 d | Undifferentiated, no root |
| 0.05 | 0.01 | 1.2 | 2.1 | 0.98±0.1 e | Differentiated, no root |
| 0.04 | 0.02 | 1.1 | 2.6 | 1.58±0.1 c | Undifferentiated, no root |
| 0.04 | 0.05 | 1.2 | 2.3 | 1.18±0.1 d | Undifferentiated, no root |
| 0.04 | 0.1 | 1.1 | 3.3 | 2.28±0.1 b | Undifferentiated, no root |
| 0.04 | 0.2 | 1.3 | 4.1 | 2.88±0.2 a | Undifferentiated, rootage |
表6 不同激素及不同激素水平对3种岩白菜属植物壮苗的影响
Table 6 The effects of different hormone and hormone concentrations on making robust seedling of 3 Bergenia species
| Concentration (mg·L-1) | Average height before culture (cm) | Average height after culture (cm) | Adding average height (cm) | Other condition | |
|---|---|---|---|---|---|
| 6-BA | IBA | ||||
| 0.01 | 0.01 | 1.1 | 1.9 | 0.8±0.1 e | Undifferentiated, no root |
| 0.02 | 0.01 | 1.2 | 2.1 | 0.98±0 e | Undifferentiated, no root |
| 0.03 | 0.01 | 1.1 | 2.0 | 0.98±0 e | Undifferentiated, no root |
| 0.04 | 0.01 | 1.3 | 2.5 | 1.28±0.1 d | Undifferentiated, no root |
| 0.05 | 0.01 | 1.2 | 2.1 | 0.98±0.1 e | Differentiated, no root |
| 0.04 | 0.02 | 1.1 | 2.6 | 1.58±0.1 c | Undifferentiated, no root |
| 0.04 | 0.05 | 1.2 | 2.3 | 1.18±0.1 d | Undifferentiated, no root |
| 0.04 | 0.1 | 1.1 | 3.3 | 2.28±0.1 b | Undifferentiated, no root |
| 0.04 | 0.2 | 1.3 | 4.1 | 2.88±0.2 a | Undifferentiated, rootage |
| Concentration (mg·L-1) | No. of roots (individual) | Rooting rate (%) | Callus status | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| NAA | IBA | VC | A | B | C | A | B | C | A | B | C | |||
| 0.1 | 2.0 | 4±1 f | 5±0 d | 3±1 e | 20±0.05 f | 25±0 d | 15±0.05 e | A small amount of browning | A small amount of browning | A small amount of browning | ||||
| 0.5 | 2.0 | 9±2 d | 9±2 c | 7±1 d | 45±0.1 d | 45±0.1 c | 35±0.05 d | A small amount of browning | A small amount of browning | A small amount of browning | ||||
| 1.0 | 2.0 | 11±2 c | 13±2 b | 10±1 c | 55±0.1 c | 65±0.1 b | 50±0.05 c | A small amount of browning | A small amount of browning | A small amount of browning | ||||
| 2.0 | 2.0 | 12±2 b | 11±2 c | 12±2 b | 55±0.1 c | 60±0.1 b | 60±0.1 b | Severe browning | Severe browning | Severe browning | ||||
| 0.1 | 2.0 | 7±1 e | 7±0 cd | 7±1 d | 35±0.05 e | 35±0 cd | 35±0.05 d | No browning | No browning | No browning | ||||
| 0.5 | 2.0 | 17±2 a | 18±1 a | 16±2 a | 85±0.1 a | 90±0.05 a | 80±0.1 a | No browning | No browning | No browning | ||||
| 1.0 | 2.0 | 17±2 a | 16±3 a | 15±2 a | 85±0.1 a | 80±0.15 a | 75±0.1 a | No browning | No browning | No browning | ||||
| 2.0 | 2.0 | 16±2 b | 17±3 a | 15±3 a | 80±0.1 b | 85±0.15 a | 75±0.15 a | A small amount of browning | A small amount of browning | A small amount of browning | ||||
| 0.5 | 0±2 g | 17±1 a | 15±2 a | 0±0.1 g | 85±0.05 a | 75±0.1 a | Browning death | Normal | Normal | |||||
表7 不同激素及不同激素浓度对3种岩白菜属植物生根的影响
Table 7 The effects of different hormone and hormone concentrations on rooting of 3 Bergenia species
| Concentration (mg·L-1) | No. of roots (individual) | Rooting rate (%) | Callus status | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| NAA | IBA | VC | A | B | C | A | B | C | A | B | C | |||
| 0.1 | 2.0 | 4±1 f | 5±0 d | 3±1 e | 20±0.05 f | 25±0 d | 15±0.05 e | A small amount of browning | A small amount of browning | A small amount of browning | ||||
| 0.5 | 2.0 | 9±2 d | 9±2 c | 7±1 d | 45±0.1 d | 45±0.1 c | 35±0.05 d | A small amount of browning | A small amount of browning | A small amount of browning | ||||
| 1.0 | 2.0 | 11±2 c | 13±2 b | 10±1 c | 55±0.1 c | 65±0.1 b | 50±0.05 c | A small amount of browning | A small amount of browning | A small amount of browning | ||||
| 2.0 | 2.0 | 12±2 b | 11±2 c | 12±2 b | 55±0.1 c | 60±0.1 b | 60±0.1 b | Severe browning | Severe browning | Severe browning | ||||
| 0.1 | 2.0 | 7±1 e | 7±0 cd | 7±1 d | 35±0.05 e | 35±0 cd | 35±0.05 d | No browning | No browning | No browning | ||||
| 0.5 | 2.0 | 17±2 a | 18±1 a | 16±2 a | 85±0.1 a | 90±0.05 a | 80±0.1 a | No browning | No browning | No browning | ||||
| 1.0 | 2.0 | 17±2 a | 16±3 a | 15±2 a | 85±0.1 a | 80±0.15 a | 75±0.1 a | No browning | No browning | No browning | ||||
| 2.0 | 2.0 | 16±2 b | 17±3 a | 15±3 a | 80±0.1 b | 85±0.15 a | 75±0.15 a | A small amount of browning | A small amount of browning | A small amount of browning | ||||
| 0.5 | 0±2 g | 17±1 a | 15±2 a | 0±0.1 g | 85±0.05 a | 75±0.1 a | Browning death | Normal | Normal | |||||

图2 3种岩白菜属植物畸形苗和地栽苗(A), (B) 顶端畸形的种苗; (C) 移栽成活的半年生组培苗; (D) 两年生组培苗开花; (E) 两年生组培苗, 冬季叶色变红
Figure 2 The phenotype of abnormal seedlings and field grown plants of 3 Bergenia species(A), (B) The seedlings of abnormal apex; (C) Tissue culture seedlings were transplanted for half a year; (D) Flowering phenotype of two years old tissue culture plants; (E) Phenotypic changes of leaves of two years old tissue culture plants in winter
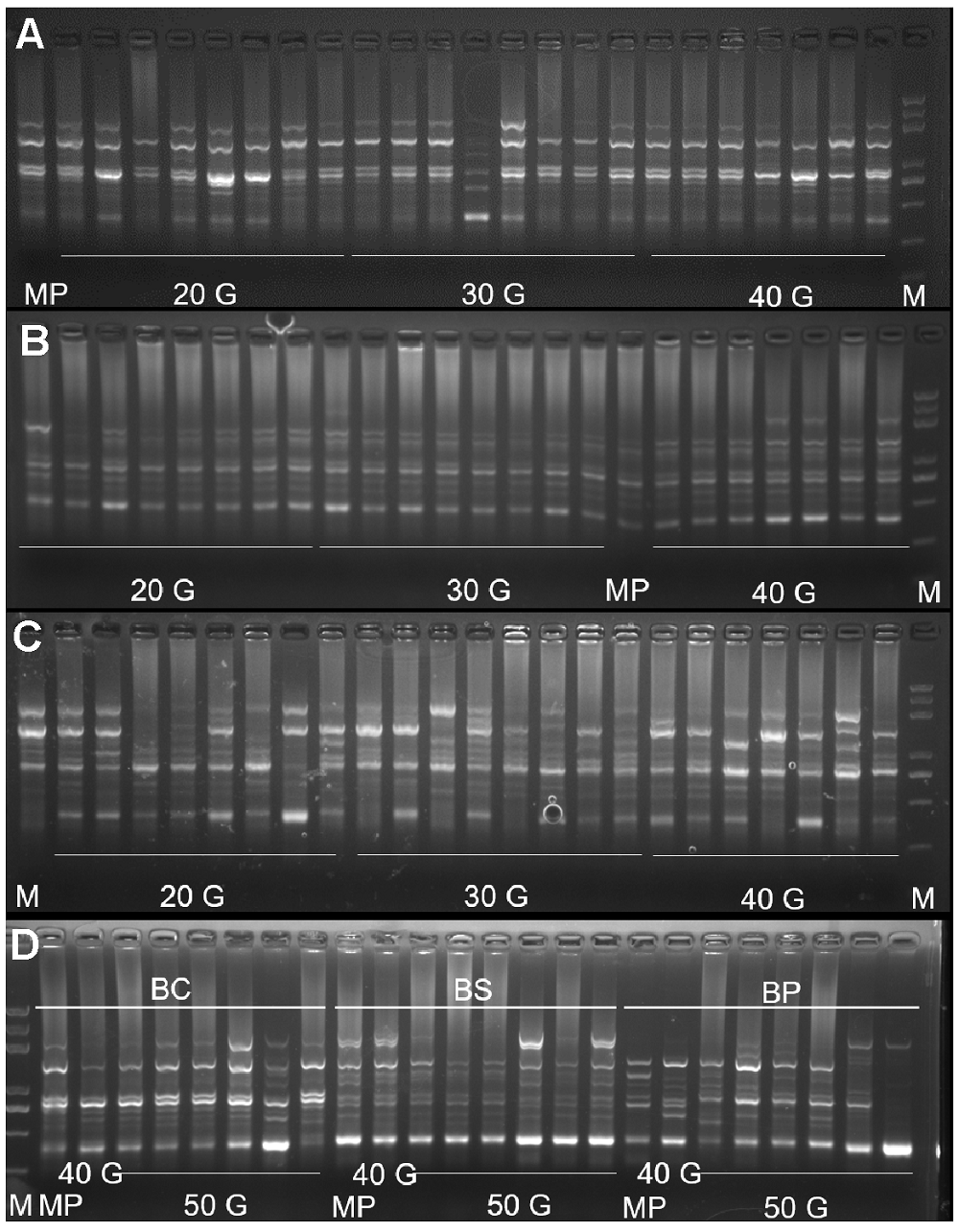
图3 ISSR引物UBC854在3种岩白菜属植物中的扩增结果(A) 厚叶岩白菜扩增结果; (B) 秦岭岩白菜扩增结果; (C) 岩白菜扩增结果; (D) 3种岩白菜第50代组培苗扩增结果。M: DNA标准样品; MP: 母本; 20 G: 第20代; 30 G: 第30代; 40 G: 第40代; 50 G: 第50代; BC: 厚叶岩白菜; BS: 秦岭岩白菜; BP: 岩白菜
Figure 3 The amplification results of UBC854 primers in 3 Bergenia species(A) The amplification results of UBC854 primers in B. crassi- folia; (B) The amplification results of UBC854 primers in B. scopulosa; (C) The amplification results of UBC854 primers in B. purpurascens; (D) The amplification results of UBC854 primers in 50 generation seedlings of 3 Bergenia species. M: DNA marker; MP: Maternal plant; 20 G: 20 generations; 30 G: 30 generations; 40 G: 40 generations; 50 G: 50 generations; BC: B. crassifolia; BS: B. scopulosa; BP: B. purpurascens
| 1 | 董成梅, 杨丽川, 邹澄, 赵沛基, 蒲洪, 张滢 (2012). 岩白菜素的研究进展. 昆明医学院学报 (1), 150-154. |
| 2 | 丰先红, 李健, 罗孝贵 (2010). 植物组织培养中体细胞无性系变异研究. 中国农学通报 26(14), 70-73. |
| 3 | 康建坂, 朱海生, 李大忠, 李永平, 汪伟裁, 温庆放 (2010). 应用ISSR技术分析苦瓜种质资源的多态性. 福建农业学报 25, 597-601. |
| 4 | 李文春, 郭凤根, 张丽梅, 于虹漫, 李信, 林春 (2006). 岩白菜研究现状与展望. 云南农业大学学报 21, 845-850. |
| 5 | 刘锋, 江涛, 任素梅 (2004). 熊果苷合成研究进展. 日用化学工业 34, 242-244. |
| 6 | 刘福平 (2010). 植物体细胞无性系变异的遗传基础及主要影响因素. 基因组学与应用生物学 29, 1142-1151. |
| 7 | 刘敏, 郝秀英, 徐琴, 波拉提, 康喜亮, 王晓军 (2009). 野生花卉厚叶岩白菜组织培养及再生体系的建立. 安徽农业科学 37, 3455-3456, 3462. |
| 8 | 刘石泉, 李小军, 周根余 (2005). 铁皮石斛不同繁殖代数遗传稳定性RAPD的研究. 江南大学学报(自然科学版) 4, 518-521. |
| 9 | 刘思泱, 于卓, 蒙美莲, 马艳红, 刘宇杰, 甘霖, 张自强, 李长青 (2010). 6个彩色马铃薯品种的ISSR分析. 华北农学报 25(5), 117-120. |
| 10 | 吕秀立, 郭小芳, 施季森, 沈烈英 (2016). 厚叶岩白菜叶片离体培养研究. 上海交通大学学报(农业科学版) 34(6), 50-54. |
| 11 | 吕秀立, 沈烈英, 王健, 王景先 (2013a). 厚叶岩白菜组织培养技术. 林业科技开发 27, 116-118. |
| 12 | 吕秀立, 王健, 沈烈英, 崔心红, 张春英, 孙伟墨 (2013b). 厚叶岩白菜离体培养和快速繁殖的方法. 中国专利, ZL20121- 0069616.5. 2013-09-18. |
| 13 | 吕秀立, 张春英, 沈烈英, 关媛, 冯永辉, 施季森 (2017). 岩白菜属植物需求状况及发展趋势分析. 中国农学通报 33(22), 53-57. |
| 14 | 彭红卫, 赵刚, 权秋梅, 黎云祥, 王潇, 王辉, 高泽梅 (2011). 岩白菜组培中POD活性的研究. 西华师范大学学报(自然科学版) 32, 227-230. |
| 15 | 田憬若, 谭秀山, 吴婷婷, 孙惜时, 谈甜甜, 任娇 (2014). 岩白菜素的生物活性的研究进展. 食品研究与开发 35(5), 128-132. |
| 16 | 王碧霞, 赵欢, 黎云祥 (2012). 岩白菜属植物研究的新进展. 光谱实验室 29, 367-370. |
| 17 | 王继良, 何瑾, 邹澄, 黎其万 (2006). 岩白菜素的研究进展. 中国民族民间医药杂志 (6), 321-325. |
| 18 | 文晓鹏, 邓秀新 (2003). 利用细胞学和分子标记检测刺梨愈伤组织的遗传稳定性. 果树学报 20, 467-470. |
| 19 | 杨丽云, 陈翠, 汤王外, 康平德 (2010). 药用植物岩白菜种子发芽特性研究. 种子 29(12), 81-82, 86. |
| 20 | 袁菊丽, 索建兰 (2011). 岩白菜属药用植物的研究进展. 宝鸡文理学院学报(自然科学版) 31(1), 46-50. |
| 21 | 曾霞, 庄南生 (2002). 木薯分子标记研究进展. 华南热带农业大学学报 9(1), 6-12. |
| 22 | 赵桂茹, 王仕玉, 郭凤根, 龙雯虹, 张丽梅, 陈严平, 周平 (2013). 不同光照强度对2年生岩白菜生长的影响. 西部林业科学 42(5), 93-97. |
| 23 | 赵谦, 杜虹, 庄东红 (2007). ISSR分子标记及其在植物研究中的应用. 分子植物育种 5(6S), 123-129. |
| 24 | 朱军, 李晓瑾, 贾晓光, 李红侠 (2012). 新疆珍稀药用植物厚叶岩白菜离体快繁研究. 时珍国医国药 23, 2308-2309. |
| 25 | Allen GC, Flores-Vergara MA, Krasynanski S, Kumar S, Thompson WF (2006). A modified protocol for rapid DNA isolation from plant tissues using cetyltrimethylammonium bromide.Nat Protoc 1, 2320-2325. |
| 26 | Reisch BI (1988). Genetic instability in plant cell cultures: utilization in plant breeding and genetic studies. In: Pais MSS, Mavituna F, Novais JM, eds. Plant Cell Biotechnology. Berlin Heidelberg: Springer. pp. 87-95. |
| 27 | Zietkiewicz E, Rafalski A, Labuda D (1994). Genome fingerprinting by simple sequence repeat (SSR)-anchored polymerase chain reaction amplification.Genomics 20, 176-183. |
| [1] | 任露露, 张有泽, 黄克林, 宛晓春, 张照亮, 朱木兰, 韦朝领. 茶树茎段不定芽高效发生体系的建立[J]. 植物学报, 2023, 58(2): 308-315. |
| [2] | 吕秀立, 于泽群, 陈香波, 傅仁杰, 缪珊珊, 杜安. 粉美人萱草的快繁技术和大田种植[J]. 植物学报, 2022, 57(3): 350-357. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||