
|
|
||
|
植物核糖体应激响应机制研究进展
植物学报
2022, 57 (1):
80-89.
DOI: 10.11983/CBB21120
核仁是真核细胞中重要的核结构, 核糖体发生最初在核仁中进行, 该过程涉及一系列复杂的反应, 需要许多核仁相关因子参与。核糖体生物发生出现异常通常引起核仁结构紊乱, 并导致细胞周期阻滞、细胞衰老甚至凋亡。核糖体应激响应机制在哺乳动物细胞中研究得较为深入, 但在植物细胞中尚不明晰。尽管如此, 人们逐渐发现某些植物特有的NAC转录因子家族成员在植物细胞中可能参与包括核糖体应激在内的多种胞内应激响应过程。此外, 前期研究发现生长素系统与核糖体生物合成之间存在一种相互协调机制来调控植物发育。该文结合哺乳动物细胞中已知的核糖体应激响应通路, 探讨植物细胞潜在的核糖体应激机制。 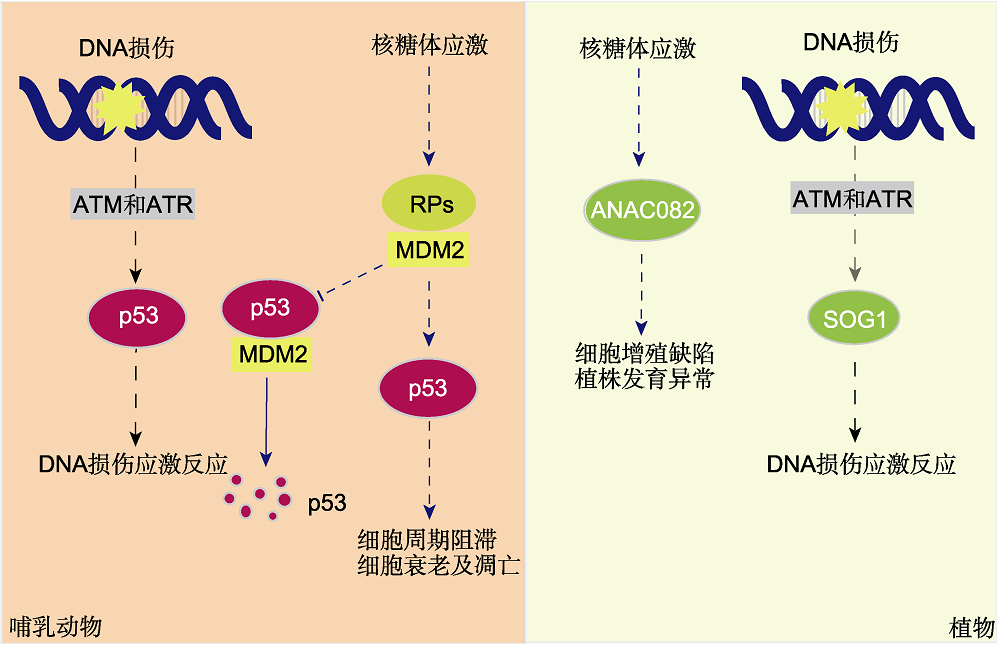 View image in article
图1
哺乳动物与植物细胞核糖体应激及DNA损伤反应途径比较
核糖体蛋白突变或核糖体生物发生缺陷会导致核糖体应激。在哺乳动物细胞中, 核糖体应激和DNA损伤反应均由p53响应。正常情况下, p53与E3泛素连接酶MDM2相互作用, 通过泛素降解途径调控其蛋白稳态; 当核糖体应激发生时, 一部分RPs从核仁中释放出来, 与MDM2的酸性结构域结合, 降低其对p53的作用。p53作为转录因子介导下游细胞周期阻滞、细胞衰老及凋亡。在植物中, 类p53转录因子SOG1被ATM和ATR激活并磷酸化, 参与DNA损伤反应, 但是目前尚无证据表明SOG1在核糖体应激响应中发挥作用。而另一个NAC家族转录因子ANAC082可能参与一定的核糖体应激反应。实线箭头表示正常状态, 虚线箭头表示应激状态。
正文中引用本图/表的段落
在动植物细胞中, 许多刺激导致的核糖体异常会激活细胞周期停滞甚至凋亡的信号通路, 这被称为核糖体应激反应(James et al., 2014)。这一过程在动物细胞中研究得较为深入, 其中最典型且最广泛的是p53依赖途径, 在这一途径中p53及其不稳定因子MDM2起关键作用。p53是哺乳动物中重要的抗肿瘤转录因子, MDM2是一种E3泛素连接酶, 与p53相互作用使其泛素化并降解(Olson, 2004)。因此, 在正常生理状态下, MDM2能够抑制p53的活性, 将其控制在很低的水平。而在核糖体应激条件下, RPs从核仁中释放, 进入核质(Olson, 2004), 释放的一些RPs (包括RPL5、RPL11、RPL23和RPS7)作为效应器直接与MDM2酸性结构域结合, 从而降低其对p53的作用(图1) (Chen et al., 2007)。p53-MDM2途径是由RPs缺乏或核糖体生物发生受损引起的发育障碍和疾病的主要原因(Pelletier et al., 2018; Klinge and Woolford, 2019)。关于哺乳动物细胞中p53非依赖途径的研究也有一定进展, 如RPL3和RPL11依赖途径(Maekawa et al., 2018)。研究发现, 由5-氟尿嘧啶和奥沙利铂诱导的核糖体应激与RPL3的上调及其以游离核糖体形式的积累有关, RPL3不仅能通过控制p21的表达参与药物诱导的细胞周期阻滞、细胞凋亡以及DNA修复, 还能以独立于p21的方式控制DNA修复(Esposito et al., 2014)。c-myc基因是myc基因家族的重要成员之一, 其产物c-myc通过增强核糖体生物发生和翻译过程促进细胞生长, 其与核糖体生物发生之间的良好协调对正常的细胞稳态至关重要。在RPL11依赖途径中, 核糖体应激诱导RPL11释放到细胞质和细胞核中, 并将microRNA诱导的沉默复合物(microRNA-induced silencing complex, miRISC)募集到c-myc mRNA, 介导其衰减(Challagundla et al., 2011)。
为了感知和应对细胞压力, 动物进化出一套相关信号系统, p53在其中作为中枢调节因子。上文提到在动物细胞中, p53是核仁应激反应的主要调控因子(图1), 此外, p53还参与其它细胞应激反应, 如DNA损伤和氧化应激(Horn and Vousden, 2007; Hu et al., 2012)。在DNA损伤应激反应中, 首先由2种PI3K相关蛋白激酶ATM和ATR感知DNA的各类损伤, 使p53特定位点发生磷酸化从而将其激活(Shiloh, 2001; Sancar et al., 2004)。在活性氧(ROS)引起的氧化应激中, 先由DNA的氧化损伤或氧化直接激活ATM触发DNA损伤应激反应, 再进一步激活p53 (Barzilai and Yamamoto, 2004)。相比之下, 植物也进化出了胁迫信号系统, 由不同的转录因子来应对不同胁迫。在植物中, DNA损伤应激反应受SOG1 (suppressor of gamma response 1)/ANAC008调控(图1) (Yoshiyama et al., 2009)。当DNA双链损伤胁迫发生时, ATM使SOG1发生超磷酸化, 将其激活来调控下游基因的表达。此外, SOG1还介导ATR依赖的DNA复制损伤信号。因此, SOG1的功能及信号响应机制类似于动物细胞p53 (Yoshiyama et al., 2013)。然而, 目前尚无证据表明SOG1在核糖体应激信号中发挥作用。此外, 在植物中由于几个NAC家族转录因子ATAF1/ANAC002和ANAC092的作用, 氧化应激能够独立于DNA损伤促进叶片衰老(Balazadeh et al., 2010; Garapati et al., 2015)。
拟南芥rid2 (root initiation defective 2)是温度敏感突变体, 由1个编码类RNA甲基转移酶蛋白基因突变引起。在高温胁迫条件下, rid2植株细胞中核糖体加工受到严重影响(Ohbayashi et al., 2017)。通过对rid2进行人工诱变及筛选, 发现一株能够缓解rid2高温发育缺陷的突变体sriw1。利用图位克隆技术明确sriw1的突变基因是位于5号染色体的At5g09330, 其编码1个NAC转录因子ANAC082 (Ohbayashi et al., 2017)。进一步的遗传学分析发现, sriw1还能缓解其它核糖体加工异常且对温度敏感的突变体(如rid3和rh10)的表型, 但对与核糖体加工不相关的温度敏感突变体(如root primordium defective 1和root growth defective 3)的表型无显著影响。上述结果表明, ANAC082可能专一地响应核糖体加工异常。
在sriw1/rid2双突变体中, 28°C条件下所有rid2特有的可见缺陷都显著减弱, 包括主根生长和叶片发育得到改善, 不定根和愈伤组织形成的抑制解除, 下胚轴中柱细胞恢复有效分裂以及核仁异常增大得到缓解等(Ohbayashi et al., 2017)。Ohbayashi等(2017)对ANAC082的表达模式进行分析, 发现其分布于核糖体相关突变的表型效应明显区域, 如茎尖和根尖分生组织及叶原基, 且高温胁迫能显著提高其启动子活性。这表明ANAC082在核糖体生物发生紊乱的下游起作用, 并可能介导一系列导致发育改变和细胞增殖缺陷的应激反应(图1)。
本文的其它图/表
|