
|
|
||
|
细胞分裂素调控种子发育、休眠与萌发的研究进展
植物学报
2021, 56 (2):
218-231.
DOI: 10.11983/CBB20141
种子萌发是子代植株建立、生长和繁育的重要阶段, 在种子植物生命周期中起重要作用。种子休眠是在发育过程中形成的, 在生理成熟期达到峰值。种子休眠与萌发的植物激素调控可能是种子植物中一种高度保守的机制。细胞分裂素(CK)是植物体内的一种重要信号分子, 调控植物生长发育的许多方面。生物活性CK的水平由其生物合成、活化、失活、再活化和降解之间的平衡所调控, 种子的发育、休眠与萌发受生物活性CK的水平和信号转导途径调控。该文综述了CK的生物合成与代谢、信号转导以及对种子发育、休眠与萌发的调控作用, 提出了在本领域需要进一步研究的科学问题, 旨在为理解CK调控种子发育、休眠与萌发的分子机理提供参考。 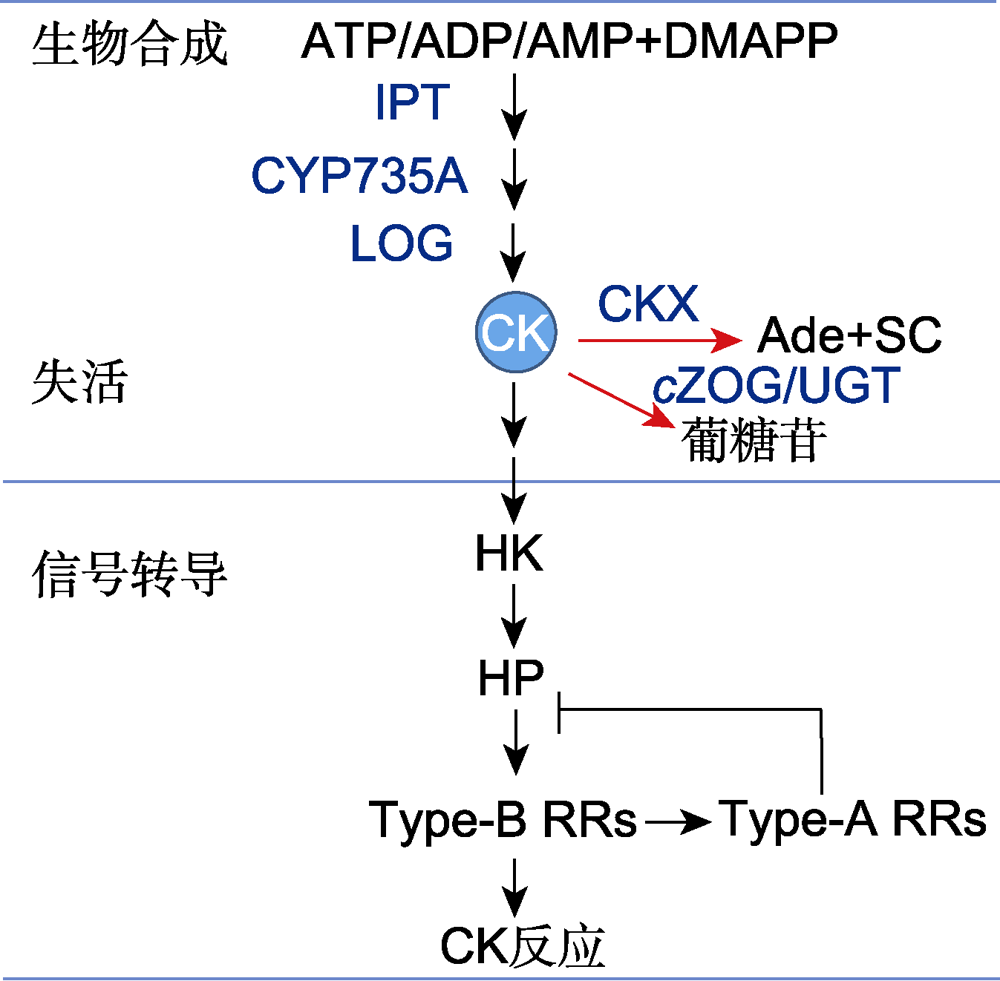 View image in article
图1
细胞分裂素(CK)代谢和信号转导模型(改自Kieber and Schaller,
Ade: 腺嘌呤; ADP: 腺苷二磷酸; AMP: 腺苷一磷酸; ATP: 腺苷三磷酸; CKX: CK氧化酶/脱氢酶; CYP735A: 细胞色素P450单加氧酶; cZOG: 顺式玉米素-O-葡糖基转移酶; DMAPP: 二甲基丙烯基二磷酸; HK: 组氨酸激酶; HP: 组氨酸磷酸转移蛋白; IPT: 异戊烯基转移酶; LOG: CK核苷5′-单磷酸磷酸核糖水解酶; SC: 侧链; Type-B RRs: 类型-B反应调控因子; Type-A RRs: 类型-A反应调控因子; UGT: UDP糖基转移酶
正文中引用本图/表的段落
细胞分裂素生物合成的最初步骤和限速步骤是异戊烯基转移酶(isopentenyltransferase, IPT)分别将AMP、ADP或者ATP和二甲基丙烯基二磷酸(dimethylallyl diphosphate, DMAPP)转化为iP-核苷酸(iP- nucleotide) (Sakakibara, 2006; Frébortet al.2011)。iP-核苷酸再被细胞色素P450单加氧酶(cytochrome P450 monooxygenase, CYP735A)转化为tZ-核苷酸(Hirose et al.2008)。CK核苷5′-单磷酸磷酸核糖水解酶(cytokinin nucleoside 5′-monophosphate phosphoribohydrolase或LOG (lonely guy))直接激活tZ-核苷酸和iP-核苷酸成为游离态CK, 包括玉米素(zeatin, Z)和iP (图1) (Kurakawa et al.2007; Frébortet al.2011)。
细胞分裂素氧化酶/脱氢酶(cytokinin oxidase/dehydrogenase, CKX)在N6侧链上不可逆地裂解游离态CK和CK核苷, 以降低生物活性CK的水平(图1) (Sakakibara, 2006; Tuan et al.2019; Chen et al.2020)。研究发现, CKX的过表达导致内源CK水平降低和多种发育缺陷; tZ和iP都能被CKX裂解, 但DZ和人工合成的CK (如激动素(kinetin)和6-BA)对CKX的裂解具有抗性(Zalabáket al.2014)。
顺式玉米素-O-葡糖基转移酶(cis-zeatin-O-glucosyltransferase, cZOG)催化tZ、cZ和DZ的侧链羟基葡糖基化为O-葡糖苷(O-glucoside) (图1)或O-木糖苷(O-xyloside); O-葡糖基化是可逆的, 能被β-葡糖苷酶(β-glucosidase, βGlc)去糖基化(deglycosylation), 重新生成生物活性CK (Sakakibara,2006)。UDP糖基转移酶(UDP glycosyltransferase, UGT)催化CK在嘌呤部分的N3、N7和N9位置上的葡糖基化成为N-葡糖苷(N-glucoside), βGlc不能有效地裂解 N-葡糖结合物(N-glucoconjugate), 因此, 实际上N-葡糖基化是不可逆的(Sakakibara, 2006)。
细胞分裂素信号转导途径也被称为双组分信号转导系统(two-component signaling system), 主要包括组氨酸激酶(histidine (His) kinase, HK)、组氨酸磷酸转移蛋白(His phosphotransfer protein, HP)和反应调控因子(response regulator, RR)。其中HK作为CK的受体, HP将信号从HK传递到细胞核的RR, 从而调控靶基因转录(图1, 图2) (Hwang et al.2012; Kieber and Schaller, 2018; Lomin et al.2018; Arkhipov et al.2019; Hallmark and Rashotte, 2019; Zubo and Schaller, 2020)。双分子荧光互补(bimolecular fluorescence complementation, BiFC)实验证明, 拟南芥CK受体AHK (Arabidopsis HK) 2-4均能与AHP (Arabidopsis HP)1-3相互作用, 且无明显的偏好; CK受体能形成同源和异源二聚体(Arkhipov et al.2019)。AHK-AHK和AHK-AHP的相互作用主要定位于内质网(endoplasmic reticulum, ER); 相反, 各种磷酸转移蛋白(AHP)的同源和异源二聚体主要存在于植物的细胞核中(Arkhipov et al.2019)。
在CK信号转导途径中, HP (也称为His磷酸传递蛋白(His phosphotransmitter, HPt))在HK受体的下游起作用, 介导磷酸基在多步骤磷酸转移中从活化的HK受体接收器结构域转移到RR接收器结构域(图1, 图2) (Hwang et al.2012; Arkhipov et al.2019)。AHP不具有催化活性, 实际上是作为RR自身磷酸化活性的高能磷酸供体。AHP是CK信号转导冗余的正调控因子(Hutchison et al.2006), 但它们也在植物其它HK下游(如CKI1 (CYTOKININ-INDEPENDENT1))起作用(Liu et al.2017)。AHP蛋白具有1个保守的半胱氨酸残基, 该残基能在体外和体内被一氧化氮(NO) S-亚硝酰化, 抑制AHP作为磷酸转移蛋白的作用, 降低AHP从HK接收磷酸基并将其转移到RR的能力(Feng et al.2013)。
细胞分裂素与HK的PAS结合, 导致受体的二聚作用并被激活, CK的信号转导通过类似于原核生物的His-Asp磷酸传递途径进行(Keshishian and Rashotte, 2015; Zschiedrich et al.2016)。在激活的受体ATP结合结构域中, ATP发生水解, 释放的磷酸基团与HisKA结构域中1个保守的His残基结合, 形成磷酸组氨酸(phosphohistidine)。然后, 活化(hot)的磷酸基在分子内被转移到接收器结构域中1个保守的Asp残基上, 依次与HPt相互作用, 将活化的磷酸基转移到HPt保守的His残基上。HPt携带该活化的磷酸基并转移到细胞核和磷酸化RR蛋白保守的Asp残基。最后, 磷酸化的B型RR能够与DNA结合, 激活CK靶基因的转录(图1, 图2) (Kieber and Schaller, 2018; Pekarova et al.2018; Arkhipov et al.2019)。
种子成熟过程中在母体植株上获得的休眠类型称为初生休眠(primary dormancy), 种子初生休眠的诱导和维持受植物激素调控(Shu et al.2016; Nonogaki, 2017, 2019; 宋松泉等, 2020a)。研究表明, 种子中CK的水平和信号转导调控种子的发育、休眠与萌发(图1, 图3) (Kieber and Schaller, 2018; Tuan et al.2019; Nguyen et al.2020)。后熟(after-ripening)是一种释放种子休眠的方式, 也通过影响CK的水平和信号转导来调控种子的休眠与萌发(Chitnis et al.2014)。
细胞分裂素对种子发育、休眠与萌发的调控通过生物活性CK水平和信号转导途径来实现(图1, 图3) (Hwang et al.2012; Nguyen et al.2020; Zubo and Schaller, 2020)。尽管近年来这些领域的研究已经取得了重要进展, 但仍然有一些科学问题需要进一步探索。例如, 已知生物活性CK可被CKX失活、通过cZOG可逆失活、被UGT不可逆失活以及通过βGlc重新活化(Frébortet al.2011; Jameson and Song, 2016), 那么, 这些反应是否同时存在于同一物种的同一组织, 还是具有物种、组织和发育阶段的特异性? 在响应种子发育、休眠与萌发和环境变化时, 为了控制组织或细胞内的生物活性CK水平, 这些途径怎样被启动、运行和协调?
本文的其它图/表
|