基因可变剪接调控植物响应非生物胁迫研究进展
熊良林, 梁国鲁, 郭启高, 景丹龙
植物学报
2025, 60 ( 3):
435-448.
DOI: 10.11983/CBB24189
外界环境对植物生长发育产生至关重要的影响, 近年来频繁出现的极端气候严重威胁植物生长发育。明确植物抗逆调控机制对于保障植物生存和发育(特别是经济作物的产量)具有重要意义。基因可变剪接是一种重要的转录后调控机制, 对于植物基因功能的多样性与抗逆性均具有重要作用。目前已在不同植物中鉴定出多种抗逆相关基因可变剪接体, 并阐明部分基因可变剪接介导的植物抗逆调控机制, 有效奠定了植物抗逆研究的相关理论基础。因此, 挖掘和鉴定更多抗逆基因在非生物胁迫下的可变剪接调控机制对于植物抗逆研究具有重要意义。该文综述了植物基因可变剪接类型以及剪接机制, 重点阐述了非生物胁迫下相关基因可变剪接介导的植物抗逆研究进展, 展望了未来的研究方向。
| 物种 | 基因 | 功能 | 胁迫类型 | 参考文献 | | 拟南芥(Arabidopsis thaliana) | AtHsfA2 | 维持热休克蛋白相关基因的表达水平 | 热胁迫 | Charng et al., 2007 | | AtSIZ1 | 促进热休克蛋白相关基因表达 | 热胁迫 | Ishida et al., 2012 | | AtIRE1 | 通过调节转录因子bZIP60前体mRNA剪接上调BIP3蛋白的表达 | 热胁迫 | Ling et al., 2021 | | AtZIFL1 | 产生剪接变体, 靶向叶片气孔保卫细胞的质膜并介导耐旱性 | 干旱胁迫 | Remy et al., 2013 | | AtSPCH | 降低气孔密度, 减少水分蒸发 | 干旱胁迫 | Wang et al., 2024a | | AtSR | 使剪接因子丰度和活性发生动态变化, 影响靶基因表达 | 冷胁迫 | Syed et al., 2012 | | AtLUC7 | 参与冷胁迫条件下内含子的剪接调节 | 冷胁迫 | de Francisco Amorim et al., 2018 | | AtSR45 | SR45.1亚型通过调节SOS基因表达以控制离子稳态和赋予耐盐性 | 盐胁迫 | Albaqami et al., 2019 | | AtSR34b | 通过IRT1的剪接和稳定性促进IRT1蛋白积累 | 盐胁迫 | Zhang et al., 2014 | | AtSAD1 | 提高盐胁迫响应基因的剪接效率 | 盐胁迫 | Cui et al., 2014 | | AtSKIP | 参与剪接位点的识别或切割 | 盐胁迫 | Feng et al., 2015 | | AtRCD1 | RCD1的剪接变体可减少盐诱导的细胞死亡 | 盐胁迫 | Hong et al., 2023 | | 水稻(Oryza sativa) | OsIRE1 | 调节热胁迫响应基因OsbZIP74的前体mRNA剪接 | 热胁迫 | Ling et al., 2021 | | 小麦(Triticum aestivum) | TaHSFA6e | TaHSFA6e的剪接变体可增强下游热休克蛋白基因的转录活性 | 热胁迫 | Wen et al., 2023 | | 毛白杨(Populus tomentosa) | PtoRSZ21 | 通过调节PtoATG2b的剪接影响植物的水分利用效率和抗逆能力 | 干旱胁迫 | Huang et al., 2024 | | 玉米(Zea mays) | ZmPP2C26 | ZmPP2C26的2个剪接变体负向调节干旱耐受性 | 干旱胁迫 | Lu et al., 2022 | | 茶树(Camellia sinensis) | CsWRKY21 | CsWRKY21的剪接变体抑制ABA分解相关基因的表达 | 冷胁迫 | Mi et al., 2024 | | 谷子(Setaria italica) | SiCYP19 | 剪接变体可以提高脯氨酸含量和促进活性氧清除 | 盐胁迫 | Zhang et al., 2024c | | 胡杨(Populus euphratica) | PeuHKT1;3 | 产生PeuHKT1;3a变体, 改变离子选择性 | 盐胁迫 | Lv et al., 2024 | | 大豆(Glycine max) | GmPeNTL9 | 剪接变体激活抗氧化清除系统 | 盐胁迫 | Liu et al., 2024 | | GmSnRK1.1 | 调节转录因子的活性和稳定性 | 盐胁迫 | Liu et al., 2023 |
View table in article
表1
不同植物响应非生物胁迫过程中涉及可变剪接的相关基因
正文中引用本图/表的段落
基因可变剪接事件通过调节响应非生物胁迫基因剪接变体活性和非活性亚型之间的比率, 调控胁迫关键调节因子的表达, 进而影响植物的非生物胁迫响应(Laloum et al., 2018)。大量研究表明, 非生物胁迫显著改变植物基因的可变剪接事件。例如, 在高温胁迫下葡萄(Vitis vinifera)叶片出现1 075个差异性剪接事件(Jiang et al., 2017)。冷胁迫诱导水稻(Oryza sativa)中出现大量的可变剪接事件, 且内含子保留是其中最主要的剪接类型(Zhong et al., 2024)。盐胁迫改变了拟南芥(Arabidopsis thaliana)中6 188个基因的可变剪接模式(Feng et al., 2015)。同时, 小麦(Triticum aestivum)在高温和干旱组合胁迫下产生963个可变剪接事件, 而在单独高温或单独干旱胁迫下几乎没有变化, 表明部分基因可变剪接事件可能受到多种非生物胁迫共同调控(Liu et al., 2018)。研究表明, 拟南芥在主要的非生物胁迫(热、冷、干旱和盐胁迫以及ABA处理)下, 其不同组织中基因可变剪接事件存在显著差异(Martín et al., 2021)。因此, 环境胁迫诱导和组织器官依赖的可变剪接事件是植物适应逆境的重要手段。本文综述了植物可变剪接的类型和机制, 重点阐述了可变剪接参与调控植物响应非生物胁迫的研究进展, 展望了该领域未来的研究方向。
SR蛋白包含1个或2个N端RNA识别基序型(RNA Recognition Motif, RRM) RNA结合结构域和1个长度可变的C端精氨酸/丝氨酸富集结构域(arginine/serine- rich domain, RS) (Manley and Tacke, 1996)。SR蛋白参与剪接体的组装过程, 通过结合到特定的剪接增强子或沉默子序列附近, 引导剪接体识别内含子和外显子边界, 进而影响剪接方式(Lopato et al., 1996)。SR蛋白为内含子剪接所必需, 可以促进U1 snRNP与5′剪接位点的结合(Zahler and Roth, 1995)。当SR蛋白结合在外显子上时, 通常促进外显子和剪接因子的结合, 起到剪接激活的作用; 而当其结合在内含子上时, 可能会抑制剪接。然而, 对于hnRNP (heterogeneous nuclear ribonucleoprotein)蛋白, 也有类似的位置依赖性剪接调控模式, 只是根据具体情况剪接模式有所不同(Erkelenz et al., 2013)。富含丝氨酸/精氨酸的剪接因子1 (serine/argininerich splicing factor 1, SRSF1)通过使用与RNA结合位点相反的表面将U1-70K (U1 snRNP 70K)的RRM桥接到前体mRNA, 参与介导早期的剪接体组装事件(Cho et al., 2011)。
SIZ1是最早在拟南芥中发现的一种SUMO E3连接酶, 参与调控剪接因子的SUMO化修饰, 进而调控植物响应热胁迫(Miura et al., 2005; Yunus and Lima, 2009)。随后的研究表明, SIZ1在拟南芥不同组织中广泛表达, 在高温胁迫下其表达水平升高。同时, 热胁迫下SIZ1通过SUMO化修饰调节转录因子的活性, 促进一些编码热休克蛋白的基因(如HSP70和HSP90)表达, 从而调节植物响应高温胁迫(Ishida et al., 2012)。在热胁迫下, 真菌SUMO化修饰某些剪接因子, 促进这些剪接因子在特定剪接位点富集, 从而改变前体mRNA的剪接模式, 这种改变可能有助于产生特定的mRNA异构体, 进而响应热胁迫(Jian et al., 2023)。研究发现, 拟南芥SIZ1剪接变体SSV2和SSV5在热应激下大量积累, 二者通过编码同种蛋白质, 在热应激条件下作为质膜中的SUMO E3连接酶发挥作用; SSV2介导热应激下细胞质膜蛋白或膜连接蛋白的类泛素化修饰, 从而调节它们的稳定性或功能。此外, 在拟南芥siz1-2突变体中表达SSV2基因可提高植株的耐热应激能力。这些结果表明, SIZ1剪接产物SSV2在调节拟南芥响应高温胁迫方面具有重要作用(Kwak et al., 2024)。
在拟南芥中, IRE1可以表达为2种异构体IRE1a和IRE1b。在热胁迫下, IRE1剪接变体IRE1b通过调节转录因子bZIP60前体mRNA剪接参与上调结合蛋白3 (BIP3)的表达, 进而减轻应激损伤。而IRE1a在感知到热胁迫后表达量立即下降, 之后逐渐恢复, 这表明热胁迫诱导的IRE1a下调会导致IRE1a信号通路终止, 以避免过度反应。IRE1b介导的可变剪接调控以热胁迫特定的方式进行, 在盐、缺氧和营养胁迫等其它胁迫下不会被激活。在水稻中, OsIRE1也调节热胁迫响应基因OsbZIP74的前体mRNA剪接。综上表明, IRE1介导的bZIP转录因子编码基因可变剪接调控植物响应热胁迫是一种相对保守的机制(Ling et al., 2021)。在小麦中, 热休克转录因子TaHSFA6e在热应激下可变剪接产生2个主要的功能转录本: TaHSFA6e-II和TaHSFA6e-III, 二者编码的蛋白增强了3个下游热休克蛋白70 (TaHSP70)基因的转录活性。此外, 小麦通过可变剪接产生TaHSFA2-III, 导致C端含14个氨基酸残基的肽增多, 可增强TaHSFA6e-III的转录活性(Wen et al., 2023)。
在冷胁迫下, 基因可变剪接受到调控元件的影响, 通过改变冷胁迫响应通路中相关基因的表达促进植物响应冷胁迫。例如, TAS1a是一种长链非编码RNA (long non-coding RNA, lncRNA), 其可变剪接仅受冷胁迫调控, TAS1a是对寒冷反应最快和最大的137个DAS基因之一, TAS1a基因的剪接形式在冷胁迫下发生变化, 剪接体减少, 导致成熟siRNA (small interfering RNA)的水平降低(Calixto et al., 2019)。RCF1是一种RNA解旋酶, 其通过维持冷响应相关基因前体mRNA剪接调节这些基因的表达, 进而影响植物的耐寒性, 特别是RCF1还与其它调节因子共同作用, 构成复杂的基因表达网络, 以调节植物对冷胁迫的响应(Guan et al., 2013)。SME1是拟南芥中与真核生物Sm环SmE亚基同源的蛋白质, SME1促进U1、U2、U4和U5 snRNA可变剪接积累, 对剪接体的组装和活性具有重要作用。在冷胁迫下, SME1调控冷响应相关基因。同时, 大多数受SME1调控的内含子保留事件导致产生具有NMD特征的mRNA, 表明SME1确保了冷响应基因中关键功能基因的转录本水平(Huertas et al., 2019)。CBFs通过SmEb依赖性前体mRNA可变剪接负向调节寒冷应激反应, 而SmEb通过BES1提供正反馈, 进而调节寒冷胁迫下CBF基因表达(Wang et al., 2022)。烟草(Nicotiana tabacum) ClNUM1基因产生的3个剪接变体增强了植株对胁迫的抗性并促进植物生长, 其中ClNUM1.1和ClNUM1.2增强了烟草的耐盐和耐低温能力, ClNUM1.3增强了耐低温能力(Zhang et al., 2024b)。这表明同一基因不同剪接变体在促进植物抗逆方面有相似之处, 但不同剪接变体的功能存在差异。
U1 snRNA是一种长度为60-300 bp的小RNA, 存在于真核生物的细胞核中, U1 snRNA在剪接过程中发挥重要作用, 参与识别5′剪接位点(Liu et al., 2020)。在干旱胁迫下, AtU1 snRNA过表达通过调控拟南芥干旱相关基因的表达响应干旱胁迫; 同时, 参与干旱胁迫响应和ABA信号通路的差异表达基因以及差异剪接基因显著增加。在干旱胁迫下, AtU1 snRNA过表达拟南芥植株表现出更强的耐受性, 包括主根变长和鲜重增加, 且过表达AtU1 snRNA植株中的前体mRNA剪接事件发生显著变化, 其中内含子保留最普遍。在干旱胁迫下, 可变5′剪接位点内G位点的识别受到影响, 导致异常剪接事件发生频率增高。同时, U1 snRNA能够加强对可变5′剪接位点中T位点的识别, 从而减少异常剪接事件的发生。干旱胁迫下, AtU1 snRNA影响AtSPCH的剪接模式, 导致气孔密度降低, 这有利于拟南芥减少水分蒸发进而响应干旱胁迫(Wang et al., 2024a)。上述研究表明, U1 snRNA在植物中通过多条途径响应干旱胁迫, 如调控干旱胁迫相关基因的表达、减少异常剪接事件发生以及改变前体mRNA剪接模式, 然而是否存在其它方面的调控机制尚待挖掘。
土壤盐碱化是一种重要的非生物胁迫, 由于盐碱化土壤中积累了大量的可溶性盐, 极大地限制了植物生长和生产力, 威胁全世界的作物产量和粮食安全(Zhou et al., 2024)。因此, 研究植物在盐胁迫下可变剪接的调控机制尤为重要。在盐胁迫下, 番茄根部基因可变剪接事件数量显著高于对照组, 其中外显子跳跃在盐处理样本中最为常见, 表明盐胁迫促进番茄根部的可变剪接变化(Gan et al., 2024)。研究发现, 盐胁迫下拟南芥中存在15个与可变剪接相关的剪接因子, 其中10个编码富含丝氨酸/精氨酸(SR)的蛋白质, 并且部分SR基因内含子保留减少, 导致异常转录本减少和功能转录本增加, 从而增强了植株对盐胁迫的耐受性(Ding et al., 2014)。在盐胁迫下的甘草(Glycyrrhiza uralensis)中, MPK4、RbohD、SnRK2和ETR2等基因通过可变剪接增加不同基因异构体的比例, 进而调节下游基因响应盐胁迫, 增强甘草对盐胁迫的耐受性(Yao et al., 2024)。最新研究发现, 水稻中存在一种新的剪接因子OsSCR106, 其可能与U2AF35相互作用, 参与调控胁迫相关基因3′剪接位点的选择, 从而调节水稻的耐盐性(Alhabsi et al., 2024)。上述研究表明, 在盐胁迫下, 不同植物主要通过基因可变剪接的方式提高对盐胁迫的耐受性(表1)。
拟南芥SR45.1亚型通过调节SOS基因的表达, 在调控离子稳态和赋予耐盐性方面起重要作用(Albaqami et al., 2019).镉胁迫下, 拟南芥剪接因子SR34b通过调控下游靶基因IRT1的剪接和稳定性, 增强IRT1蛋白的组成型积累, IRT1蛋白通过参与镉吸收过程增强镉耐受性(Zhang et al., 2014).拟南芥SAD1基因过表达显著提高了转基因植株中盐胁迫响应相关基因的剪接效率, 进而提高转基因植株的耐盐性(Cui et al., 2014).SKIP是植物剪接体的关键组分之一, 通过直接与剪接体的另一个组分SR45相互作用, 维持剪接体功能, 并调节基因可变剪接(Wang et al., 2012); 在盐胁迫下, 拟南芥SKIP通过调控剪接体靶向基因中可变5′端供体位点和可变3′端受体位点的识别或切割诱导全基因组可变剪接, 提高植株对盐胁迫的耐受性(Feng et al., 2015).拟南芥AtU1A是剪接体的组成部分, 负责识别前体mRNA的5′剪接位点, 同时AtU1A通过调节活性氧清除相关基因的剪接, 维持活性氧的平衡, 从而提高植株的盐胁迫耐受性(Gu et al., 2018).SiCYP19的2个可变剪接变体(SiCYP19-a和SiCYP19-b)均可增强谷子(Setaria italica)的耐盐性, 其中SiCYP19-b定位于线粒体, 通过提高脯氨酸含量和促进活性氧清除方式增强谷子的耐盐性(Zhang et al., 2024c).研究发现, 拟南芥Sm核心蛋白SmEb通过调控RCD1可变剪接减少盐诱导的细胞死亡, 从而增强植株的耐盐性(Hong et al., 2023).胡杨(Populus euphratica) PeuHKT1;3通过可变剪接产生PeuHKT1;3a变体, 进一步通过改变离子选择性提高对K+的亲和力, 增强植株在盐胁迫下的适应能力(Lv et al., 2024).GmNTL9和GmRSZ22剪接变体通过激活抗氧化清除系统提高大豆对碳酸氢盐胁迫的耐受性; GmRSZ22两种剪接变体均可与GmU1-70K相互作用, 可能调控盐胁迫响应基因的可变剪接过程(Liu et al., 2024).在盐胁迫下, GsSnRK1.1通过调节转录因子活性和稳定调控下游靶基因表达, 并调控离子平衡和渗透调节等生理过程, 进而提高植株的耐盐性(Liu et al., 2023).最新研究发现, 盐胁迫激活了拟南芥SnRK1激酶, 使其磷酸化SRRM1L, 随后SRRM1L与U1-70K相互作用进入剪接体, 调控NFYA10前体mRNA可变剪接, 产生功能性NFYA10.1变体, 而NFYA10.1过表达可增强拟南芥对盐胁迫的抗性(Sun et al., 2024).上述研究表明, 基因可变剪接调控植物响应盐胁迫主要通过以下2条途径进行: 一是mRNA剪接体或剪接组分通过调节盐胁迫响应相关基因的表达增强植物的耐盐性; 二是剪接体通过直接参与分子网络调控途径增强耐盐性. ...
拟南芥SR45.1亚型通过调节SOS基因的表达, 在调控离子稳态和赋予耐盐性方面起重要作用(Albaqami et al., 2019).镉胁迫下, 拟南芥剪接因子SR34b通过调控下游靶基因IRT1的剪接和稳定性, 增强IRT1蛋白的组成型积累, IRT1蛋白通过参与镉吸收过程增强镉耐受性(Zhang et al., 2014).拟南芥SAD1基因过表达显著提高了转基因植株中盐胁迫响应相关基因的剪接效率, 进而提高转基因植株的耐盐性(Cui et al., 2014).SKIP是植物剪接体的关键组分之一, 通过直接与剪接体的另一个组分SR45相互作用, 维持剪接体功能, 并调节基因可变剪接(Wang et al., 2012); 在盐胁迫下, 拟南芥SKIP通过调控剪接体靶向基因中可变5′端供体位点和可变3′端受体位点的识别或切割诱导全基因组可变剪接, 提高植株对盐胁迫的耐受性(Feng et al., 2015).拟南芥AtU1A是剪接体的组成部分, 负责识别前体mRNA的5′剪接位点, 同时AtU1A通过调节活性氧清除相关基因的剪接, 维持活性氧的平衡, 从而提高植株的盐胁迫耐受性(Gu et al., 2018).SiCYP19的2个可变剪接变体(SiCYP19-a和SiCYP19-b)均可增强谷子(Setaria italica)的耐盐性, 其中SiCYP19-b定位于线粒体, 通过提高脯氨酸含量和促进活性氧清除方式增强谷子的耐盐性(Zhang et al., 2024c).研究发现, 拟南芥Sm核心蛋白SmEb通过调控RCD1可变剪接减少盐诱导的细胞死亡, 从而增强植株的耐盐性(Hong et al., 2023).胡杨(Populus euphratica) PeuHKT1;3通过可变剪接产生PeuHKT1;3a变体, 进一步通过改变离子选择性提高对K+的亲和力, 增强植株在盐胁迫下的适应能力(Lv et al., 2024).GmNTL9和GmRSZ22剪接变体通过激活抗氧化清除系统提高大豆对碳酸氢盐胁迫的耐受性; GmRSZ22两种剪接变体均可与GmU1-70K相互作用, 可能调控盐胁迫响应基因的可变剪接过程(Liu et al., 2024).在盐胁迫下, GsSnRK1.1通过调节转录因子活性和稳定调控下游靶基因表达, 并调控离子平衡和渗透调节等生理过程, 进而提高植株的耐盐性(Liu et al., 2023).最新研究发现, 盐胁迫激活了拟南芥SnRK1激酶, 使其磷酸化SRRM1L, 随后SRRM1L与U1-70K相互作用进入剪接体, 调控NFYA10前体mRNA可变剪接, 产生功能性NFYA10.1变体, 而NFYA10.1过表达可增强拟南芥对盐胁迫的抗性(Sun et al., 2024).上述研究表明, 基因可变剪接调控植物响应盐胁迫主要通过以下2条途径进行: 一是mRNA剪接体或剪接组分通过调节盐胁迫响应相关基因的表达增强植物的耐盐性; 二是剪接体通过直接参与分子网络调控途径增强耐盐性. ... 1 2022 ... 植物SR基因可变剪接在不同类型植物中响应干旱胁迫的调控机制具有保守性.拟南芥AtSR45a和AtSR30的表达和可变剪接受环境胁迫调控, 在应对环境胁迫方面发挥重要作用(Tanabe et al., 2007).在干旱胁迫下, 木薯部分SR基因的剪接模式发生变化, 表明SR蛋白可能在木薯响应干旱胁迫中发挥作用(Gu et al., 2020).在干旱胁迫下, 芜菁(Brassica rapa) BrSR45a基因过表达会改变干旱响应基因的剪接模式, 促进植物响应热胁迫.同时, BrSR45a表达改变还调控U2AF在干旱胁迫响应中的剪接模式(Muthusamy et al., 2020).毛白杨(Populus tomentosa) PtoRSZ21是一种丝氨酸/精氨酸富集的剪接因子, 参与调控基因的可变剪接过程, 通过与核心剪接因子PtoU1-70K结合, 确保剪接过程的准确性和高效性.干旱胁迫下, 毛白杨PtoRSZ21作为正向调节因子, 通过调控PtoATG2b的剪接影响植物水分利用效率和抗逆能力(Huang et al., 2024).在干旱胁迫下, 拟南芥中过表达木薯RSZ家族成员MeRSZ21b基因, 能促进拟南芥气孔关闭; 此外, MeRSZ21b还通过减少超氧化物自由基的积累和维持渗透压在响应干旱胁迫中发挥积极作用(Chen et al., 2022).上述研究表明, SR基因的表达和可变剪接可能是不同植物干旱胁迫响应的保守机制.然而, 不同植物中RSZ家族在干旱胁迫下的调节机制有待进一步阐明. ... Interaction between the RNA binding domains of Ser-Arg splicing factor 1 and U1-70K snRNP protein determines early spliceosome assembly 1 2011 ... SR蛋白包含1个或2个N端RNA识别基序型(RNA Recognition Motif, RRM) RNA结合结构域和1个长度可变的C端精氨酸/丝氨酸富集结构域(arginine/serine- rich domain, RS) (Manley and Tacke, 1996).SR蛋白参与剪接体的组装过程, 通过结合到特定的剪接增强子或沉默子序列附近, 引导剪接体识别内含子和外显子边界, 进而影响剪接方式(Lopato et al., 1996).SR蛋白为内含子剪接所必需, 可以促进U1 snRNP与5′剪接位点的结合(Zahler and Roth, 1995).当SR蛋白结合在外显子上时, 通常促进外显子和剪接因子的结合, 起到剪接激活的作用; 而当其结合在内含子上时, 可能会抑制剪接.然而, 对于hnRNP (heterogeneous nuclear ribonucleoprotein)蛋白, 也有类似的位置依赖性剪接调控模式, 只是根据具体情况剪接模式有所不同(Erkelenz et al., 2013).富含丝氨酸/精氨酸的剪接因子1 (serine/argininerich splicing factor 1, SRSF1)通过使用与RNA结合位点相反的表面将U1-70K (U1 snRNP 70K)的RRM桥接到前体mRNA, 参与介导早期的剪接体组装事件(Cho et al., 2011). ... 2 2014 ... Alternative splicing-related genes involved in regulating plant responses to abiotic stress in different species
拟南芥SR45.1亚型通过调节SOS基因的表达, 在调控离子稳态和赋予耐盐性方面起重要作用(Albaqami et al., 2019).镉胁迫下, 拟南芥剪接因子SR34b通过调控下游靶基因IRT1的剪接和稳定性, 增强IRT1蛋白的组成型积累, IRT1蛋白通过参与镉吸收过程增强镉耐受性(Zhang et al., 2014).拟南芥SAD1基因过表达显著提高了转基因植株中盐胁迫响应相关基因的剪接效率, 进而提高转基因植株的耐盐性(Cui et al., 2014).SKIP是植物剪接体的关键组分之一, 通过直接与剪接体的另一个组分SR45相互作用, 维持剪接体功能, 并调节基因可变剪接(Wang et al., 2012); 在盐胁迫下, 拟南芥SKIP通过调控剪接体靶向基因中可变5′端供体位点和可变3′端受体位点的识别或切割诱导全基因组可变剪接, 提高植株对盐胁迫的耐受性(Feng et al., 2015).拟南芥AtU1A是剪接体的组成部分, 负责识别前体mRNA的5′剪接位点, 同时AtU1A通过调节活性氧清除相关基因的剪接, 维持活性氧的平衡, 从而提高植株的盐胁迫耐受性(Gu et al., 2018).SiCYP19的2个可变剪接变体(SiCYP19-a和SiCYP19-b)均可增强谷子(Setaria italica)的耐盐性, 其中SiCYP19-b定位于线粒体, 通过提高脯氨酸含量和促进活性氧清除方式增强谷子的耐盐性(Zhang et al., 2024c).研究发现, 拟南芥Sm核心蛋白SmEb通过调控RCD1可变剪接减少盐诱导的细胞死亡, 从而增强植株的耐盐性(Hong et al., 2023).胡杨(Populus euphratica) PeuHKT1;3通过可变剪接产生PeuHKT1;3a变体, 进一步通过改变离子选择性提高对K+的亲和力, 增强植株在盐胁迫下的适应能力(Lv et al., 2024).GmNTL9和GmRSZ22剪接变体通过激活抗氧化清除系统提高大豆对碳酸氢盐胁迫的耐受性; GmRSZ22两种剪接变体均可与GmU1-70K相互作用, 可能调控盐胁迫响应基因的可变剪接过程(Liu et al., 2024).在盐胁迫下, GsSnRK1.1通过调节转录因子活性和稳定调控下游靶基因表达, 并调控离子平衡和渗透调节等生理过程, 进而提高植株的耐盐性(Liu et al., 2023).最新研究发现, 盐胁迫激活了拟南芥SnRK1激酶, 使其磷酸化SRRM1L, 随后SRRM1L与U1-70K相互作用进入剪接体, 调控NFYA10前体mRNA可变剪接, 产生功能性NFYA10.1变体, 而NFYA10.1过表达可增强拟南芥对盐胁迫的抗性(Sun et al., 2024).上述研究表明, 基因可变剪接调控植物响应盐胁迫主要通过以下2条途径进行: 一是mRNA剪接体或剪接组分通过调节盐胁迫响应相关基因的表达增强植物的耐盐性; 二是剪接体通过直接参与分子网络调控途径增强耐盐性. ...
拟南芥SR45.1亚型通过调节SOS基因的表达, 在调控离子稳态和赋予耐盐性方面起重要作用(Albaqami et al., 2019).镉胁迫下, 拟南芥剪接因子SR34b通过调控下游靶基因IRT1的剪接和稳定性, 增强IRT1蛋白的组成型积累, IRT1蛋白通过参与镉吸收过程增强镉耐受性(Zhang et al., 2014).拟南芥SAD1基因过表达显著提高了转基因植株中盐胁迫响应相关基因的剪接效率, 进而提高转基因植株的耐盐性(Cui et al., 2014).SKIP是植物剪接体的关键组分之一, 通过直接与剪接体的另一个组分SR45相互作用, 维持剪接体功能, 并调节基因可变剪接(Wang et al., 2012); 在盐胁迫下, 拟南芥SKIP通过调控剪接体靶向基因中可变5′端供体位点和可变3′端受体位点的识别或切割诱导全基因组可变剪接, 提高植株对盐胁迫的耐受性(Feng et al., 2015).拟南芥AtU1A是剪接体的组成部分, 负责识别前体mRNA的5′剪接位点, 同时AtU1A通过调节活性氧清除相关基因的剪接, 维持活性氧的平衡, 从而提高植株的盐胁迫耐受性(Gu et al., 2018).SiCYP19的2个可变剪接变体(SiCYP19-a和SiCYP19-b)均可增强谷子(Setaria italica)的耐盐性, 其中SiCYP19-b定位于线粒体, 通过提高脯氨酸含量和促进活性氧清除方式增强谷子的耐盐性(Zhang et al., 2024c).研究发现, 拟南芥Sm核心蛋白SmEb通过调控RCD1可变剪接减少盐诱导的细胞死亡, 从而增强植株的耐盐性(Hong et al., 2023).胡杨(Populus euphratica) PeuHKT1;3通过可变剪接产生PeuHKT1;3a变体, 进一步通过改变离子选择性提高对K+的亲和力, 增强植株在盐胁迫下的适应能力(Lv et al., 2024).GmNTL9和GmRSZ22剪接变体通过激活抗氧化清除系统提高大豆对碳酸氢盐胁迫的耐受性; GmRSZ22两种剪接变体均可与GmU1-70K相互作用, 可能调控盐胁迫响应基因的可变剪接过程(Liu et al., 2024).在盐胁迫下, GsSnRK1.1通过调节转录因子活性和稳定调控下游靶基因表达, 并调控离子平衡和渗透调节等生理过程, 进而提高植株的耐盐性(Liu et al., 2023).最新研究发现, 盐胁迫激活了拟南芥SnRK1激酶, 使其磷酸化SRRM1L, 随后SRRM1L与U1-70K相互作用进入剪接体, 调控NFYA10前体mRNA可变剪接, 产生功能性NFYA10.1变体, 而NFYA10.1过表达可增强拟南芥对盐胁迫的抗性(Sun et al., 2024).上述研究表明, 基因可变剪接调控植物响应盐胁迫主要通过以下2条途径进行: 一是mRNA剪接体或剪接组分通过调节盐胁迫响应相关基因的表达增强植物的耐盐性; 二是剪接体通过直接参与分子网络调控途径增强耐盐性. ... 1 2014 ... 土壤盐碱化是一种重要的非生物胁迫, 由于盐碱化土壤中积累了大量的可溶性盐, 极大地限制了植物生长和生产力, 威胁全世界的作物产量和粮食安全(Zhou et al., 2024).因此, 研究植物在盐胁迫下可变剪接的调控机制尤为重要.在盐胁迫下, 番茄根部基因可变剪接事件数量显著高于对照组, 其中外显子跳跃在盐处理样本中最为常见, 表明盐胁迫促进番茄根部的可变剪接变化(Gan et al., 2024).研究发现, 盐胁迫下拟南芥中存在15个与可变剪接相关的剪接因子, 其中10个编码富含丝氨酸/精氨酸(SR)的蛋白质, 并且部分SR基因内含子保留减少, 导致异常转录本减少和功能转录本增加, 从而增强了植株对盐胁迫的耐受性(Ding et al., 2014).在盐胁迫下的甘草(Glycyrrhiza uralensis)中, MPK4、RbohD、SnRK2和ETR2等基因通过可变剪接增加不同基因异构体的比例, 进而调节下游基因响应盐胁迫, 增强甘草对盐胁迫的耐受性(Yao et al., 2024).最新研究发现, 水稻中存在一种新的剪接因子OsSCR106, 其可能与U2AF35相互作用, 参与调控胁迫相关基因3′剪接位点的选择, 从而调节水稻的耐盐性(Alhabsi et al., 2024).上述研究表明, 在盐胁迫下, 不同植物主要通过基因可变剪接的方式提高对盐胁迫的耐受性(表1). ... Differential regulation of transcript accumulation and alternative splicing of a DREB2 homolog under abiotic stress conditions in common wheat 1 2006 ... 基因可变剪接是植物转录组重编程以响应冷胁迫的主要方式(Calixto et al., 2018).可变剪接调控植物响应冷胁迫的研究最早在小麦中开展.研究发现,在冷胁迫下小麦中DREB2同源基因发生可变剪接, 产生不同的剪接变体, 而这些剪接变体可能影响植物对冷胁迫的响应(Egawa et al., 2006).可变剪接可能会影响靶基因的表达, 从而促进冷驯化过程(Calixto et al., 2019).剪接因子丰度和活性变化决定了下游基因的可变剪接模式: 在冷胁迫下, 拟南芥通过调节SR和hnRNP基因的可变剪接, 使剪接因子丰度和活性发生动态变化, 影响靶基因的表达, 进而响应冷胁迫(Syed et al., 2012).研究表明, 一些转录因子基因可变剪接会产生小干扰肽(small interfering peptide, siPEP), 这些小干扰肽通过肽干扰(peptide interference, PEPi)负向调节靶转录因子, 构成植物冷胁迫响应的调节回路.同时, 多种转录因子通过可变剪接产生的部分剪接异构体具有更强的DNA结合能力, 能够更有效地调控下游基因的表达, 而另一些异构体通过特异的蛋白质互作方式, 影响植物对低温胁迫的响应(Seo et al., 2013).可变剪接通过差异性调控不同功能剪接体的比例响应冷胁迫.例如, 在冷胁迫下, 木薯(Manihot esculenta)中5种主要亚型的可变剪接事件数量均大幅增加, 其中对冷胁迫有特异响应的内含子保留和可变3′端受体位点类型显著增加.而在冷诱导下, SR基因mRNA产物通过反作用方式改变下游靶标基因的剪接, 进而导致响应冷胁迫下的整体转录组发生变化(Li et al., 2020).上述研究表明, 植物通过基因可变剪接响应冷胁迫主要有2种方式: 一种是通过影响下游靶基因的表达响应冷胁迫; 另一种是通过剪接异构体与DNA结合或与蛋白质相互作用响应冷胁迫. ... Position-dependent splicing activation and repression by SR and hnRNP proteins rely on common mechanisms 1 2013 ... SR蛋白包含1个或2个N端RNA识别基序型(RNA Recognition Motif, RRM) RNA结合结构域和1个长度可变的C端精氨酸/丝氨酸富集结构域(arginine/serine- rich domain, RS) (Manley and Tacke, 1996).SR蛋白参与剪接体的组装过程, 通过结合到特定的剪接增强子或沉默子序列附近, 引导剪接体识别内含子和外显子边界, 进而影响剪接方式(Lopato et al., 1996).SR蛋白为内含子剪接所必需, 可以促进U1 snRNP与5′剪接位点的结合(Zahler and Roth, 1995).当SR蛋白结合在外显子上时, 通常促进外显子和剪接因子的结合, 起到剪接激活的作用; 而当其结合在内含子上时, 可能会抑制剪接.然而, 对于hnRNP (heterogeneous nuclear ribonucleoprotein)蛋白, 也有类似的位置依赖性剪接调控模式, 只是根据具体情况剪接模式有所不同(Erkelenz et al., 2013).富含丝氨酸/精氨酸的剪接因子1 (serine/argininerich splicing factor 1, SRSF1)通过使用与RNA结合位点相反的表面将U1-70K (U1 snRNP 70K)的RRM桥接到前体mRNA, 参与介导早期的剪接体组装事件(Cho et al., 2011). ... Radically rethinking agriculture for the 21st century 1 2010 ... 植物生长发育过程经常遭受各种非生物胁迫(如高温、低温、干旱和盐胁迫), 近年来频繁出现的极端气候加剧了这些非生物胁迫对植物生长发育的不利影响.植物在长期演化过程中进化出一系列分子调控机制以响应各种非生物胁迫(Yamaguchi-Shinozaki and Shinozaki, 2006; Fedoroff et al., 2010).基因可变剪接是植物响应逆境胁迫的重要调控机制之一.其中, 组成型剪接(constitutive splicing, CS)是指前体mRNA的非编码内含子区被去除, 外显子通过酯化反应连接, 获得基因初级转录本的过程; 当前体mRNA发生差异性剪接时, 会产生可变剪接(alternative splicing, AS), 因此可变剪接是前体mRNA外显子以不同剪接方式产生不同结构和功能的mRNA和蛋白质变体的过程(Lorkovi? et al., 2000; Blencowe, 2006; Matera and Wang, 2014).前体mRNA可变剪接是一种用途广泛的调节机制, 它可以影响基因表达精准调控机制, 实现蛋白质功能多样化, 进而调节植物的生长发育过程; 特别是可变剪接从单个多外显子基因产生多种mRNA亚型, 增强了蛋白质组多样性, 并在植物响应各种胁迫中发挥重要作用(Staiger and Brown, 2013). ... 3 2015 ... 基因可变剪接事件通过调节响应非生物胁迫基因剪接变体活性和非活性亚型之间的比率, 调控胁迫关键调节因子的表达, 进而影响植物的非生物胁迫响应(Laloum et al., 2018).大量研究表明, 非生物胁迫显著改变植物基因的可变剪接事件.例如, 在高温胁迫下葡萄(Vitis vinifera)叶片出现1 075个差异性剪接事件(Jiang et al., 2017).冷胁迫诱导水稻(Oryza sativa)中出现大量的可变剪接事件, 且内含子保留是其中最主要的剪接类型(Zhong et al., 2024).盐胁迫改变了拟南芥(Arabidopsis thaliana)中6 188个基因的可变剪接模式(Feng et al., 2015).同时, 小麦(Triticum aestivum)在高温和干旱组合胁迫下产生963个可变剪接事件, 而在单独高温或单独干旱胁迫下几乎没有变化, 表明部分基因可变剪接事件可能受到多种非生物胁迫共同调控(Liu et al., 2018).研究表明, 拟南芥在主要的非生物胁迫(热、冷、干旱和盐胁迫以及ABA处理)下, 其不同组织中基因可变剪接事件存在显著差异(Martín et al., 2021).因此, 环境胁迫诱导和组织器官依赖的可变剪接事件是植物适应逆境的重要手段.本文综述了植物可变剪接的类型和机制, 重点阐述了可变剪接参与调控植物响应非生物胁迫的研究进展, 展望了该领域未来的研究方向. ...
拟南芥SR45.1亚型通过调节SOS基因的表达, 在调控离子稳态和赋予耐盐性方面起重要作用(Albaqami et al., 2019).镉胁迫下, 拟南芥剪接因子SR34b通过调控下游靶基因IRT1的剪接和稳定性, 增强IRT1蛋白的组成型积累, IRT1蛋白通过参与镉吸收过程增强镉耐受性(Zhang et al., 2014).拟南芥SAD1基因过表达显著提高了转基因植株中盐胁迫响应相关基因的剪接效率, 进而提高转基因植株的耐盐性(Cui et al., 2014).SKIP是植物剪接体的关键组分之一, 通过直接与剪接体的另一个组分SR45相互作用, 维持剪接体功能, 并调节基因可变剪接(Wang et al., 2012); 在盐胁迫下, 拟南芥SKIP通过调控剪接体靶向基因中可变5′端供体位点和可变3′端受体位点的识别或切割诱导全基因组可变剪接, 提高植株对盐胁迫的耐受性(Feng et al., 2015).拟南芥AtU1A是剪接体的组成部分, 负责识别前体mRNA的5′剪接位点, 同时AtU1A通过调节活性氧清除相关基因的剪接, 维持活性氧的平衡, 从而提高植株的盐胁迫耐受性(Gu et al., 2018).SiCYP19的2个可变剪接变体(SiCYP19-a和SiCYP19-b)均可增强谷子(Setaria italica)的耐盐性, 其中SiCYP19-b定位于线粒体, 通过提高脯氨酸含量和促进活性氧清除方式增强谷子的耐盐性(Zhang et al., 2024c).研究发现, 拟南芥Sm核心蛋白SmEb通过调控RCD1可变剪接减少盐诱导的细胞死亡, 从而增强植株的耐盐性(Hong et al., 2023).胡杨(Populus euphratica) PeuHKT1;3通过可变剪接产生PeuHKT1;3a变体, 进一步通过改变离子选择性提高对K+的亲和力, 增强植株在盐胁迫下的适应能力(Lv et al., 2024).GmNTL9和GmRSZ22剪接变体通过激活抗氧化清除系统提高大豆对碳酸氢盐胁迫的耐受性; GmRSZ22两种剪接变体均可与GmU1-70K相互作用, 可能调控盐胁迫响应基因的可变剪接过程(Liu et al., 2024).在盐胁迫下, GsSnRK1.1通过调节转录因子活性和稳定调控下游靶基因表达, 并调控离子平衡和渗透调节等生理过程, 进而提高植株的耐盐性(Liu et al., 2023).最新研究发现, 盐胁迫激活了拟南芥SnRK1激酶, 使其磷酸化SRRM1L, 随后SRRM1L与U1-70K相互作用进入剪接体, 调控NFYA10前体mRNA可变剪接, 产生功能性NFYA10.1变体, 而NFYA10.1过表达可增强拟南芥对盐胁迫的抗性(Sun et al., 2024).上述研究表明, 基因可变剪接调控植物响应盐胁迫主要通过以下2条途径进行: 一是mRNA剪接体或剪接组分通过调节盐胁迫响应相关基因的表达增强植物的耐盐性; 二是剪接体通过直接参与分子网络调控途径增强耐盐性. ...
拟南芥SR45.1亚型通过调节SOS基因的表达, 在调控离子稳态和赋予耐盐性方面起重要作用(Albaqami et al., 2019).镉胁迫下, 拟南芥剪接因子SR34b通过调控下游靶基因IRT1的剪接和稳定性, 增强IRT1蛋白的组成型积累, IRT1蛋白通过参与镉吸收过程增强镉耐受性(Zhang et al., 2014).拟南芥SAD1基因过表达显著提高了转基因植株中盐胁迫响应相关基因的剪接效率, 进而提高转基因植株的耐盐性(Cui et al., 2014).SKIP是植物剪接体的关键组分之一, 通过直接与剪接体的另一个组分SR45相互作用, 维持剪接体功能, 并调节基因可变剪接(Wang et al., 2012); 在盐胁迫下, 拟南芥SKIP通过调控剪接体靶向基因中可变5′端供体位点和可变3′端受体位点的识别或切割诱导全基因组可变剪接, 提高植株对盐胁迫的耐受性(Feng et al., 2015).拟南芥AtU1A是剪接体的组成部分, 负责识别前体mRNA的5′剪接位点, 同时AtU1A通过调节活性氧清除相关基因的剪接, 维持活性氧的平衡, 从而提高植株的盐胁迫耐受性(Gu et al., 2018).SiCYP19的2个可变剪接变体(SiCYP19-a和SiCYP19-b)均可增强谷子(Setaria italica)的耐盐性, 其中SiCYP19-b定位于线粒体, 通过提高脯氨酸含量和促进活性氧清除方式增强谷子的耐盐性(Zhang et al., 2024c).研究发现, 拟南芥Sm核心蛋白SmEb通过调控RCD1可变剪接减少盐诱导的细胞死亡, 从而增强植株的耐盐性(Hong et al., 2023).胡杨(Populus euphratica) PeuHKT1;3通过可变剪接产生PeuHKT1;3a变体, 进一步通过改变离子选择性提高对K+的亲和力, 增强植株在盐胁迫下的适应能力(Lv et al., 2024).GmNTL9和GmRSZ22剪接变体通过激活抗氧化清除系统提高大豆对碳酸氢盐胁迫的耐受性; GmRSZ22两种剪接变体均可与GmU1-70K相互作用, 可能调控盐胁迫响应基因的可变剪接过程(Liu et al., 2024).在盐胁迫下, GsSnRK1.1通过调节转录因子活性和稳定调控下游靶基因表达, 并调控离子平衡和渗透调节等生理过程, 进而提高植株的耐盐性(Liu et al., 2023).最新研究发现, 盐胁迫激活了拟南芥SnRK1激酶, 使其磷酸化SRRM1L, 随后SRRM1L与U1-70K相互作用进入剪接体, 调控NFYA10前体mRNA可变剪接, 产生功能性NFYA10.1变体, 而NFYA10.1过表达可增强拟南芥对盐胁迫的抗性(Sun et al., 2024).上述研究表明, 基因可变剪接调控植物响应盐胁迫主要通过以下2条途径进行: 一是mRNA剪接体或剪接组分通过调节盐胁迫响应相关基因的表达增强植物的耐盐性; 二是剪接体通过直接参与分子网络调控途径增强耐盐性. ...
拟南芥SR45.1亚型通过调节SOS基因的表达, 在调控离子稳态和赋予耐盐性方面起重要作用(Albaqami et al., 2019).镉胁迫下, 拟南芥剪接因子SR34b通过调控下游靶基因IRT1的剪接和稳定性, 增强IRT1蛋白的组成型积累, IRT1蛋白通过参与镉吸收过程增强镉耐受性(Zhang et al., 2014).拟南芥SAD1基因过表达显著提高了转基因植株中盐胁迫响应相关基因的剪接效率, 进而提高转基因植株的耐盐性(Cui et al., 2014).SKIP是植物剪接体的关键组分之一, 通过直接与剪接体的另一个组分SR45相互作用, 维持剪接体功能, 并调节基因可变剪接(Wang et al., 2012); 在盐胁迫下, 拟南芥SKIP通过调控剪接体靶向基因中可变5′端供体位点和可变3′端受体位点的识别或切割诱导全基因组可变剪接, 提高植株对盐胁迫的耐受性(Feng et al., 2015).拟南芥AtU1A是剪接体的组成部分, 负责识别前体mRNA的5′剪接位点, 同时AtU1A通过调节活性氧清除相关基因的剪接, 维持活性氧的平衡, 从而提高植株的盐胁迫耐受性(Gu et al., 2018).SiCYP19的2个可变剪接变体(SiCYP19-a和SiCYP19-b)均可增强谷子(Setaria italica)的耐盐性, 其中SiCYP19-b定位于线粒体, 通过提高脯氨酸含量和促进活性氧清除方式增强谷子的耐盐性(Zhang et al., 2024c).研究发现, 拟南芥Sm核心蛋白SmEb通过调控RCD1可变剪接减少盐诱导的细胞死亡, 从而增强植株的耐盐性(Hong et al., 2023).胡杨(Populus euphratica) PeuHKT1;3通过可变剪接产生PeuHKT1;3a变体, 进一步通过改变离子选择性提高对K+的亲和力, 增强植株在盐胁迫下的适应能力(Lv et al., 2024).GmNTL9和GmRSZ22剪接变体通过激活抗氧化清除系统提高大豆对碳酸氢盐胁迫的耐受性; GmRSZ22两种剪接变体均可与GmU1-70K相互作用, 可能调控盐胁迫响应基因的可变剪接过程(Liu et al., 2024).在盐胁迫下, GsSnRK1.1通过调节转录因子活性和稳定调控下游靶基因表达, 并调控离子平衡和渗透调节等生理过程, 进而提高植株的耐盐性(Liu et al., 2023).最新研究发现, 盐胁迫激活了拟南芥SnRK1激酶, 使其磷酸化SRRM1L, 随后SRRM1L与U1-70K相互作用进入剪接体, 调控NFYA10前体mRNA可变剪接, 产生功能性NFYA10.1变体, 而NFYA10.1过表达可增强拟南芥对盐胁迫的抗性(Sun et al., 2024).上述研究表明, 基因可变剪接调控植物响应盐胁迫主要通过以下2条途径进行: 一是mRNA剪接体或剪接组分通过调节盐胁迫响应相关基因的表达增强植物的耐盐性; 二是剪接体通过直接参与分子网络调控途径增强耐盐性. ... Arabidopsis SME1 regulates plant development and response to abiotic stress by determining spliceosome activity specificity 1 2019 ... 在冷胁迫下, 基因可变剪接受到调控元件的影响, 通过改变冷胁迫响应通路中相关基因的表达促进植物响应冷胁迫.例如, TAS1a是一种长链非编码RNA (long non-coding RNA, lncRNA), 其可变剪接仅受冷胁迫调控, TAS1a是对寒冷反应最快和最大的137个DAS基因之一, TAS1a基因的剪接形式在冷胁迫下发生变化, 剪接体减少, 导致成熟siRNA (small interfering RNA)的水平降低(Calixto et al., 2019).RCF1是一种RNA解旋酶, 其通过维持冷响应相关基因前体mRNA剪接调节这些基因的表达, 进而影响植物的耐寒性, 特别是RCF1还与其它调节因子共同作用, 构成复杂的基因表达网络, 以调节植物对冷胁迫的响应(Guan et al., 2013).SME1是拟南芥中与真核生物Sm环SmE亚基同源的蛋白质, SME1促进U1、U2、U4和U5 snRNA可变剪接积累, 对剪接体的组装和活性具有重要作用.在冷胁迫下, SME1调控冷响应相关基因.同时, 大多数受SME1调控的内含子保留事件导致产生具有NMD特征的mRNA, 表明SME1确保了冷响应基因中关键功能基因的转录本水平(Huertas et al., 2019).CBFs通过SmEb依赖性前体mRNA可变剪接负向调节寒冷应激反应, 而SmEb通过BES1提供正反馈, 进而调节寒冷胁迫下CBF基因表达(Wang et al., 2022).烟草(Nicotiana tabacum) ClNUM1基因产生的3个剪接变体增强了植株对胁迫的抗性并促进植物生长, 其中ClNUM1.1和ClNUM1.2增强了烟草的耐盐和耐低温能力, ClNUM1.3增强了耐低温能力(Zhang et al., 2024b).这表明同一基因不同剪接变体在促进植物抗逆方面有相似之处, 但不同剪接变体的功能存在差异. ... Arabidopsis HsfB1 and HsfB2b act as repressors of the expression of heat-inducible Hsfs but positively regulate the acquired thermotolerance 1 2011 ... 热胁迫是一种典型的非生物胁迫, 引起光合作用和呼吸作用变化, 导致植物生命周期缩短和生产能力降低(Barnabás et al., 2008).因此, 研究基因可变剪接如何调节植物响应热胁迫具有重要的生物学意义.植物在面对高温等环境胁迫时, 会通过一系列生理过程来应对高温胁迫, 如SR蛋白介导的前体mRNA调控(图2), 进而启动热休克反应(heat shock response, HSR), 包括激活热休克转录因子(heat shock factor, HSF)和产生热休克蛋白(heat shock protein, HSP).在热胁迫下, 植物中的HSF调控HSP表达, 使得植物合成足够的HSPs, 以应对热应激带来的挑战, 增强耐热性(Rosenkranz et al., 2024).在拟南芥中, HsfA2在热应激下会发生可变剪接, 产生包含提前终止密码子的剪接变体(如HsfA2-II) (Palusa and Reddy, 2015).研究发现, 在多种非生物胁迫(包括热胁迫)下HsfA2表达的诱导在A类HSF中最高, 这表明HsfA2是非生物胁迫下诱导防御系统的关键调节因子(Nishizawa et al., 2006).在热胁迫下, 拟南芥HsfA2正向调节一些被HsfA1初始诱导后的热诱导基因表达, 进而延长拟南芥获得耐热性的持续时间, 且HsfA2在维持热休克反应中具有主导作用, 而其它一些Hsfs (如HsfB1)在持续获得耐热性的调控中并非必需(Charng et al., 2007).拟南芥的2个热休克转录因子HsfB1和HsfB2b作为转录抑制因子负向调节热诱导的HSFs和HSPs (Ikeda et al., 2011).苜蓿(Medicago sativa)中HSF1基因可变剪接模式决定了其翻译产物能否结合到下游基因的热激元件(heat shock elements, HSEs)上, 进而影响热响应基因的激活(Ling et al., 2021).拟南芥HSFA2受到热胁迫时产生可变剪接调节.例如, 拟南芥幼苗暴露于不同强度热胁迫下会导致HSFA2前体mRNA上的外显子跳跃或内含子保留, 并产生不同比例的HSFA2 mRNA亚型: HSFA2-I、HSFA2-II和HSFA2-III.其中, HSFA2-III被认为参与HSFA2表达的自动调节, 从而响应热胁迫.热激蛋白是植物应对热应激的重要保护分子, 对于提高植物耐热性具有重要作用.在热应激下, 可变剪接调控热激蛋白基因表达, 促进热激蛋白合成, 进而增强植物的耐热性(Ling et al., 2017).在严重热激下, HsfA2产生新的剪接变体HsfA2-III, HsfA2-III编码S-HsfA2, 形成一个正向的自调控环, S-HsfA2可激活HsfA2基因的表达, 使内源完全剪接的HsfA2积累水平大幅提高(Liu et al., 2013).研究表明, 在热胁迫条件下, 大量被子植物HSF基因家族成员(如番茄(Solanum lycopersicum) SlHSFA2、玉米(Zea mays) ZmHSFA2B以及百合(Lilium spp.) LsHSFA3)的可变剪接事件显著提高了植株的抗逆性, 推测植物HSF基因家族成员可变剪接属于一种保守的热胁迫应答机制(Wu et al., 2019; Rosenkranz et al., 2024; Song et al., 2025). ... 1 2013 ... 干旱是影响植物生长发育、生存和作物生产力最重要的因素之一, 对农业可持续发展构成重大威胁(Ings et al., 2013).植物中发生的大多数基因可变剪接事件为内含子保留, 然而当大豆(Glycine max)受到干旱胁迫时, 外显子跳跃成为数量最多的可变剪接事件; 外显子跳跃可以促进蛋白质的结构多样性, 可能是大豆适应干旱胁迫的一种有效方式(Kim et al., 2024).研究表明, 从大豆中鉴定出56个响应干旱胁迫的剪接调节因子(splicing regulatory factors, SPF)相关基因在干旱条件下进行了可变剪接, 其中3′端受体位点可变剪接和外显子跳跃占多数(Song et al., 2020).在水稻种子中, 大环内酯类抗生素可以通过调控剪接因子相关基因SR33和SR40的表达下调其它基因的可变剪接, 抑制种子萌发, 进而调控水稻种子的干旱耐受性(宋凝曦等, 2020). ... MMS21/HPY2 and SIZ1, two Arabidopsis SUMO E3 ligases, have distinct functions in development 2 2012 ... SIZ1是最早在拟南芥中发现的一种SUMO E3连接酶, 参与调控剪接因子的SUMO化修饰, 进而调控植物响应热胁迫(Miura et al., 2005; Yunus and Lima, 2009).随后的研究表明, SIZ1在拟南芥不同组织中广泛表达, 在高温胁迫下其表达水平升高.同时, 热胁迫下SIZ1通过SUMO化修饰调节转录因子的活性, 促进一些编码热休克蛋白的基因(如HSP70和HSP90)表达, 从而调节植物响应高温胁迫(Ishida et al., 2012).在热胁迫下, 真菌SUMO化修饰某些剪接因子, 促进这些剪接因子在特定剪接位点富集, 从而改变前体mRNA的剪接模式, 这种改变可能有助于产生特定的mRNA异构体, 进而响应热胁迫(Jian et al., 2023).研究发现, 拟南芥SIZ1剪接变体SSV2和SSV5在热应激下大量积累, 二者通过编码同种蛋白质, 在热应激条件下作为质膜中的SUMO E3连接酶发挥作用; SSV2介导热应激下细胞质膜蛋白或膜连接蛋白的类泛素化修饰, 从而调节它们的稳定性或功能.此外, 在拟南芥siz1-2突变体中表达SSV2基因可提高植株的耐热应激能力.这些结果表明, SIZ1剪接产物SSV2在调节拟南芥响应高温胁迫方面具有重要作用(Kwak et al., 2024). ...
拟南芥SR45.1亚型通过调节SOS基因的表达, 在调控离子稳态和赋予耐盐性方面起重要作用(Albaqami et al., 2019).镉胁迫下, 拟南芥剪接因子SR34b通过调控下游靶基因IRT1的剪接和稳定性, 增强IRT1蛋白的组成型积累, IRT1蛋白通过参与镉吸收过程增强镉耐受性(Zhang et al., 2014).拟南芥SAD1基因过表达显著提高了转基因植株中盐胁迫响应相关基因的剪接效率, 进而提高转基因植株的耐盐性(Cui et al., 2014).SKIP是植物剪接体的关键组分之一, 通过直接与剪接体的另一个组分SR45相互作用, 维持剪接体功能, 并调节基因可变剪接(Wang et al., 2012); 在盐胁迫下, 拟南芥SKIP通过调控剪接体靶向基因中可变5′端供体位点和可变3′端受体位点的识别或切割诱导全基因组可变剪接, 提高植株对盐胁迫的耐受性(Feng et al., 2015).拟南芥AtU1A是剪接体的组成部分, 负责识别前体mRNA的5′剪接位点, 同时AtU1A通过调节活性氧清除相关基因的剪接, 维持活性氧的平衡, 从而提高植株的盐胁迫耐受性(Gu et al., 2018).SiCYP19的2个可变剪接变体(SiCYP19-a和SiCYP19-b)均可增强谷子(Setaria italica)的耐盐性, 其中SiCYP19-b定位于线粒体, 通过提高脯氨酸含量和促进活性氧清除方式增强谷子的耐盐性(Zhang et al., 2024c).研究发现, 拟南芥Sm核心蛋白SmEb通过调控RCD1可变剪接减少盐诱导的细胞死亡, 从而增强植株的耐盐性(Hong et al., 2023).胡杨(Populus euphratica) PeuHKT1;3通过可变剪接产生PeuHKT1;3a变体, 进一步通过改变离子选择性提高对K+的亲和力, 增强植株在盐胁迫下的适应能力(Lv et al., 2024).GmNTL9和GmRSZ22剪接变体通过激活抗氧化清除系统提高大豆对碳酸氢盐胁迫的耐受性; GmRSZ22两种剪接变体均可与GmU1-70K相互作用, 可能调控盐胁迫响应基因的可变剪接过程(Liu et al., 2024).在盐胁迫下, GsSnRK1.1通过调节转录因子活性和稳定调控下游靶基因表达, 并调控离子平衡和渗透调节等生理过程, 进而提高植株的耐盐性(Liu et al., 2023).最新研究发现, 盐胁迫激活了拟南芥SnRK1激酶, 使其磷酸化SRRM1L, 随后SRRM1L与U1-70K相互作用进入剪接体, 调控NFYA10前体mRNA可变剪接, 产生功能性NFYA10.1变体, 而NFYA10.1过表达可增强拟南芥对盐胁迫的抗性(Sun et al., 2024).上述研究表明, 基因可变剪接调控植物响应盐胁迫主要通过以下2条途径进行: 一是mRNA剪接体或剪接组分通过调节盐胁迫响应相关基因的表达增强植物的耐盐性; 二是剪接体通过直接参与分子网络调控途径增强耐盐性. ... SUMOylation regulates pre-mRNA splicing to overcome DNA damage in fungi 1 2023 ... SIZ1是最早在拟南芥中发现的一种SUMO E3连接酶, 参与调控剪接因子的SUMO化修饰, 进而调控植物响应热胁迫(Miura et al., 2005; Yunus and Lima, 2009).随后的研究表明, SIZ1在拟南芥不同组织中广泛表达, 在高温胁迫下其表达水平升高.同时, 热胁迫下SIZ1通过SUMO化修饰调节转录因子的活性, 促进一些编码热休克蛋白的基因(如HSP70和HSP90)表达, 从而调节植物响应高温胁迫(Ishida et al., 2012).在热胁迫下, 真菌SUMO化修饰某些剪接因子, 促进这些剪接因子在特定剪接位点富集, 从而改变前体mRNA的剪接模式, 这种改变可能有助于产生特定的mRNA异构体, 进而响应热胁迫(Jian et al., 2023).研究发现, 拟南芥SIZ1剪接变体SSV2和SSV5在热应激下大量积累, 二者通过编码同种蛋白质, 在热应激条件下作为质膜中的SUMO E3连接酶发挥作用; SSV2介导热应激下细胞质膜蛋白或膜连接蛋白的类泛素化修饰, 从而调节它们的稳定性或功能.此外, 在拟南芥siz1-2突变体中表达SSV2基因可提高植株的耐热应激能力.这些结果表明, SIZ1剪接产物SSV2在调节拟南芥响应高温胁迫方面具有重要作用(Kwak et al., 2024). ... Integrating omics and alternative splicing reveals insights into grape response to high temperature 1 2017 ... 基因可变剪接事件通过调节响应非生物胁迫基因剪接变体活性和非活性亚型之间的比率, 调控胁迫关键调节因子的表达, 进而影响植物的非生物胁迫响应(Laloum et al., 2018).大量研究表明, 非生物胁迫显著改变植物基因的可变剪接事件.例如, 在高温胁迫下葡萄(Vitis vinifera)叶片出现1 075个差异性剪接事件(Jiang et al., 2017).冷胁迫诱导水稻(Oryza sativa)中出现大量的可变剪接事件, 且内含子保留是其中最主要的剪接类型(Zhong et al., 2024).盐胁迫改变了拟南芥(Arabidopsis thaliana)中6 188个基因的可变剪接模式(Feng et al., 2015).同时, 小麦(Triticum aestivum)在高温和干旱组合胁迫下产生963个可变剪接事件, 而在单独高温或单独干旱胁迫下几乎没有变化, 表明部分基因可变剪接事件可能受到多种非生物胁迫共同调控(Liu et al., 2018).研究表明, 拟南芥在主要的非生物胁迫(热、冷、干旱和盐胁迫以及ABA处理)下, 其不同组织中基因可变剪接事件存在显著差异(Martín et al., 2021).因此, 环境胁迫诱导和组织器官依赖的可变剪接事件是植物适应逆境的重要手段.本文综述了植物可变剪接的类型和机制, 重点阐述了可变剪接参与调控植物响应非生物胁迫的研究进展, 展望了该领域未来的研究方向. ... Understanding the molecular mechanisms of drought tolerance in wild soybean (Glycine soja) through multi-omics-based alternative splicing predictions 1 2024 ... 干旱是影响植物生长发育、生存和作物生产力最重要的因素之一, 对农业可持续发展构成重大威胁(Ings et al., 2013).植物中发生的大多数基因可变剪接事件为内含子保留, 然而当大豆(Glycine max)受到干旱胁迫时, 外显子跳跃成为数量最多的可变剪接事件; 外显子跳跃可以促进蛋白质的结构多样性, 可能是大豆适应干旱胁迫的一种有效方式(Kim et al., 2024).研究表明, 从大豆中鉴定出56个响应干旱胁迫的剪接调节因子(splicing regulatory factors, SPF)相关基因在干旱条件下进行了可变剪接, 其中3′端受体位点可变剪接和外显子跳跃占多数(Song et al., 2020).在水稻种子中, 大环内酯类抗生素可以通过调控剪接因子相关基因SR33和SR40的表达下调其它基因的可变剪接, 抑制种子萌发, 进而调控水稻种子的干旱耐受性(宋凝曦等, 2020). ... E3 SUMO ligase SIZ1 splicing variants localize and function according to external conditions 1 2024 ... SIZ1是最早在拟南芥中发现的一种SUMO E3连接酶, 参与调控剪接因子的SUMO化修饰, 进而调控植物响应热胁迫(Miura et al., 2005; Yunus and Lima, 2009).随后的研究表明, SIZ1在拟南芥不同组织中广泛表达, 在高温胁迫下其表达水平升高.同时, 热胁迫下SIZ1通过SUMO化修饰调节转录因子的活性, 促进一些编码热休克蛋白的基因(如HSP70和HSP90)表达, 从而调节植物响应高温胁迫(Ishida et al., 2012).在热胁迫下, 真菌SUMO化修饰某些剪接因子, 促进这些剪接因子在特定剪接位点富集, 从而改变前体mRNA的剪接模式, 这种改变可能有助于产生特定的mRNA异构体, 进而响应热胁迫(Jian et al., 2023).研究发现, 拟南芥SIZ1剪接变体SSV2和SSV5在热应激下大量积累, 二者通过编码同种蛋白质, 在热应激条件下作为质膜中的SUMO E3连接酶发挥作用; SSV2介导热应激下细胞质膜蛋白或膜连接蛋白的类泛素化修饰, 从而调节它们的稳定性或功能.此外, 在拟南芥siz1-2突变体中表达SSV2基因可提高植株的耐热应激能力.这些结果表明, SIZ1剪接产物SSV2在调节拟南芥响应高温胁迫方面具有重要作用(Kwak et al., 2024). ... Alternative splicing control of abiotic stress responses 6 2018 ... 基因可变剪接事件通过调节响应非生物胁迫基因剪接变体活性和非活性亚型之间的比率, 调控胁迫关键调节因子的表达, 进而影响植物的非生物胁迫响应(Laloum et al., 2018).大量研究表明, 非生物胁迫显著改变植物基因的可变剪接事件.例如, 在高温胁迫下葡萄(Vitis vinifera)叶片出现1 075个差异性剪接事件(Jiang et al., 2017).冷胁迫诱导水稻(Oryza sativa)中出现大量的可变剪接事件, 且内含子保留是其中最主要的剪接类型(Zhong et al., 2024).盐胁迫改变了拟南芥(Arabidopsis thaliana)中6 188个基因的可变剪接模式(Feng et al., 2015).同时, 小麦(Triticum aestivum)在高温和干旱组合胁迫下产生963个可变剪接事件, 而在单独高温或单独干旱胁迫下几乎没有变化, 表明部分基因可变剪接事件可能受到多种非生物胁迫共同调控(Liu et al., 2018).研究表明, 拟南芥在主要的非生物胁迫(热、冷、干旱和盐胁迫以及ABA处理)下, 其不同组织中基因可变剪接事件存在显著差异(Martín et al., 2021).因此, 环境胁迫诱导和组织器官依赖的可变剪接事件是植物适应逆境的重要手段.本文综述了植物可变剪接的类型和机制, 重点阐述了可变剪接参与调控植物响应非生物胁迫的研究进展, 展望了该领域未来的研究方向. ...
SR蛋白包含1个或2个N端RNA识别基序型(RNA Recognition Motif, RRM) RNA结合结构域和1个长度可变的C端精氨酸/丝氨酸富集结构域(arginine/serine- rich domain, RS) (Manley and Tacke, 1996).SR蛋白参与剪接体的组装过程, 通过结合到特定的剪接增强子或沉默子序列附近, 引导剪接体识别内含子和外显子边界, 进而影响剪接方式(Lopato et al., 1996).SR蛋白为内含子剪接所必需, 可以促进U1 snRNP与5′剪接位点的结合(Zahler and Roth, 1995).当SR蛋白结合在外显子上时, 通常促进外显子和剪接因子的结合, 起到剪接激活的作用; 而当其结合在内含子上时, 可能会抑制剪接.然而, 对于hnRNP (heterogeneous nuclear ribonucleoprotein)蛋白, 也有类似的位置依赖性剪接调控模式, 只是根据具体情况剪接模式有所不同(Erkelenz et al., 2013).富含丝氨酸/精氨酸的剪接因子1 (serine/argininerich splicing factor 1, SRSF1)通过使用与RNA结合位点相反的表面将U1-70K (U1 snRNP 70K)的RRM桥接到前体mRNA, 参与介导早期的剪接体组装事件(Cho et al., 2011). ...
SR蛋白包含1个或2个N端RNA识别基序型(RNA Recognition Motif, RRM) RNA结合结构域和1个长度可变的C端精氨酸/丝氨酸富集结构域(arginine/serine- rich domain, RS) (Manley and Tacke, 1996).SR蛋白参与剪接体的组装过程, 通过结合到特定的剪接增强子或沉默子序列附近, 引导剪接体识别内含子和外显子边界, 进而影响剪接方式(Lopato et al., 1996).SR蛋白为内含子剪接所必需, 可以促进U1 snRNP与5′剪接位点的结合(Zahler and Roth, 1995).当SR蛋白结合在外显子上时, 通常促进外显子和剪接因子的结合, 起到剪接激活的作用; 而当其结合在内含子上时, 可能会抑制剪接.然而, 对于hnRNP (heterogeneous nuclear ribonucleoprotein)蛋白, 也有类似的位置依赖性剪接调控模式, 只是根据具体情况剪接模式有所不同(Erkelenz et al., 2013).富含丝氨酸/精氨酸的剪接因子1 (serine/argininerich splicing factor 1, SRSF1)通过使用与RNA结合位点相反的表面将U1-70K (U1 snRNP 70K)的RRM桥接到前体mRNA, 参与介导早期的剪接体组装事件(Cho et al., 2011). ... 1 2006 ... 剪接因子在调控植物响应冷胁迫方面同样起重要作用.STA1是一个前体mRNA剪接因子, 拟南芥中STA1表达受冷胁迫诱导, 通过调节前体mRNA剪接响应冷胁迫(Lee et al., 2006).在冷胁迫下, 水稻中OsRH42与U2 snRNA直接相互作用, 对前体mRNA剪接至关重要, 可确保有足够数量的成熟mRNA响应冷胁迫(Lu et al., 2020).在水稻rs33突变体中, RS33的缺失导致大量胁迫响应基因的前体mRNA剪接异常, 表明冷胁迫下RS33通过维持胁迫相关基因前体mRNA正常剪接, 促进植株响应冷胁迫(Butt et al., 2022).水稻OsRS33和OsRS2Z38是冷诱导剪接的关键调节基因, 而Os03g0701200和OsCATC是水稻冷胁迫响应的重要候选基因, 用于提高水稻的冷胁迫耐受性(Zhong et al., 2024).研究表明, 花生(Arachis hypogaea)中存在28个冷诱导AhDREBs和8个具有DAS的SR剪接因子, 可能在冷响应中起重要作用(Wang et al., 2024b).在构树(Broussonetia papyrifera)中鉴定出41个富含丝氨酸/精氨酸(SR)的剪接因子基因, 其中5个SR基因在冷处理12和24小时后均表现出差异表达, 这表明SR基因通过可变剪接调控植物响应冷胁迫(Yu et al., 2023).LUC7作为U1 snRNP的组成部分, 对可变剪接具有重要调节作用, 包括影响5′剪接位点识别、外显子定义和3′剪接位点识别等, LUC7还直接参与冷胁迫下的内含子剪接调节.此外, 冷胁迫下, 随着末端内含子保留的增加, LUC7可能通过调节这些内含子的剪接响应冷胁迫(de Francisco Amorim et al., 2018).在冷胁迫下, 水稻OsRH42蛋白的表达量增加, 其通过与U2 snRNA结合在mRNA前体剪接中发挥重要作用.在过表达OsRH42植株中, 过量的OsRH42在U2 snRNA结合到分支点位点后仍继续结合, 影响了U2 snRNP、U4 snRNP和U5 snRNP招募到剪接体中, 从而破坏了前体mRNA剪接途径, 导致水稻对冷胁迫不耐受(Lu et al., 2020).上述研究表明, SR剪接因子以及LUC7等剪接过程中的核心调节因子在植物冷胁迫响应过程中起关键作用, 未来仍需对冷胁迫下剪接过程中的相关调节因子进行深入研究, 以阐明基因可变剪接在植物冷胁迫响应中的调控网络. ... Large-scale analysis of the cassava transcriptome reveals the impact of cold stress on alternative splicing 1 2020 ... 基因可变剪接是植物转录组重编程以响应冷胁迫的主要方式(Calixto et al., 2018).可变剪接调控植物响应冷胁迫的研究最早在小麦中开展.研究发现,在冷胁迫下小麦中DREB2同源基因发生可变剪接, 产生不同的剪接变体, 而这些剪接变体可能影响植物对冷胁迫的响应(Egawa et al., 2006).可变剪接可能会影响靶基因的表达, 从而促进冷驯化过程(Calixto et al., 2019).剪接因子丰度和活性变化决定了下游基因的可变剪接模式: 在冷胁迫下, 拟南芥通过调节SR和hnRNP基因的可变剪接, 使剪接因子丰度和活性发生动态变化, 影响靶基因的表达, 进而响应冷胁迫(Syed et al., 2012).研究表明, 一些转录因子基因可变剪接会产生小干扰肽(small interfering peptide, siPEP), 这些小干扰肽通过肽干扰(peptide interference, PEPi)负向调节靶转录因子, 构成植物冷胁迫响应的调节回路.同时, 多种转录因子通过可变剪接产生的部分剪接异构体具有更强的DNA结合能力, 能够更有效地调控下游基因的表达, 而另一些异构体通过特异的蛋白质互作方式, 影响植物对低温胁迫的响应(Seo et al., 2013).可变剪接通过差异性调控不同功能剪接体的比例响应冷胁迫.例如, 在冷胁迫下, 木薯(Manihot esculenta)中5种主要亚型的可变剪接事件数量均大幅增加, 其中对冷胁迫有特异响应的内含子保留和可变3′端受体位点类型显著增加.而在冷诱导下, SR基因mRNA产物通过反作用方式改变下游靶标基因的剪接, 进而导致响应冷胁迫下的整体转录组发生变化(Li et al., 2020).上述研究表明, 植物通过基因可变剪接响应冷胁迫主要有2种方式: 一种是通过影响下游靶基因的表达响应冷胁迫; 另一种是通过剪接异构体与DNA结合或与蛋白质相互作用响应冷胁迫. ... Antisense oligonucleotide modulation of non-productive alternative splicing upregulates gene expression 1 2020 ... 基因可变剪接是一种重要的转录后调控机制, 在转录后水平上对基因进行不同方式剪接, 扩大基因表达多样性, 产生具有不同功能的蛋白质异构体, 增加蛋白质组复杂性, 为生物体提供了更多功能选择(Graveley, 2001; Laloum et al., 2018).基因可变剪接的主要类型有内含子保留、外显子跳跃、可变5′端供体位点以及可变3′端受体位点(Laloum et al., 2018) (图1).例如, 拟南芥中最常见的可变剪接事件是内含子保留(Ner-Gaon et al., 2004).然而, 有些剪接异构体由于含有提前终止密码子(premature termination codon, PTC), 可通过无义介导的mRNA衰变(nonsense-mediated mRNA decay, NMD)途径降解, 从而调控转录本比率, 进而调节基因表达, 最终增强植物对非生物胁迫的响应(Lim et al., 2020).同时, 当mRNA转录本中存在上游开放阅读框(upstream open reading frame, uORF)时, 核糖体会优先结合并翻译uORF, 影响后续正常编码区翻译起始或导致核糖体提前解离, 最终导致mRNA剪接异构体翻译被抑制或者不翻译(Calvo et al., 2009).可变剪接由剪接体催化, 而剪接体由5种小核糖核蛋白(small nuclear ribonucleoprotein, snRNP)组成, 包括U1 snRNP、U2 snRNP、U4 snRNP、U5 snRNP和U6 snRNP (Will and Lührmann, 2011).U1 snRNP中的U1小核RNA (small nuclear RNA, snRNA)通过碱基互补配对与5′剪接位点GU序列附近区域结合, 从而实现对5′剪接位点的初步识别; U2辅助因子(U2 auxiliary factor, U2AF)通过与3′剪接位点AG序列相互作用进而识别3′端.U2 snRNP参与识别分支点序列, 通过与分支点序列及其附近区域进行碱基互补配对, 实现对分支点序列的结合(Laloum et al., 2018; Paul et al., 2024).U1 snRNP结合到5′剪接位点后, 招募其它蛋白质因子, 形成E复合物(E complex).随后, U2 snRNP结合到分支点序列, 并与已经结合在5′剪接位点的U1 snRNP以及其它相关蛋白质因子相互作用, 形成A复合物(A complex).随后, U4/U6 snRNP和U5 snRNP加入, 形成B复合物(B complex).最后, 经过一系列的结构重排, U4 snRNP解离, U6 snRNP与U2 snRNP之间相互作用进一步调整, 形成具有催化活性的C复合物(C complex).C复合物经过2次转酯反应, 完成可变剪接的1个基本单元.上述过程反复进行, 最终产生多种不同的mRNA剪接异构体(Punzo et al., 2020). ... Pre-mRNA splicing repression triggers abiotic stress signaling in plants 1 2017 ... 热胁迫是一种典型的非生物胁迫, 引起光合作用和呼吸作用变化, 导致植物生命周期缩短和生产能力降低(Barnabás et al., 2008).因此, 研究基因可变剪接如何调节植物响应热胁迫具有重要的生物学意义.植物在面对高温等环境胁迫时, 会通过一系列生理过程来应对高温胁迫, 如SR蛋白介导的前体mRNA调控(图2), 进而启动热休克反应(heat shock response, HSR), 包括激活热休克转录因子(heat shock factor, HSF)和产生热休克蛋白(heat shock protein, HSP).在热胁迫下, 植物中的HSF调控HSP表达, 使得植物合成足够的HSPs, 以应对热应激带来的挑战, 增强耐热性(Rosenkranz et al., 2024).在拟南芥中, HsfA2在热应激下会发生可变剪接, 产生包含提前终止密码子的剪接变体(如HsfA2-II) (Palusa and Reddy, 2015).研究发现, 在多种非生物胁迫(包括热胁迫)下HsfA2表达的诱导在A类HSF中最高, 这表明HsfA2是非生物胁迫下诱导防御系统的关键调节因子(Nishizawa et al., 2006).在热胁迫下, 拟南芥HsfA2正向调节一些被HsfA1初始诱导后的热诱导基因表达, 进而延长拟南芥获得耐热性的持续时间, 且HsfA2在维持热休克反应中具有主导作用, 而其它一些Hsfs (如HsfB1)在持续获得耐热性的调控中并非必需(Charng et al., 2007).拟南芥的2个热休克转录因子HsfB1和HsfB2b作为转录抑制因子负向调节热诱导的HSFs和HSPs (Ikeda et al., 2011).苜蓿(Medicago sativa)中HSF1基因可变剪接模式决定了其翻译产物能否结合到下游基因的热激元件(heat shock elements, HSEs)上, 进而影响热响应基因的激活(Ling et al., 2021).拟南芥HSFA2受到热胁迫时产生可变剪接调节.例如, 拟南芥幼苗暴露于不同强度热胁迫下会导致HSFA2前体mRNA上的外显子跳跃或内含子保留, 并产生不同比例的HSFA2 mRNA亚型: HSFA2-I、HSFA2-II和HSFA2-III.其中, HSFA2-III被认为参与HSFA2表达的自动调节, 从而响应热胁迫.热激蛋白是植物应对热应激的重要保护分子, 对于提高植物耐热性具有重要作用.在热应激下, 可变剪接调控热激蛋白基因表达, 促进热激蛋白合成, 进而增强植物的耐热性(Ling et al., 2017).在严重热激下, HsfA2产生新的剪接变体HsfA2-III, HsfA2-III编码S-HsfA2, 形成一个正向的自调控环, S-HsfA2可激活HsfA2基因的表达, 使内源完全剪接的HsfA2积累水平大幅提高(Liu et al., 2013).研究表明, 在热胁迫条件下, 大量被子植物HSF基因家族成员(如番茄(Solanum lycopersicum) SlHSFA2、玉米(Zea mays) ZmHSFA2B以及百合(Lilium spp.) LsHSFA3)的可变剪接事件显著提高了植株的抗逆性, 推测植物HSF基因家族成员可变剪接属于一种保守的热胁迫应答机制(Wu et al., 2019; Rosenkranz et al., 2024; Song et al., 2025). ... Pre-mRNA alternative splicing as a modulator for heat stress response in plants 6 2021 ... 热胁迫是一种典型的非生物胁迫, 引起光合作用和呼吸作用变化, 导致植物生命周期缩短和生产能力降低(Barnabás et al., 2008).因此, 研究基因可变剪接如何调节植物响应热胁迫具有重要的生物学意义.植物在面对高温等环境胁迫时, 会通过一系列生理过程来应对高温胁迫, 如SR蛋白介导的前体mRNA调控(图2), 进而启动热休克反应(heat shock response, HSR), 包括激活热休克转录因子(heat shock factor, HSF)和产生热休克蛋白(heat shock protein, HSP).在热胁迫下, 植物中的HSF调控HSP表达, 使得植物合成足够的HSPs, 以应对热应激带来的挑战, 增强耐热性(Rosenkranz et al., 2024).在拟南芥中, HsfA2在热应激下会发生可变剪接, 产生包含提前终止密码子的剪接变体(如HsfA2-II) (Palusa and Reddy, 2015).研究发现, 在多种非生物胁迫(包括热胁迫)下HsfA2表达的诱导在A类HSF中最高, 这表明HsfA2是非生物胁迫下诱导防御系统的关键调节因子(Nishizawa et al., 2006).在热胁迫下, 拟南芥HsfA2正向调节一些被HsfA1初始诱导后的热诱导基因表达, 进而延长拟南芥获得耐热性的持续时间, 且HsfA2在维持热休克反应中具有主导作用, 而其它一些Hsfs (如HsfB1)在持续获得耐热性的调控中并非必需(Charng et al., 2007).拟南芥的2个热休克转录因子HsfB1和HsfB2b作为转录抑制因子负向调节热诱导的HSFs和HSPs (Ikeda et al., 2011).苜蓿(Medicago sativa)中HSF1基因可变剪接模式决定了其翻译产物能否结合到下游基因的热激元件(heat shock elements, HSEs)上, 进而影响热响应基因的激活(Ling et al., 2021).拟南芥HSFA2受到热胁迫时产生可变剪接调节.例如, 拟南芥幼苗暴露于不同强度热胁迫下会导致HSFA2前体mRNA上的外显子跳跃或内含子保留, 并产生不同比例的HSFA2 mRNA亚型: HSFA2-I、HSFA2-II和HSFA2-III.其中, HSFA2-III被认为参与HSFA2表达的自动调节, 从而响应热胁迫.热激蛋白是植物应对热应激的重要保护分子, 对于提高植物耐热性具有重要作用.在热应激下, 可变剪接调控热激蛋白基因表达, 促进热激蛋白合成, 进而增强植物的耐热性(Ling et al., 2017).在严重热激下, HsfA2产生新的剪接变体HsfA2-III, HsfA2-III编码S-HsfA2, 形成一个正向的自调控环, S-HsfA2可激活HsfA2基因的表达, 使内源完全剪接的HsfA2积累水平大幅提高(Liu et al., 2013).研究表明, 在热胁迫条件下, 大量被子植物HSF基因家族成员(如番茄(Solanum lycopersicum) SlHSFA2、玉米(Zea mays) ZmHSFA2B以及百合(Lilium spp.) LsHSFA3)的可变剪接事件显著提高了植株的抗逆性, 推测植物HSF基因家族成员可变剪接属于一种保守的热胁迫应答机制(Wu et al., 2019; Rosenkranz et al., 2024; Song et al., 2025). ...
拟南芥SR45.1亚型通过调节SOS基因的表达, 在调控离子稳态和赋予耐盐性方面起重要作用(Albaqami et al., 2019).镉胁迫下, 拟南芥剪接因子SR34b通过调控下游靶基因IRT1的剪接和稳定性, 增强IRT1蛋白的组成型积累, IRT1蛋白通过参与镉吸收过程增强镉耐受性(Zhang et al., 2014).拟南芥SAD1基因过表达显著提高了转基因植株中盐胁迫响应相关基因的剪接效率, 进而提高转基因植株的耐盐性(Cui et al., 2014).SKIP是植物剪接体的关键组分之一, 通过直接与剪接体的另一个组分SR45相互作用, 维持剪接体功能, 并调节基因可变剪接(Wang et al., 2012); 在盐胁迫下, 拟南芥SKIP通过调控剪接体靶向基因中可变5′端供体位点和可变3′端受体位点的识别或切割诱导全基因组可变剪接, 提高植株对盐胁迫的耐受性(Feng et al., 2015).拟南芥AtU1A是剪接体的组成部分, 负责识别前体mRNA的5′剪接位点, 同时AtU1A通过调节活性氧清除相关基因的剪接, 维持活性氧的平衡, 从而提高植株的盐胁迫耐受性(Gu et al., 2018).SiCYP19的2个可变剪接变体(SiCYP19-a和SiCYP19-b)均可增强谷子(Setaria italica)的耐盐性, 其中SiCYP19-b定位于线粒体, 通过提高脯氨酸含量和促进活性氧清除方式增强谷子的耐盐性(Zhang et al., 2024c).研究发现, 拟南芥Sm核心蛋白SmEb通过调控RCD1可变剪接减少盐诱导的细胞死亡, 从而增强植株的耐盐性(Hong et al., 2023).胡杨(Populus euphratica) PeuHKT1;3通过可变剪接产生PeuHKT1;3a变体, 进一步通过改变离子选择性提高对K+的亲和力, 增强植株在盐胁迫下的适应能力(Lv et al., 2024).GmNTL9和GmRSZ22剪接变体通过激活抗氧化清除系统提高大豆对碳酸氢盐胁迫的耐受性; GmRSZ22两种剪接变体均可与GmU1-70K相互作用, 可能调控盐胁迫响应基因的可变剪接过程(Liu et al., 2024).在盐胁迫下, GsSnRK1.1通过调节转录因子活性和稳定调控下游靶基因表达, 并调控离子平衡和渗透调节等生理过程, 进而提高植株的耐盐性(Liu et al., 2023).最新研究发现, 盐胁迫激活了拟南芥SnRK1激酶, 使其磷酸化SRRM1L, 随后SRRM1L与U1-70K相互作用进入剪接体, 调控NFYA10前体mRNA可变剪接, 产生功能性NFYA10.1变体, 而NFYA10.1过表达可增强拟南芥对盐胁迫的抗性(Sun et al., 2024).上述研究表明, 基因可变剪接调控植物响应盐胁迫主要通过以下2条途径进行: 一是mRNA剪接体或剪接组分通过调节盐胁迫响应相关基因的表达增强植物的耐盐性; 二是剪接体通过直接参与分子网络调控途径增强耐盐性. ...
拟南芥SR45.1亚型通过调节SOS基因的表达, 在调控离子稳态和赋予耐盐性方面起重要作用(Albaqami et al., 2019).镉胁迫下, 拟南芥剪接因子SR34b通过调控下游靶基因IRT1的剪接和稳定性, 增强IRT1蛋白的组成型积累, IRT1蛋白通过参与镉吸收过程增强镉耐受性(Zhang et al., 2014).拟南芥SAD1基因过表达显著提高了转基因植株中盐胁迫响应相关基因的剪接效率, 进而提高转基因植株的耐盐性(Cui et al., 2014).SKIP是植物剪接体的关键组分之一, 通过直接与剪接体的另一个组分SR45相互作用, 维持剪接体功能, 并调节基因可变剪接(Wang et al., 2012); 在盐胁迫下, 拟南芥SKIP通过调控剪接体靶向基因中可变5′端供体位点和可变3′端受体位点的识别或切割诱导全基因组可变剪接, 提高植株对盐胁迫的耐受性(Feng et al., 2015).拟南芥AtU1A是剪接体的组成部分, 负责识别前体mRNA的5′剪接位点, 同时AtU1A通过调节活性氧清除相关基因的剪接, 维持活性氧的平衡, 从而提高植株的盐胁迫耐受性(Gu et al., 2018).SiCYP19的2个可变剪接变体(SiCYP19-a和SiCYP19-b)均可增强谷子(Setaria italica)的耐盐性, 其中SiCYP19-b定位于线粒体, 通过提高脯氨酸含量和促进活性氧清除方式增强谷子的耐盐性(Zhang et al., 2024c).研究发现, 拟南芥Sm核心蛋白SmEb通过调控RCD1可变剪接减少盐诱导的细胞死亡, 从而增强植株的耐盐性(Hong et al., 2023).胡杨(Populus euphratica) PeuHKT1;3通过可变剪接产生PeuHKT1;3a变体, 进一步通过改变离子选择性提高对K+的亲和力, 增强植株在盐胁迫下的适应能力(Lv et al., 2024).GmNTL9和GmRSZ22剪接变体通过激活抗氧化清除系统提高大豆对碳酸氢盐胁迫的耐受性; GmRSZ22两种剪接变体均可与GmU1-70K相互作用, 可能调控盐胁迫响应基因的可变剪接过程(Liu et al., 2024).在盐胁迫下, GsSnRK1.1通过调节转录因子活性和稳定调控下游靶基因表达, 并调控离子平衡和渗透调节等生理过程, 进而提高植株的耐盐性(Liu et al., 2023).最新研究发现, 盐胁迫激活了拟南芥SnRK1激酶, 使其磷酸化SRRM1L, 随后SRRM1L与U1-70K相互作用进入剪接体, 调控NFYA10前体mRNA可变剪接, 产生功能性NFYA10.1变体, 而NFYA10.1过表达可增强拟南芥对盐胁迫的抗性(Sun et al., 2024).上述研究表明, 基因可变剪接调控植物响应盐胁迫主要通过以下2条途径进行: 一是mRNA剪接体或剪接组分通过调节盐胁迫响应相关基因的表达增强植物的耐盐性; 二是剪接体通过直接参与分子网络调控途径增强耐盐性. ... An autoregulatory loop controlling Arabidopsis HsfA2 expression: role of heat shock-induced alternative splicing 1 2013 ... 热胁迫是一种典型的非生物胁迫, 引起光合作用和呼吸作用变化, 导致植物生命周期缩短和生产能力降低(Barnabás et al., 2008).因此, 研究基因可变剪接如何调节植物响应热胁迫具有重要的生物学意义.植物在面对高温等环境胁迫时, 会通过一系列生理过程来应对高温胁迫, 如SR蛋白介导的前体mRNA调控(图2), 进而启动热休克反应(heat shock response, HSR), 包括激活热休克转录因子(heat shock factor, HSF)和产生热休克蛋白(heat shock protein, HSP).在热胁迫下, 植物中的HSF调控HSP表达, 使得植物合成足够的HSPs, 以应对热应激带来的挑战, 增强耐热性(Rosenkranz et al., 2024).在拟南芥中, HsfA2在热应激下会发生可变剪接, 产生包含提前终止密码子的剪接变体(如HsfA2-II) (Palusa and Reddy, 2015).研究发现, 在多种非生物胁迫(包括热胁迫)下HsfA2表达的诱导在A类HSF中最高, 这表明HsfA2是非生物胁迫下诱导防御系统的关键调节因子(Nishizawa et al., 2006).在热胁迫下, 拟南芥HsfA2正向调节一些被HsfA1初始诱导后的热诱导基因表达, 进而延长拟南芥获得耐热性的持续时间, 且HsfA2在维持热休克反应中具有主导作用, 而其它一些Hsfs (如HsfB1)在持续获得耐热性的调控中并非必需(Charng et al., 2007).拟南芥的2个热休克转录因子HsfB1和HsfB2b作为转录抑制因子负向调节热诱导的HSFs和HSPs (Ikeda et al., 2011).苜蓿(Medicago sativa)中HSF1基因可变剪接模式决定了其翻译产物能否结合到下游基因的热激元件(heat shock elements, HSEs)上, 进而影响热响应基因的激活(Ling et al., 2021).拟南芥HSFA2受到热胁迫时产生可变剪接调节.例如, 拟南芥幼苗暴露于不同强度热胁迫下会导致HSFA2前体mRNA上的外显子跳跃或内含子保留, 并产生不同比例的HSFA2 mRNA亚型: HSFA2-I、HSFA2-II和HSFA2-III.其中, HSFA2-III被认为参与HSFA2表达的自动调节, 从而响应热胁迫.热激蛋白是植物应对热应激的重要保护分子, 对于提高植物耐热性具有重要作用.在热应激下, 可变剪接调控热激蛋白基因表达, 促进热激蛋白合成, 进而增强植物的耐热性(Ling et al., 2017).在严重热激下, HsfA2产生新的剪接变体HsfA2-III, HsfA2-III编码S-HsfA2, 形成一个正向的自调控环, S-HsfA2可激活HsfA2基因的表达, 使内源完全剪接的HsfA2积累水平大幅提高(Liu et al., 2013).研究表明, 在热胁迫条件下, 大量被子植物HSF基因家族成员(如番茄(Solanum lycopersicum) SlHSFA2、玉米(Zea mays) ZmHSFA2B以及百合(Lilium spp.) LsHSFA3)的可变剪接事件显著提高了植株的抗逆性, 推测植物HSF基因家族成员可变剪接属于一种保守的热胁迫应答机制(Wu et al., 2019; Rosenkranz et al., 2024; Song et al., 2025). ... Classification and function of RNA-protein interactions 1 2020 ... U1 snRNA是一种长度为60-300 bp的小RNA, 存在于真核生物的细胞核中, U1 snRNA在剪接过程中发挥重要作用, 参与识别5′剪接位点(Liu et al., 2020).在干旱胁迫下, AtU1 snRNA过表达通过调控拟南芥干旱相关基因的表达响应干旱胁迫; 同时, 参与干旱胁迫响应和ABA信号通路的差异表达基因以及差异剪接基因显著增加.在干旱胁迫下, AtU1 snRNA过表达拟南芥植株表现出更强的耐受性, 包括主根变长和鲜重增加, 且过表达AtU1 snRNA植株中的前体mRNA剪接事件发生显著变化, 其中内含子保留最普遍.在干旱胁迫下, 可变5′剪接位点内G位点的识别受到影响, 导致异常剪接事件发生频率增高.同时, U1 snRNA能够加强对可变5′剪接位点中T位点的识别, 从而减少异常剪接事件的发生.干旱胁迫下, AtU1 snRNA影响AtSPCH的剪接模式, 导致气孔密度降低, 这有利于拟南芥减少水分蒸发进而响应干旱胁迫(Wang et al., 2024a).上述研究表明, U1 snRNA在植物中通过多条途径响应干旱胁迫, 如调控干旱胁迫相关基因的表达、减少异常剪接事件发生以及改变前体mRNA剪接模式, 然而是否存在其它方面的调控机制尚待挖掘. ... A global survey of bicarbonate stress-induced pre-mRNA alternative splicing in soybean via integrative analysis of Iso-seq and RNA-seq 2 2024 ... Alternative splicing-related genes involved in regulating plant responses to abiotic stress in different species
拟南芥SR45.1亚型通过调节SOS基因的表达, 在调控离子稳态和赋予耐盐性方面起重要作用(Albaqami et al., 2019).镉胁迫下, 拟南芥剪接因子SR34b通过调控下游靶基因IRT1的剪接和稳定性, 增强IRT1蛋白的组成型积累, IRT1蛋白通过参与镉吸收过程增强镉耐受性(Zhang et al., 2014).拟南芥SAD1基因过表达显著提高了转基因植株中盐胁迫响应相关基因的剪接效率, 进而提高转基因植株的耐盐性(Cui et al., 2014).SKIP是植物剪接体的关键组分之一, 通过直接与剪接体的另一个组分SR45相互作用, 维持剪接体功能, 并调节基因可变剪接(Wang et al., 2012); 在盐胁迫下, 拟南芥SKIP通过调控剪接体靶向基因中可变5′端供体位点和可变3′端受体位点的识别或切割诱导全基因组可变剪接, 提高植株对盐胁迫的耐受性(Feng et al., 2015).拟南芥AtU1A是剪接体的组成部分, 负责识别前体mRNA的5′剪接位点, 同时AtU1A通过调节活性氧清除相关基因的剪接, 维持活性氧的平衡, 从而提高植株的盐胁迫耐受性(Gu et al., 2018).SiCYP19的2个可变剪接变体(SiCYP19-a和SiCYP19-b)均可增强谷子(Setaria italica)的耐盐性, 其中SiCYP19-b定位于线粒体, 通过提高脯氨酸含量和促进活性氧清除方式增强谷子的耐盐性(Zhang et al., 2024c).研究发现, 拟南芥Sm核心蛋白SmEb通过调控RCD1可变剪接减少盐诱导的细胞死亡, 从而增强植株的耐盐性(Hong et al., 2023).胡杨(Populus euphratica) PeuHKT1;3通过可变剪接产生PeuHKT1;3a变体, 进一步通过改变离子选择性提高对K+的亲和力, 增强植株在盐胁迫下的适应能力(Lv et al., 2024).GmNTL9和GmRSZ22剪接变体通过激活抗氧化清除系统提高大豆对碳酸氢盐胁迫的耐受性; GmRSZ22两种剪接变体均可与GmU1-70K相互作用, 可能调控盐胁迫响应基因的可变剪接过程(Liu et al., 2024).在盐胁迫下, GsSnRK1.1通过调节转录因子活性和稳定调控下游靶基因表达, 并调控离子平衡和渗透调节等生理过程, 进而提高植株的耐盐性(Liu et al., 2023).最新研究发现, 盐胁迫激活了拟南芥SnRK1激酶, 使其磷酸化SRRM1L, 随后SRRM1L与U1-70K相互作用进入剪接体, 调控NFYA10前体mRNA可变剪接, 产生功能性NFYA10.1变体, 而NFYA10.1过表达可增强拟南芥对盐胁迫的抗性(Sun et al., 2024).上述研究表明, 基因可变剪接调控植物响应盐胁迫主要通过以下2条途径进行: 一是mRNA剪接体或剪接组分通过调节盐胁迫响应相关基因的表达增强植物的耐盐性; 二是剪接体通过直接参与分子网络调控途径增强耐盐性. ...
拟南芥SR45.1亚型通过调节SOS基因的表达, 在调控离子稳态和赋予耐盐性方面起重要作用(Albaqami et al., 2019).镉胁迫下, 拟南芥剪接因子SR34b通过调控下游靶基因IRT1的剪接和稳定性, 增强IRT1蛋白的组成型积累, IRT1蛋白通过参与镉吸收过程增强镉耐受性(Zhang et al., 2014).拟南芥SAD1基因过表达显著提高了转基因植株中盐胁迫响应相关基因的剪接效率, 进而提高转基因植株的耐盐性(Cui et al., 2014).SKIP是植物剪接体的关键组分之一, 通过直接与剪接体的另一个组分SR45相互作用, 维持剪接体功能, 并调节基因可变剪接(Wang et al., 2012); 在盐胁迫下, 拟南芥SKIP通过调控剪接体靶向基因中可变5′端供体位点和可变3′端受体位点的识别或切割诱导全基因组可变剪接, 提高植株对盐胁迫的耐受性(Feng et al., 2015).拟南芥AtU1A是剪接体的组成部分, 负责识别前体mRNA的5′剪接位点, 同时AtU1A通过调节活性氧清除相关基因的剪接, 维持活性氧的平衡, 从而提高植株的盐胁迫耐受性(Gu et al., 2018).SiCYP19的2个可变剪接变体(SiCYP19-a和SiCYP19-b)均可增强谷子(Setaria italica)的耐盐性, 其中SiCYP19-b定位于线粒体, 通过提高脯氨酸含量和促进活性氧清除方式增强谷子的耐盐性(Zhang et al., 2024c).研究发现, 拟南芥Sm核心蛋白SmEb通过调控RCD1可变剪接减少盐诱导的细胞死亡, 从而增强植株的耐盐性(Hong et al., 2023).胡杨(Populus euphratica) PeuHKT1;3通过可变剪接产生PeuHKT1;3a变体, 进一步通过改变离子选择性提高对K+的亲和力, 增强植株在盐胁迫下的适应能力(Lv et al., 2024).GmNTL9和GmRSZ22剪接变体通过激活抗氧化清除系统提高大豆对碳酸氢盐胁迫的耐受性; GmRSZ22两种剪接变体均可与GmU1-70K相互作用, 可能调控盐胁迫响应基因的可变剪接过程(Liu et al., 2024).在盐胁迫下, GsSnRK1.1通过调节转录因子活性和稳定调控下游靶基因表达, 并调控离子平衡和渗透调节等生理过程, 进而提高植株的耐盐性(Liu et al., 2023).最新研究发现, 盐胁迫激活了拟南芥SnRK1激酶, 使其磷酸化SRRM1L, 随后SRRM1L与U1-70K相互作用进入剪接体, 调控NFYA10前体mRNA可变剪接, 产生功能性NFYA10.1变体, 而NFYA10.1过表达可增强拟南芥对盐胁迫的抗性(Sun et al., 2024).上述研究表明, 基因可变剪接调控植物响应盐胁迫主要通过以下2条途径进行: 一是mRNA剪接体或剪接组分通过调节盐胁迫响应相关基因的表达增强植物的耐盐性; 二是剪接体通过直接参与分子网络调控途径增强耐盐性. ...
拟南芥SR45.1亚型通过调节SOS基因的表达, 在调控离子稳态和赋予耐盐性方面起重要作用(Albaqami et al., 2019).镉胁迫下, 拟南芥剪接因子SR34b通过调控下游靶基因IRT1的剪接和稳定性, 增强IRT1蛋白的组成型积累, IRT1蛋白通过参与镉吸收过程增强镉耐受性(Zhang et al., 2014).拟南芥SAD1基因过表达显著提高了转基因植株中盐胁迫响应相关基因的剪接效率, 进而提高转基因植株的耐盐性(Cui et al., 2014).SKIP是植物剪接体的关键组分之一, 通过直接与剪接体的另一个组分SR45相互作用, 维持剪接体功能, 并调节基因可变剪接(Wang et al., 2012); 在盐胁迫下, 拟南芥SKIP通过调控剪接体靶向基因中可变5′端供体位点和可变3′端受体位点的识别或切割诱导全基因组可变剪接, 提高植株对盐胁迫的耐受性(Feng et al., 2015).拟南芥AtU1A是剪接体的组成部分, 负责识别前体mRNA的5′剪接位点, 同时AtU1A通过调节活性氧清除相关基因的剪接, 维持活性氧的平衡, 从而提高植株的盐胁迫耐受性(Gu et al., 2018).SiCYP19的2个可变剪接变体(SiCYP19-a和SiCYP19-b)均可增强谷子(Setaria italica)的耐盐性, 其中SiCYP19-b定位于线粒体, 通过提高脯氨酸含量和促进活性氧清除方式增强谷子的耐盐性(Zhang et al., 2024c).研究发现, 拟南芥Sm核心蛋白SmEb通过调控RCD1可变剪接减少盐诱导的细胞死亡, 从而增强植株的耐盐性(Hong et al., 2023).胡杨(Populus euphratica) PeuHKT1;3通过可变剪接产生PeuHKT1;3a变体, 进一步通过改变离子选择性提高对K+的亲和力, 增强植株在盐胁迫下的适应能力(Lv et al., 2024).GmNTL9和GmRSZ22剪接变体通过激活抗氧化清除系统提高大豆对碳酸氢盐胁迫的耐受性; GmRSZ22两种剪接变体均可与GmU1-70K相互作用, 可能调控盐胁迫响应基因的可变剪接过程(Liu et al., 2024).在盐胁迫下, GsSnRK1.1通过调节转录因子活性和稳定调控下游靶基因表达, 并调控离子平衡和渗透调节等生理过程, 进而提高植株的耐盐性(Liu et al., 2023).最新研究发现, 盐胁迫激活了拟南芥SnRK1激酶, 使其磷酸化SRRM1L, 随后SRRM1L与U1-70K相互作用进入剪接体, 调控NFYA10前体mRNA可变剪接, 产生功能性NFYA10.1变体, 而NFYA10.1过表达可增强拟南芥对盐胁迫的抗性(Sun et al., 2024).上述研究表明, 基因可变剪接调控植物响应盐胁迫主要通过以下2条途径进行: 一是mRNA剪接体或剪接组分通过调节盐胁迫响应相关基因的表达增强植物的耐盐性; 二是剪接体通过直接参与分子网络调控途径增强耐盐性. ... 2 2024 ... Alternative splicing-related genes involved in regulating plant responses to abiotic stress in different species
拟南芥SR45.1亚型通过调节SOS基因的表达, 在调控离子稳态和赋予耐盐性方面起重要作用(Albaqami et al., 2019).镉胁迫下, 拟南芥剪接因子SR34b通过调控下游靶基因IRT1的剪接和稳定性, 增强IRT1蛋白的组成型积累, IRT1蛋白通过参与镉吸收过程增强镉耐受性(Zhang et al., 2014).拟南芥SAD1基因过表达显著提高了转基因植株中盐胁迫响应相关基因的剪接效率, 进而提高转基因植株的耐盐性(Cui et al., 2014).SKIP是植物剪接体的关键组分之一, 通过直接与剪接体的另一个组分SR45相互作用, 维持剪接体功能, 并调节基因可变剪接(Wang et al., 2012); 在盐胁迫下, 拟南芥SKIP通过调控剪接体靶向基因中可变5′端供体位点和可变3′端受体位点的识别或切割诱导全基因组可变剪接, 提高植株对盐胁迫的耐受性(Feng et al., 2015).拟南芥AtU1A是剪接体的组成部分, 负责识别前体mRNA的5′剪接位点, 同时AtU1A通过调节活性氧清除相关基因的剪接, 维持活性氧的平衡, 从而提高植株的盐胁迫耐受性(Gu et al., 2018).SiCYP19的2个可变剪接变体(SiCYP19-a和SiCYP19-b)均可增强谷子(Setaria italica)的耐盐性, 其中SiCYP19-b定位于线粒体, 通过提高脯氨酸含量和促进活性氧清除方式增强谷子的耐盐性(Zhang et al., 2024c).研究发现, 拟南芥Sm核心蛋白SmEb通过调控RCD1可变剪接减少盐诱导的细胞死亡, 从而增强植株的耐盐性(Hong et al., 2023).胡杨(Populus euphratica) PeuHKT1;3通过可变剪接产生PeuHKT1;3a变体, 进一步通过改变离子选择性提高对K+的亲和力, 增强植株在盐胁迫下的适应能力(Lv et al., 2024).GmNTL9和GmRSZ22剪接变体通过激活抗氧化清除系统提高大豆对碳酸氢盐胁迫的耐受性; GmRSZ22两种剪接变体均可与GmU1-70K相互作用, 可能调控盐胁迫响应基因的可变剪接过程(Liu et al., 2024).在盐胁迫下, GsSnRK1.1通过调节转录因子活性和稳定调控下游靶基因表达, 并调控离子平衡和渗透调节等生理过程, 进而提高植株的耐盐性(Liu et al., 2023).最新研究发现, 盐胁迫激活了拟南芥SnRK1激酶, 使其磷酸化SRRM1L, 随后SRRM1L与U1-70K相互作用进入剪接体, 调控NFYA10前体mRNA可变剪接, 产生功能性NFYA10.1变体, 而NFYA10.1过表达可增强拟南芥对盐胁迫的抗性(Sun et al., 2024).上述研究表明, 基因可变剪接调控植物响应盐胁迫主要通过以下2条途径进行: 一是mRNA剪接体或剪接组分通过调节盐胁迫响应相关基因的表达增强植物的耐盐性; 二是剪接体通过直接参与分子网络调控途径增强耐盐性. ...
拟南芥SR45.1亚型通过调节SOS基因的表达, 在调控离子稳态和赋予耐盐性方面起重要作用(Albaqami et al., 2019).镉胁迫下, 拟南芥剪接因子SR34b通过调控下游靶基因IRT1的剪接和稳定性, 增强IRT1蛋白的组成型积累, IRT1蛋白通过参与镉吸收过程增强镉耐受性(Zhang et al., 2014).拟南芥SAD1基因过表达显著提高了转基因植株中盐胁迫响应相关基因的剪接效率, 进而提高转基因植株的耐盐性(Cui et al., 2014).SKIP是植物剪接体的关键组分之一, 通过直接与剪接体的另一个组分SR45相互作用, 维持剪接体功能, 并调节基因可变剪接(Wang et al., 2012); 在盐胁迫下, 拟南芥SKIP通过调控剪接体靶向基因中可变5′端供体位点和可变3′端受体位点的识别或切割诱导全基因组可变剪接, 提高植株对盐胁迫的耐受性(Feng et al., 2015).拟南芥AtU1A是剪接体的组成部分, 负责识别前体mRNA的5′剪接位点, 同时AtU1A通过调节活性氧清除相关基因的剪接, 维持活性氧的平衡, 从而提高植株的盐胁迫耐受性(Gu et al., 2018).SiCYP19的2个可变剪接变体(SiCYP19-a和SiCYP19-b)均可增强谷子(Setaria italica)的耐盐性, 其中SiCYP19-b定位于线粒体, 通过提高脯氨酸含量和促进活性氧清除方式增强谷子的耐盐性(Zhang et al., 2024c).研究发现, 拟南芥Sm核心蛋白SmEb通过调控RCD1可变剪接减少盐诱导的细胞死亡, 从而增强植株的耐盐性(Hong et al., 2023).胡杨(Populus euphratica) PeuHKT1;3通过可变剪接产生PeuHKT1;3a变体, 进一步通过改变离子选择性提高对K+的亲和力, 增强植株在盐胁迫下的适应能力(Lv et al., 2024).GmNTL9和GmRSZ22剪接变体通过激活抗氧化清除系统提高大豆对碳酸氢盐胁迫的耐受性; GmRSZ22两种剪接变体均可与GmU1-70K相互作用, 可能调控盐胁迫响应基因的可变剪接过程(Liu et al., 2024).在盐胁迫下, GsSnRK1.1通过调节转录因子活性和稳定调控下游靶基因表达, 并调控离子平衡和渗透调节等生理过程, 进而提高植株的耐盐性(Liu et al., 2023).最新研究发现, 盐胁迫激活了拟南芥SnRK1激酶, 使其磷酸化SRRM1L, 随后SRRM1L与U1-70K相互作用进入剪接体, 调控NFYA10前体mRNA可变剪接, 产生功能性NFYA10.1变体, 而NFYA10.1过表达可增强拟南芥对盐胁迫的抗性(Sun et al., 2024).上述研究表明, 基因可变剪接调控植物响应盐胁迫主要通过以下2条途径进行: 一是mRNA剪接体或剪接组分通过调节盐胁迫响应相关基因的表达增强植物的耐盐性; 二是剪接体通过直接参与分子网络调控途径增强耐盐性. ... Cold signaling and cold response in plants 1 2013 ... 冷胁迫作为一种重要的非生物胁迫因子, 严重影响植物的生长发育(Miura and Furumoto, 2013).在低温胁迫下, 植物体内大量差异表达基因(differentially expressed genes, DEGs)存在差异性剪接(Butt et al., 2022).低温诱导的植物可变剪接变化迅速.例如, 在拟南芥中, 部分基因在冷胁迫40-60分钟内即发生显著的可变剪接变化, 导致拟南芥对温度的敏感性小幅降低, 这有助于拟南芥感知温度变化, 从而响应冷胁迫(Calixto et al., 2018).基因可变剪接在冷响应中起主要作用, 影响拟南芥多个冷响应转录因子和RNA结合蛋白质.部分DAS (differentially alternatively spliced)基因早期的响应机制研究表明, 可变剪接启动下游级联效应, 对初始冷响应和持续耐寒性起重要作用(Gallegos, 2018).在低温下, 茶树(Camellia sinensis)中CsWRKY21通过可变剪接产生不同剪接变体, 其中CsWRKY21-b在低温下表达上调且蛋白质含量增加, 它通过抑制ABA分解相关基因的表达调节ABA含量, 从而增强茶树的耐寒性(Mi et al., 2024). ... The Arabidopsis SUMO E3 ligase SIZ1 controls phosphate deficiency responses 1 2005 ... SIZ1是最早在拟南芥中发现的一种SUMO E3连接酶, 参与调控剪接因子的SUMO化修饰, 进而调控植物响应热胁迫(Miura et al., 2005; Yunus and Lima, 2009).随后的研究表明, SIZ1在拟南芥不同组织中广泛表达, 在高温胁迫下其表达水平升高.同时, 热胁迫下SIZ1通过SUMO化修饰调节转录因子的活性, 促进一些编码热休克蛋白的基因(如HSP70和HSP90)表达, 从而调节植物响应高温胁迫(Ishida et al., 2012).在热胁迫下, 真菌SUMO化修饰某些剪接因子, 促进这些剪接因子在特定剪接位点富集, 从而改变前体mRNA的剪接模式, 这种改变可能有助于产生特定的mRNA异构体, 进而响应热胁迫(Jian et al., 2023).研究发现, 拟南芥SIZ1剪接变体SSV2和SSV5在热应激下大量积累, 二者通过编码同种蛋白质, 在热应激条件下作为质膜中的SUMO E3连接酶发挥作用; SSV2介导热应激下细胞质膜蛋白或膜连接蛋白的类泛素化修饰, 从而调节它们的稳定性或功能.此外, 在拟南芥siz1-2突变体中表达SSV2基因可提高植株的耐热应激能力.这些结果表明, SIZ1剪接产物SSV2在调节拟南芥响应高温胁迫方面具有重要作用(Kwak et al., 2024). ... Brassica rapa SR45a regulates drought tolerance via the alternative splicing of target genes 2 2020 ... 植物SR基因可变剪接在不同类型植物中响应干旱胁迫的调控机制具有保守性.拟南芥AtSR45a和AtSR30的表达和可变剪接受环境胁迫调控, 在应对环境胁迫方面发挥重要作用(Tanabe et al., 2007).在干旱胁迫下, 木薯部分SR基因的剪接模式发生变化, 表明SR蛋白可能在木薯响应干旱胁迫中发挥作用(Gu et al., 2020).在干旱胁迫下, 芜菁(Brassica rapa) BrSR45a基因过表达会改变干旱响应基因的剪接模式, 促进植物响应热胁迫.同时, BrSR45a表达改变还调控U2AF在干旱胁迫响应中的剪接模式(Muthusamy et al., 2020).毛白杨(Populus tomentosa) PtoRSZ21是一种丝氨酸/精氨酸富集的剪接因子, 参与调控基因的可变剪接过程, 通过与核心剪接因子PtoU1-70K结合, 确保剪接过程的准确性和高效性.干旱胁迫下, 毛白杨PtoRSZ21作为正向调节因子, 通过调控PtoATG2b的剪接影响植物水分利用效率和抗逆能力(Huang et al., 2024).在干旱胁迫下, 拟南芥中过表达木薯RSZ家族成员MeRSZ21b基因, 能促进拟南芥气孔关闭; 此外, MeRSZ21b还通过减少超氧化物自由基的积累和维持渗透压在响应干旱胁迫中发挥积极作用(Chen et al., 2022).上述研究表明, SR基因的表达和可变剪接可能是不同植物干旱胁迫响应的保守机制.然而, 不同植物中RSZ家族在干旱胁迫下的调节机制有待进一步阐明. ...
拟南芥SR45.1亚型通过调节SOS基因的表达, 在调控离子稳态和赋予耐盐性方面起重要作用(Albaqami et al., 2019).镉胁迫下, 拟南芥剪接因子SR34b通过调控下游靶基因IRT1的剪接和稳定性, 增强IRT1蛋白的组成型积累, IRT1蛋白通过参与镉吸收过程增强镉耐受性(Zhang et al., 2014).拟南芥SAD1基因过表达显著提高了转基因植株中盐胁迫响应相关基因的剪接效率, 进而提高转基因植株的耐盐性(Cui et al., 2014).SKIP是植物剪接体的关键组分之一, 通过直接与剪接体的另一个组分SR45相互作用, 维持剪接体功能, 并调节基因可变剪接(Wang et al., 2012); 在盐胁迫下, 拟南芥SKIP通过调控剪接体靶向基因中可变5′端供体位点和可变3′端受体位点的识别或切割诱导全基因组可变剪接, 提高植株对盐胁迫的耐受性(Feng et al., 2015).拟南芥AtU1A是剪接体的组成部分, 负责识别前体mRNA的5′剪接位点, 同时AtU1A通过调节活性氧清除相关基因的剪接, 维持活性氧的平衡, 从而提高植株的盐胁迫耐受性(Gu et al., 2018).SiCYP19的2个可变剪接变体(SiCYP19-a和SiCYP19-b)均可增强谷子(Setaria italica)的耐盐性, 其中SiCYP19-b定位于线粒体, 通过提高脯氨酸含量和促进活性氧清除方式增强谷子的耐盐性(Zhang et al., 2024c).研究发现, 拟南芥Sm核心蛋白SmEb通过调控RCD1可变剪接减少盐诱导的细胞死亡, 从而增强植株的耐盐性(Hong et al., 2023).胡杨(Populus euphratica) PeuHKT1;3通过可变剪接产生PeuHKT1;3a变体, 进一步通过改变离子选择性提高对K+的亲和力, 增强植株在盐胁迫下的适应能力(Lv et al., 2024).GmNTL9和GmRSZ22剪接变体通过激活抗氧化清除系统提高大豆对碳酸氢盐胁迫的耐受性; GmRSZ22两种剪接变体均可与GmU1-70K相互作用, 可能调控盐胁迫响应基因的可变剪接过程(Liu et al., 2024).在盐胁迫下, GsSnRK1.1通过调节转录因子活性和稳定调控下游靶基因表达, 并调控离子平衡和渗透调节等生理过程, 进而提高植株的耐盐性(Liu et al., 2023).最新研究发现, 盐胁迫激活了拟南芥SnRK1激酶, 使其磷酸化SRRM1L, 随后SRRM1L与U1-70K相互作用进入剪接体, 调控NFYA10前体mRNA可变剪接, 产生功能性NFYA10.1变体, 而NFYA10.1过表达可增强拟南芥对盐胁迫的抗性(Sun et al., 2024).上述研究表明, 基因可变剪接调控植物响应盐胁迫主要通过以下2条途径进行: 一是mRNA剪接体或剪接组分通过调节盐胁迫响应相关基因的表达增强植物的耐盐性; 二是剪接体通过直接参与分子网络调控途径增强耐盐性. ... A plant-specific clade of serine/arginine- rich proteins regulates RNA splicing homeostasis and thermotolerance in tomato 2 2024 ... 热胁迫是一种典型的非生物胁迫, 引起光合作用和呼吸作用变化, 导致植物生命周期缩短和生产能力降低(Barnabás et al., 2008).因此, 研究基因可变剪接如何调节植物响应热胁迫具有重要的生物学意义.植物在面对高温等环境胁迫时, 会通过一系列生理过程来应对高温胁迫, 如SR蛋白介导的前体mRNA调控(图2), 进而启动热休克反应(heat shock response, HSR), 包括激活热休克转录因子(heat shock factor, HSF)和产生热休克蛋白(heat shock protein, HSP).在热胁迫下, 植物中的HSF调控HSP表达, 使得植物合成足够的HSPs, 以应对热应激带来的挑战, 增强耐热性(Rosenkranz et al., 2024).在拟南芥中, HsfA2在热应激下会发生可变剪接, 产生包含提前终止密码子的剪接变体(如HsfA2-II) (Palusa and Reddy, 2015).研究发现, 在多种非生物胁迫(包括热胁迫)下HsfA2表达的诱导在A类HSF中最高, 这表明HsfA2是非生物胁迫下诱导防御系统的关键调节因子(Nishizawa et al., 2006).在热胁迫下, 拟南芥HsfA2正向调节一些被HsfA1初始诱导后的热诱导基因表达, 进而延长拟南芥获得耐热性的持续时间, 且HsfA2在维持热休克反应中具有主导作用, 而其它一些Hsfs (如HsfB1)在持续获得耐热性的调控中并非必需(Charng et al., 2007).拟南芥的2个热休克转录因子HsfB1和HsfB2b作为转录抑制因子负向调节热诱导的HSFs和HSPs (Ikeda et al., 2011).苜蓿(Medicago sativa)中HSF1基因可变剪接模式决定了其翻译产物能否结合到下游基因的热激元件(heat shock elements, HSEs)上, 进而影响热响应基因的激活(Ling et al., 2021).拟南芥HSFA2受到热胁迫时产生可变剪接调节.例如, 拟南芥幼苗暴露于不同强度热胁迫下会导致HSFA2前体mRNA上的外显子跳跃或内含子保留, 并产生不同比例的HSFA2 mRNA亚型: HSFA2-I、HSFA2-II和HSFA2-III.其中, HSFA2-III被认为参与HSFA2表达的自动调节, 从而响应热胁迫.热激蛋白是植物应对热应激的重要保护分子, 对于提高植物耐热性具有重要作用.在热应激下, 可变剪接调控热激蛋白基因表达, 促进热激蛋白合成, 进而增强植物的耐热性(Ling et al., 2017).在严重热激下, HsfA2产生新的剪接变体HsfA2-III, HsfA2-III编码S-HsfA2, 形成一个正向的自调控环, S-HsfA2可激活HsfA2基因的表达, 使内源完全剪接的HsfA2积累水平大幅提高(Liu et al., 2013).研究表明, 在热胁迫条件下, 大量被子植物HSF基因家族成员(如番茄(Solanum lycopersicum) SlHSFA2、玉米(Zea mays) ZmHSFA2B以及百合(Lilium spp.) LsHSFA3)的可变剪接事件显著提高了植株的抗逆性, 推测植物HSF基因家族成员可变剪接属于一种保守的热胁迫应答机制(Wu et al., 2019; Rosenkranz et al., 2024; Song et al., 2025). ...
拟南芥SR45.1亚型通过调节SOS基因的表达, 在调控离子稳态和赋予耐盐性方面起重要作用(Albaqami et al., 2019).镉胁迫下, 拟南芥剪接因子SR34b通过调控下游靶基因IRT1的剪接和稳定性, 增强IRT1蛋白的组成型积累, IRT1蛋白通过参与镉吸收过程增强镉耐受性(Zhang et al., 2014).拟南芥SAD1基因过表达显著提高了转基因植株中盐胁迫响应相关基因的剪接效率, 进而提高转基因植株的耐盐性(Cui et al., 2014).SKIP是植物剪接体的关键组分之一, 通过直接与剪接体的另一个组分SR45相互作用, 维持剪接体功能, 并调节基因可变剪接(Wang et al., 2012); 在盐胁迫下, 拟南芥SKIP通过调控剪接体靶向基因中可变5′端供体位点和可变3′端受体位点的识别或切割诱导全基因组可变剪接, 提高植株对盐胁迫的耐受性(Feng et al., 2015).拟南芥AtU1A是剪接体的组成部分, 负责识别前体mRNA的5′剪接位点, 同时AtU1A通过调节活性氧清除相关基因的剪接, 维持活性氧的平衡, 从而提高植株的盐胁迫耐受性(Gu et al., 2018).SiCYP19的2个可变剪接变体(SiCYP19-a和SiCYP19-b)均可增强谷子(Setaria italica)的耐盐性, 其中SiCYP19-b定位于线粒体, 通过提高脯氨酸含量和促进活性氧清除方式增强谷子的耐盐性(Zhang et al., 2024c).研究发现, 拟南芥Sm核心蛋白SmEb通过调控RCD1可变剪接减少盐诱导的细胞死亡, 从而增强植株的耐盐性(Hong et al., 2023).胡杨(Populus euphratica) PeuHKT1;3通过可变剪接产生PeuHKT1;3a变体, 进一步通过改变离子选择性提高对K+的亲和力, 增强植株在盐胁迫下的适应能力(Lv et al., 2024).GmNTL9和GmRSZ22剪接变体通过激活抗氧化清除系统提高大豆对碳酸氢盐胁迫的耐受性; GmRSZ22两种剪接变体均可与GmU1-70K相互作用, 可能调控盐胁迫响应基因的可变剪接过程(Liu et al., 2024).在盐胁迫下, GsSnRK1.1通过调节转录因子活性和稳定调控下游靶基因表达, 并调控离子平衡和渗透调节等生理过程, 进而提高植株的耐盐性(Liu et al., 2023).最新研究发现, 盐胁迫激活了拟南芥SnRK1激酶, 使其磷酸化SRRM1L, 随后SRRM1L与U1-70K相互作用进入剪接体, 调控NFYA10前体mRNA可变剪接, 产生功能性NFYA10.1变体, 而NFYA10.1过表达可增强拟南芥对盐胁迫的抗性(Sun et al., 2024).上述研究表明, 基因可变剪接调控植物响应盐胁迫主要通过以下2条途径进行: 一是mRNA剪接体或剪接组分通过调节盐胁迫响应相关基因的表达增强植物的耐盐性; 二是剪接体通过直接参与分子网络调控途径增强耐盐性. ... Differential expression of alternatively spliced mRNAs of Arabidopsis SR protein homologs, AtSR30 and AtSR45a, in response to environmental stress 1 2007 ... 植物SR基因可变剪接在不同类型植物中响应干旱胁迫的调控机制具有保守性.拟南芥AtSR45a和AtSR30的表达和可变剪接受环境胁迫调控, 在应对环境胁迫方面发挥重要作用(Tanabe et al., 2007).在干旱胁迫下, 木薯部分SR基因的剪接模式发生变化, 表明SR蛋白可能在木薯响应干旱胁迫中发挥作用(Gu et al., 2020).在干旱胁迫下, 芜菁(Brassica rapa) BrSR45a基因过表达会改变干旱响应基因的剪接模式, 促进植物响应热胁迫.同时, BrSR45a表达改变还调控U2AF在干旱胁迫响应中的剪接模式(Muthusamy et al., 2020).毛白杨(Populus tomentosa) PtoRSZ21是一种丝氨酸/精氨酸富集的剪接因子, 参与调控基因的可变剪接过程, 通过与核心剪接因子PtoU1-70K结合, 确保剪接过程的准确性和高效性.干旱胁迫下, 毛白杨PtoRSZ21作为正向调节因子, 通过调控PtoATG2b的剪接影响植物水分利用效率和抗逆能力(Huang et al., 2024).在干旱胁迫下, 拟南芥中过表达木薯RSZ家族成员MeRSZ21b基因, 能促进拟南芥气孔关闭; 此外, MeRSZ21b还通过减少超氧化物自由基的积累和维持渗透压在响应干旱胁迫中发挥积极作用(Chen et al., 2022).上述研究表明, SR基因的表达和可变剪接可能是不同植物干旱胁迫响应的保守机制.然而, 不同植物中RSZ家族在干旱胁迫下的调节机制有待进一步阐明. ... Alternative splicing of ZmCCA1 mediates drought response in tropical maize 1 2019 ... 研究发现, 水稻OsDREB2的2种剪接变体(OsDREB2A和OsDREB2B)在高温和干旱胁迫下差异表达, 以快速响应环境胁迫(Matsukura et al., 2010).拟南芥可变3′受体位点的可变剪接产生了锌诱导促进因子1 (Zinc-Induced Facilitator-Like 1, ZIFL1)转运蛋白的2种剪接形式, 其中全长型位于根细胞的核质体中并调节生长素转运, 而截短型ZIFL1变体定位于叶片气孔保卫细胞的质膜, 调节气孔开闭, 进而介导植株耐旱性(Remy et al., 2013).干旱胁迫下, 玉米ZmCCA1剪接变体35S:ZmCCA1.1和35S:ZmCCA1.3转基因植株的相对主根长度和相对发芽率均高于野生型, 且ZmCCA1.1在提高转基因拟南芥植株耐旱性方面更有效(Tian et al., 2019).玉米ZmPP2C26基因通过可变剪接产生ZmPP2C26L和ZmPP2C26S两种异构体, 这2个异构体通过去磷酸化ZmMAPK3和ZmMAPK7负向调节干旱耐受性(Lu et al., 2022).综上, 在干旱胁迫下, 玉米不同基因可变剪接的功能研究表明, 同一物种在干旱胁迫下可通过不同基因可变剪接响应干旱胁迫, 但这些基因之间是否存在相互作用, 以及如何互作仍有待阐明. ... 2 2024a ... U1 snRNA是一种长度为60-300 bp的小RNA, 存在于真核生物的细胞核中, U1 snRNA在剪接过程中发挥重要作用, 参与识别5′剪接位点(Liu et al., 2020).在干旱胁迫下, AtU1 snRNA过表达通过调控拟南芥干旱相关基因的表达响应干旱胁迫; 同时, 参与干旱胁迫响应和ABA信号通路的差异表达基因以及差异剪接基因显著增加.在干旱胁迫下, AtU1 snRNA过表达拟南芥植株表现出更强的耐受性, 包括主根变长和鲜重增加, 且过表达AtU1 snRNA植株中的前体mRNA剪接事件发生显著变化, 其中内含子保留最普遍.在干旱胁迫下, 可变5′剪接位点内G位点的识别受到影响, 导致异常剪接事件发生频率增高.同时, U1 snRNA能够加强对可变5′剪接位点中T位点的识别, 从而减少异常剪接事件的发生.干旱胁迫下, AtU1 snRNA影响AtSPCH的剪接模式, 导致气孔密度降低, 这有利于拟南芥减少水分蒸发进而响应干旱胁迫(Wang et al., 2024a).上述研究表明, U1 snRNA在植物中通过多条途径响应干旱胁迫, 如调控干旱胁迫相关基因的表达、减少异常剪接事件发生以及改变前体mRNA剪接模式, 然而是否存在其它方面的调控机制尚待挖掘. ...
拟南芥SR45.1亚型通过调节SOS基因的表达, 在调控离子稳态和赋予耐盐性方面起重要作用(Albaqami et al., 2019).镉胁迫下, 拟南芥剪接因子SR34b通过调控下游靶基因IRT1的剪接和稳定性, 增强IRT1蛋白的组成型积累, IRT1蛋白通过参与镉吸收过程增强镉耐受性(Zhang et al., 2014).拟南芥SAD1基因过表达显著提高了转基因植株中盐胁迫响应相关基因的剪接效率, 进而提高转基因植株的耐盐性(Cui et al., 2014).SKIP是植物剪接体的关键组分之一, 通过直接与剪接体的另一个组分SR45相互作用, 维持剪接体功能, 并调节基因可变剪接(Wang et al., 2012); 在盐胁迫下, 拟南芥SKIP通过调控剪接体靶向基因中可变5′端供体位点和可变3′端受体位点的识别或切割诱导全基因组可变剪接, 提高植株对盐胁迫的耐受性(Feng et al., 2015).拟南芥AtU1A是剪接体的组成部分, 负责识别前体mRNA的5′剪接位点, 同时AtU1A通过调节活性氧清除相关基因的剪接, 维持活性氧的平衡, 从而提高植株的盐胁迫耐受性(Gu et al., 2018).SiCYP19的2个可变剪接变体(SiCYP19-a和SiCYP19-b)均可增强谷子(Setaria italica)的耐盐性, 其中SiCYP19-b定位于线粒体, 通过提高脯氨酸含量和促进活性氧清除方式增强谷子的耐盐性(Zhang et al., 2024c).研究发现, 拟南芥Sm核心蛋白SmEb通过调控RCD1可变剪接减少盐诱导的细胞死亡, 从而增强植株的耐盐性(Hong et al., 2023).胡杨(Populus euphratica) PeuHKT1;3通过可变剪接产生PeuHKT1;3a变体, 进一步通过改变离子选择性提高对K+的亲和力, 增强植株在盐胁迫下的适应能力(Lv et al., 2024).GmNTL9和GmRSZ22剪接变体通过激活抗氧化清除系统提高大豆对碳酸氢盐胁迫的耐受性; GmRSZ22两种剪接变体均可与GmU1-70K相互作用, 可能调控盐胁迫响应基因的可变剪接过程(Liu et al., 2024).在盐胁迫下, GsSnRK1.1通过调节转录因子活性和稳定调控下游靶基因表达, 并调控离子平衡和渗透调节等生理过程, 进而提高植株的耐盐性(Liu et al., 2023).最新研究发现, 盐胁迫激活了拟南芥SnRK1激酶, 使其磷酸化SRRM1L, 随后SRRM1L与U1-70K相互作用进入剪接体, 调控NFYA10前体mRNA可变剪接, 产生功能性NFYA10.1变体, 而NFYA10.1过表达可增强拟南芥对盐胁迫的抗性(Sun et al., 2024).上述研究表明, 基因可变剪接调控植物响应盐胁迫主要通过以下2条途径进行: 一是mRNA剪接体或剪接组分通过调节盐胁迫响应相关基因的表达增强植物的耐盐性; 二是剪接体通过直接参与分子网络调控途径增强耐盐性. ... Full-length transcriptome sequencing provides insights into alternative splicing under cold stress in peanut 1 2024b ... 剪接因子在调控植物响应冷胁迫方面同样起重要作用.STA1是一个前体mRNA剪接因子, 拟南芥中STA1表达受冷胁迫诱导, 通过调节前体mRNA剪接响应冷胁迫(Lee et al., 2006).在冷胁迫下, 水稻中OsRH42与U2 snRNA直接相互作用, 对前体mRNA剪接至关重要, 可确保有足够数量的成熟mRNA响应冷胁迫(Lu et al., 2020).在水稻rs33突变体中, RS33的缺失导致大量胁迫响应基因的前体mRNA剪接异常, 表明冷胁迫下RS33通过维持胁迫相关基因前体mRNA正常剪接, 促进植株响应冷胁迫(Butt et al., 2022).水稻OsRS33和OsRS2Z38是冷诱导剪接的关键调节基因, 而Os03g0701200和OsCATC是水稻冷胁迫响应的重要候选基因, 用于提高水稻的冷胁迫耐受性(Zhong et al., 2024).研究表明, 花生(Arachis hypogaea)中存在28个冷诱导AhDREBs和8个具有DAS的SR剪接因子, 可能在冷响应中起重要作用(Wang et al., 2024b).在构树(Broussonetia papyrifera)中鉴定出41个富含丝氨酸/精氨酸(SR)的剪接因子基因, 其中5个SR基因在冷处理12和24小时后均表现出差异表达, 这表明SR基因通过可变剪接调控植物响应冷胁迫(Yu et al., 2023).LUC7作为U1 snRNP的组成部分, 对可变剪接具有重要调节作用, 包括影响5′剪接位点识别、外显子定义和3′剪接位点识别等, LUC7还直接参与冷胁迫下的内含子剪接调节.此外, 冷胁迫下, 随着末端内含子保留的增加, LUC7可能通过调节这些内含子的剪接响应冷胁迫(de Francisco Amorim et al., 2018).在冷胁迫下, 水稻OsRH42蛋白的表达量增加, 其通过与U2 snRNA结合在mRNA前体剪接中发挥重要作用.在过表达OsRH42植株中, 过量的OsRH42在U2 snRNA结合到分支点位点后仍继续结合, 影响了U2 snRNP、U4 snRNP和U5 snRNP招募到剪接体中, 从而破坏了前体mRNA剪接途径, 导致水稻对冷胁迫不耐受(Lu et al., 2020).上述研究表明, SR剪接因子以及LUC7等剪接过程中的核心调节因子在植物冷胁迫响应过程中起关键作用, 未来仍需对冷胁迫下剪接过程中的相关调节因子进行深入研究, 以阐明基因可变剪接在植物冷胁迫响应中的调控网络. ... 1 2012 ... 拟南芥SR45.1亚型通过调节SOS基因的表达, 在调控离子稳态和赋予耐盐性方面起重要作用(Albaqami et al., 2019).镉胁迫下, 拟南芥剪接因子SR34b通过调控下游靶基因IRT1的剪接和稳定性, 增强IRT1蛋白的组成型积累, IRT1蛋白通过参与镉吸收过程增强镉耐受性(Zhang et al., 2014).拟南芥SAD1基因过表达显著提高了转基因植株中盐胁迫响应相关基因的剪接效率, 进而提高转基因植株的耐盐性(Cui et al., 2014).SKIP是植物剪接体的关键组分之一, 通过直接与剪接体的另一个组分SR45相互作用, 维持剪接体功能, 并调节基因可变剪接(Wang et al., 2012); 在盐胁迫下, 拟南芥SKIP通过调控剪接体靶向基因中可变5′端供体位点和可变3′端受体位点的识别或切割诱导全基因组可变剪接, 提高植株对盐胁迫的耐受性(Feng et al., 2015).拟南芥AtU1A是剪接体的组成部分, 负责识别前体mRNA的5′剪接位点, 同时AtU1A通过调节活性氧清除相关基因的剪接, 维持活性氧的平衡, 从而提高植株的盐胁迫耐受性(Gu et al., 2018).SiCYP19的2个可变剪接变体(SiCYP19-a和SiCYP19-b)均可增强谷子(Setaria italica)的耐盐性, 其中SiCYP19-b定位于线粒体, 通过提高脯氨酸含量和促进活性氧清除方式增强谷子的耐盐性(Zhang et al., 2024c).研究发现, 拟南芥Sm核心蛋白SmEb通过调控RCD1可变剪接减少盐诱导的细胞死亡, 从而增强植株的耐盐性(Hong et al., 2023).胡杨(Populus euphratica) PeuHKT1;3通过可变剪接产生PeuHKT1;3a变体, 进一步通过改变离子选择性提高对K+的亲和力, 增强植株在盐胁迫下的适应能力(Lv et al., 2024).GmNTL9和GmRSZ22剪接变体通过激活抗氧化清除系统提高大豆对碳酸氢盐胁迫的耐受性; GmRSZ22两种剪接变体均可与GmU1-70K相互作用, 可能调控盐胁迫响应基因的可变剪接过程(Liu et al., 2024).在盐胁迫下, GsSnRK1.1通过调节转录因子活性和稳定调控下游靶基因表达, 并调控离子平衡和渗透调节等生理过程, 进而提高植株的耐盐性(Liu et al., 2023).最新研究发现, 盐胁迫激活了拟南芥SnRK1激酶, 使其磷酸化SRRM1L, 随后SRRM1L与U1-70K相互作用进入剪接体, 调控NFYA10前体mRNA可变剪接, 产生功能性NFYA10.1变体, 而NFYA10.1过表达可增强拟南芥对盐胁迫的抗性(Sun et al., 2024).上述研究表明, 基因可变剪接调控植物响应盐胁迫主要通过以下2条途径进行: 一是mRNA剪接体或剪接组分通过调节盐胁迫响应相关基因的表达增强植物的耐盐性; 二是剪接体通过直接参与分子网络调控途径增强耐盐性. ... 1 2022 ... 在冷胁迫下, 基因可变剪接受到调控元件的影响, 通过改变冷胁迫响应通路中相关基因的表达促进植物响应冷胁迫.例如, TAS1a是一种长链非编码RNA (long non-coding RNA, lncRNA), 其可变剪接仅受冷胁迫调控, TAS1a是对寒冷反应最快和最大的137个DAS基因之一, TAS1a基因的剪接形式在冷胁迫下发生变化, 剪接体减少, 导致成熟siRNA (small interfering RNA)的水平降低(Calixto et al., 2019).RCF1是一种RNA解旋酶, 其通过维持冷响应相关基因前体mRNA剪接调节这些基因的表达, 进而影响植物的耐寒性, 特别是RCF1还与其它调节因子共同作用, 构成复杂的基因表达网络, 以调节植物对冷胁迫的响应(Guan et al., 2013).SME1是拟南芥中与真核生物Sm环SmE亚基同源的蛋白质, SME1促进U1、U2、U4和U5 snRNA可变剪接积累, 对剪接体的组装和活性具有重要作用.在冷胁迫下, SME1调控冷响应相关基因.同时, 大多数受SME1调控的内含子保留事件导致产生具有NMD特征的mRNA, 表明SME1确保了冷响应基因中关键功能基因的转录本水平(Huertas et al., 2019).CBFs通过SmEb依赖性前体mRNA可变剪接负向调节寒冷应激反应, 而SmEb通过BES1提供正反馈, 进而调节寒冷胁迫下CBF基因表达(Wang et al., 2022).烟草(Nicotiana tabacum) ClNUM1基因产生的3个剪接变体增强了植株对胁迫的抗性并促进植物生长, 其中ClNUM1.1和ClNUM1.2增强了烟草的耐盐和耐低温能力, ClNUM1.3增强了耐低温能力(Zhang et al., 2024b).这表明同一基因不同剪接变体在促进植物抗逆方面有相似之处, 但不同剪接变体的功能存在差异. ... Alternative splicing of TaHSFA6e modulates heat shock protein-mediated translational regulation in response to heat stress in wheat 2 2023 ... 在拟南芥中, IRE1可以表达为2种异构体IRE1a和IRE1b.在热胁迫下, IRE1剪接变体IRE1b通过调节转录因子bZIP60前体mRNA剪接参与上调结合蛋白3 (BIP3)的表达, 进而减轻应激损伤.而IRE1a在感知到热胁迫后表达量立即下降, 之后逐渐恢复, 这表明热胁迫诱导的IRE1a下调会导致IRE1a信号通路终止, 以避免过度反应.IRE1b介导的可变剪接调控以热胁迫特定的方式进行, 在盐、缺氧和营养胁迫等其它胁迫下不会被激活.在水稻中, OsIRE1也调节热胁迫响应基因OsbZIP74的前体mRNA剪接.综上表明, IRE1介导的bZIP转录因子编码基因可变剪接调控植物响应热胁迫是一种相对保守的机制(Ling et al., 2021).在小麦中, 热休克转录因子TaHSFA6e在热应激下可变剪接产生2个主要的功能转录本: TaHSFA6e-II和TaHSFA6e-III, 二者编码的蛋白增强了3个下游热休克蛋白70 (TaHSP70)基因的转录活性.此外, 小麦通过可变剪接产生TaHSFA2-III, 导致C端含14个氨基酸残基的肽增多, 可增强TaHSFA6e-III的转录活性(Wen et al., 2023). ...
拟南芥SR45.1亚型通过调节SOS基因的表达, 在调控离子稳态和赋予耐盐性方面起重要作用(Albaqami et al., 2019).镉胁迫下, 拟南芥剪接因子SR34b通过调控下游靶基因IRT1的剪接和稳定性, 增强IRT1蛋白的组成型积累, IRT1蛋白通过参与镉吸收过程增强镉耐受性(Zhang et al., 2014).拟南芥SAD1基因过表达显著提高了转基因植株中盐胁迫响应相关基因的剪接效率, 进而提高转基因植株的耐盐性(Cui et al., 2014).SKIP是植物剪接体的关键组分之一, 通过直接与剪接体的另一个组分SR45相互作用, 维持剪接体功能, 并调节基因可变剪接(Wang et al., 2012); 在盐胁迫下, 拟南芥SKIP通过调控剪接体靶向基因中可变5′端供体位点和可变3′端受体位点的识别或切割诱导全基因组可变剪接, 提高植株对盐胁迫的耐受性(Feng et al., 2015).拟南芥AtU1A是剪接体的组成部分, 负责识别前体mRNA的5′剪接位点, 同时AtU1A通过调节活性氧清除相关基因的剪接, 维持活性氧的平衡, 从而提高植株的盐胁迫耐受性(Gu et al., 2018).SiCYP19的2个可变剪接变体(SiCYP19-a和SiCYP19-b)均可增强谷子(Setaria italica)的耐盐性, 其中SiCYP19-b定位于线粒体, 通过提高脯氨酸含量和促进活性氧清除方式增强谷子的耐盐性(Zhang et al., 2024c).研究发现, 拟南芥Sm核心蛋白SmEb通过调控RCD1可变剪接减少盐诱导的细胞死亡, 从而增强植株的耐盐性(Hong et al., 2023).胡杨(Populus euphratica) PeuHKT1;3通过可变剪接产生PeuHKT1;3a变体, 进一步通过改变离子选择性提高对K+的亲和力, 增强植株在盐胁迫下的适应能力(Lv et al., 2024).GmNTL9和GmRSZ22剪接变体通过激活抗氧化清除系统提高大豆对碳酸氢盐胁迫的耐受性; GmRSZ22两种剪接变体均可与GmU1-70K相互作用, 可能调控盐胁迫响应基因的可变剪接过程(Liu et al., 2024).在盐胁迫下, GsSnRK1.1通过调节转录因子活性和稳定调控下游靶基因表达, 并调控离子平衡和渗透调节等生理过程, 进而提高植株的耐盐性(Liu et al., 2023).最新研究发现, 盐胁迫激活了拟南芥SnRK1激酶, 使其磷酸化SRRM1L, 随后SRRM1L与U1-70K相互作用进入剪接体, 调控NFYA10前体mRNA可变剪接, 产生功能性NFYA10.1变体, 而NFYA10.1过表达可增强拟南芥对盐胁迫的抗性(Sun et al., 2024).上述研究表明, 基因可变剪接调控植物响应盐胁迫主要通过以下2条途径进行: 一是mRNA剪接体或剪接组分通过调节盐胁迫响应相关基因的表达增强植物的耐盐性; 二是剪接体通过直接参与分子网络调控途径增强耐盐性. ... Spliceosome structure and function 1 2011 ... 基因可变剪接是一种重要的转录后调控机制, 在转录后水平上对基因进行不同方式剪接, 扩大基因表达多样性, 产生具有不同功能的蛋白质异构体, 增加蛋白质组复杂性, 为生物体提供了更多功能选择(Graveley, 2001; Laloum et al., 2018).基因可变剪接的主要类型有内含子保留、外显子跳跃、可变5′端供体位点以及可变3′端受体位点(Laloum et al., 2018) (图1).例如, 拟南芥中最常见的可变剪接事件是内含子保留(Ner-Gaon et al., 2004).然而, 有些剪接异构体由于含有提前终止密码子(premature termination codon, PTC), 可通过无义介导的mRNA衰变(nonsense-mediated mRNA decay, NMD)途径降解, 从而调控转录本比率, 进而调节基因表达, 最终增强植物对非生物胁迫的响应(Lim et al., 2020).同时, 当mRNA转录本中存在上游开放阅读框(upstream open reading frame, uORF)时, 核糖体会优先结合并翻译uORF, 影响后续正常编码区翻译起始或导致核糖体提前解离, 最终导致mRNA剪接异构体翻译被抑制或者不翻译(Calvo et al., 2009).可变剪接由剪接体催化, 而剪接体由5种小核糖核蛋白(small nuclear ribonucleoprotein, snRNP)组成, 包括U1 snRNP、U2 snRNP、U4 snRNP、U5 snRNP和U6 snRNP (Will and Lührmann, 2011).U1 snRNP中的U1小核RNA (small nuclear RNA, snRNA)通过碱基互补配对与5′剪接位点GU序列附近区域结合, 从而实现对5′剪接位点的初步识别; U2辅助因子(U2 auxiliary factor, U2AF)通过与3′剪接位点AG序列相互作用进而识别3′端.U2 snRNP参与识别分支点序列, 通过与分支点序列及其附近区域进行碱基互补配对, 实现对分支点序列的结合(Laloum et al., 2018; Paul et al., 2024).U1 snRNP结合到5′剪接位点后, 招募其它蛋白质因子, 形成E复合物(E complex).随后, U2 snRNP结合到分支点序列, 并与已经结合在5′剪接位点的U1 snRNP以及其它相关蛋白质因子相互作用, 形成A复合物(A complex).随后, U4/U6 snRNP和U5 snRNP加入, 形成B复合物(B complex).最后, 经过一系列的结构重排, U4 snRNP解离, U6 snRNP与U2 snRNP之间相互作用进一步调整, 形成具有催化活性的C复合物(C complex).C复合物经过2次转酯反应, 完成可变剪接的1个基本单元.上述过程反复进行, 最终产生多种不同的mRNA剪接异构体(Punzo et al., 2020). ... Alternative splicing provides a mechanism to regulate LlHSFA3 function in response to heat stress in lily 1 2019 ... 热胁迫是一种典型的非生物胁迫, 引起光合作用和呼吸作用变化, 导致植物生命周期缩短和生产能力降低(Barnabás et al., 2008).因此, 研究基因可变剪接如何调节植物响应热胁迫具有重要的生物学意义.植物在面对高温等环境胁迫时, 会通过一系列生理过程来应对高温胁迫, 如SR蛋白介导的前体mRNA调控(图2), 进而启动热休克反应(heat shock response, HSR), 包括激活热休克转录因子(heat shock factor, HSF)和产生热休克蛋白(heat shock protein, HSP).在热胁迫下, 植物中的HSF调控HSP表达, 使得植物合成足够的HSPs, 以应对热应激带来的挑战, 增强耐热性(Rosenkranz et al., 2024).在拟南芥中, HsfA2在热应激下会发生可变剪接, 产生包含提前终止密码子的剪接变体(如HsfA2-II) (Palusa and Reddy, 2015).研究发现, 在多种非生物胁迫(包括热胁迫)下HsfA2表达的诱导在A类HSF中最高, 这表明HsfA2是非生物胁迫下诱导防御系统的关键调节因子(Nishizawa et al., 2006).在热胁迫下, 拟南芥HsfA2正向调节一些被HsfA1初始诱导后的热诱导基因表达, 进而延长拟南芥获得耐热性的持续时间, 且HsfA2在维持热休克反应中具有主导作用, 而其它一些Hsfs (如HsfB1)在持续获得耐热性的调控中并非必需(Charng et al., 2007).拟南芥的2个热休克转录因子HsfB1和HsfB2b作为转录抑制因子负向调节热诱导的HSFs和HSPs (Ikeda et al., 2011).苜蓿(Medicago sativa)中HSF1基因可变剪接模式决定了其翻译产物能否结合到下游基因的热激元件(heat shock elements, HSEs)上, 进而影响热响应基因的激活(Ling et al., 2021).拟南芥HSFA2受到热胁迫时产生可变剪接调节.例如, 拟南芥幼苗暴露于不同强度热胁迫下会导致HSFA2前体mRNA上的外显子跳跃或内含子保留, 并产生不同比例的HSFA2 mRNA亚型: HSFA2-I、HSFA2-II和HSFA2-III.其中, HSFA2-III被认为参与HSFA2表达的自动调节, 从而响应热胁迫.热激蛋白是植物应对热应激的重要保护分子, 对于提高植物耐热性具有重要作用.在热应激下, 可变剪接调控热激蛋白基因表达, 促进热激蛋白合成, 进而增强植物的耐热性(Ling et al., 2017).在严重热激下, HsfA2产生新的剪接变体HsfA2-III, HsfA2-III编码S-HsfA2, 形成一个正向的自调控环, S-HsfA2可激活HsfA2基因的表达, 使内源完全剪接的HsfA2积累水平大幅提高(Liu et al., 2013).研究表明, 在热胁迫条件下, 大量被子植物HSF基因家族成员(如番茄(Solanum lycopersicum) SlHSFA2、玉米(Zea mays) ZmHSFA2B以及百合(Lilium spp.) LsHSFA3)的可变剪接事件显著提高了植株的抗逆性, 推测植物HSF基因家族成员可变剪接属于一种保守的热胁迫应答机制(Wu et al., 2019; Rosenkranz et al., 2024; Song et al., 2025). ... Transcriptional regulatory networks in cellular responses and tole-rance to dehydration and cold stresses 1 2006 ... 植物生长发育过程经常遭受各种非生物胁迫(如高温、低温、干旱和盐胁迫), 近年来频繁出现的极端气候加剧了这些非生物胁迫对植物生长发育的不利影响.植物在长期演化过程中进化出一系列分子调控机制以响应各种非生物胁迫(Yamaguchi-Shinozaki and Shinozaki, 2006; Fedoroff et al., 2010).基因可变剪接是植物响应逆境胁迫的重要调控机制之一.其中, 组成型剪接(constitutive splicing, CS)是指前体mRNA的非编码内含子区被去除, 外显子通过酯化反应连接, 获得基因初级转录本的过程; 当前体mRNA发生差异性剪接时, 会产生可变剪接(alternative splicing, AS), 因此可变剪接是前体mRNA外显子以不同剪接方式产生不同结构和功能的mRNA和蛋白质变体的过程(Lorkovi? et al., 2000; Blencowe, 2006; Matera and Wang, 2014).前体mRNA可变剪接是一种用途广泛的调节机制, 它可以影响基因表达精准调控机制, 实现蛋白质功能多样化, 进而调节植物的生长发育过程; 特别是可变剪接从单个多外显子基因产生多种mRNA亚型, 增强了蛋白质组多样性, 并在植物响应各种胁迫中发挥重要作用(Staiger and Brown, 2013). ... Alternative splicing responses to salt stress in Glycyrrhiza uralensis revealed by global profiling of transcriptome RNA-seq datasets 1 2024 ... 土壤盐碱化是一种重要的非生物胁迫, 由于盐碱化土壤中积累了大量的可溶性盐, 极大地限制了植物生长和生产力, 威胁全世界的作物产量和粮食安全(Zhou et al., 2024).因此, 研究植物在盐胁迫下可变剪接的调控机制尤为重要.在盐胁迫下, 番茄根部基因可变剪接事件数量显著高于对照组, 其中外显子跳跃在盐处理样本中最为常见, 表明盐胁迫促进番茄根部的可变剪接变化(Gan et al., 2024).研究发现, 盐胁迫下拟南芥中存在15个与可变剪接相关的剪接因子, 其中10个编码富含丝氨酸/精氨酸(SR)的蛋白质, 并且部分SR基因内含子保留减少, 导致异常转录本减少和功能转录本增加, 从而增强了植株对盐胁迫的耐受性(Ding et al., 2014).在盐胁迫下的甘草(Glycyrrhiza uralensis)中, MPK4、RbohD、SnRK2和ETR2等基因通过可变剪接增加不同基因异构体的比例, 进而调节下游基因响应盐胁迫, 增强甘草对盐胁迫的耐受性(Yao et al., 2024).最新研究发现, 水稻中存在一种新的剪接因子OsSCR106, 其可能与U2AF35相互作用, 参与调控胁迫相关基因3′剪接位点的选择, 从而调节水稻的耐盐性(Alhabsi et al., 2024).上述研究表明, 在盐胁迫下, 不同植物主要通过基因可变剪接的方式提高对盐胁迫的耐受性(表1). ... Alternative splicing under cold stress in paper mulberry 1 2023 ... 剪接因子在调控植物响应冷胁迫方面同样起重要作用.STA1是一个前体mRNA剪接因子, 拟南芥中STA1表达受冷胁迫诱导, 通过调节前体mRNA剪接响应冷胁迫(Lee et al., 2006).在冷胁迫下, 水稻中OsRH42与U2 snRNA直接相互作用, 对前体mRNA剪接至关重要, 可确保有足够数量的成熟mRNA响应冷胁迫(Lu et al., 2020).在水稻rs33突变体中, RS33的缺失导致大量胁迫响应基因的前体mRNA剪接异常, 表明冷胁迫下RS33通过维持胁迫相关基因前体mRNA正常剪接, 促进植株响应冷胁迫(Butt et al., 2022).水稻OsRS33和OsRS2Z38是冷诱导剪接的关键调节基因, 而Os03g0701200和OsCATC是水稻冷胁迫响应的重要候选基因, 用于提高水稻的冷胁迫耐受性(Zhong et al., 2024).研究表明, 花生(Arachis hypogaea)中存在28个冷诱导AhDREBs和8个具有DAS的SR剪接因子, 可能在冷响应中起重要作用(Wang et al., 2024b).在构树(Broussonetia papyrifera)中鉴定出41个富含丝氨酸/精氨酸(SR)的剪接因子基因, 其中5个SR基因在冷处理12和24小时后均表现出差异表达, 这表明SR基因通过可变剪接调控植物响应冷胁迫(Yu et al., 2023).LUC7作为U1 snRNP的组成部分, 对可变剪接具有重要调节作用, 包括影响5′剪接位点识别、外显子定义和3′剪接位点识别等, LUC7还直接参与冷胁迫下的内含子剪接调节.此外, 冷胁迫下, 随着末端内含子保留的增加, LUC7可能通过调节这些内含子的剪接响应冷胁迫(de Francisco Amorim et al., 2018).在冷胁迫下, 水稻OsRH42蛋白的表达量增加, 其通过与U2 snRNA结合在mRNA前体剪接中发挥重要作用.在过表达OsRH42植株中, 过量的OsRH42在U2 snRNA结合到分支点位点后仍继续结合, 影响了U2 snRNP、U4 snRNP和U5 snRNP招募到剪接体中, 从而破坏了前体mRNA剪接途径, 导致水稻对冷胁迫不耐受(Lu et al., 2020).上述研究表明, SR剪接因子以及LUC7等剪接过程中的核心调节因子在植物冷胁迫响应过程中起关键作用, 未来仍需对冷胁迫下剪接过程中的相关调节因子进行深入研究, 以阐明基因可变剪接在植物冷胁迫响应中的调控网络. ... Structure of the Siz/PIAS SUMO E3 ligase Siz1 and determinants required for SUMO modification of PCNA 1 2009 ... SIZ1是最早在拟南芥中发现的一种SUMO E3连接酶, 参与调控剪接因子的SUMO化修饰, 进而调控植物响应热胁迫(Miura et al., 2005; Yunus and Lima, 2009).随后的研究表明, SIZ1在拟南芥不同组织中广泛表达, 在高温胁迫下其表达水平升高.同时, 热胁迫下SIZ1通过SUMO化修饰调节转录因子的活性, 促进一些编码热休克蛋白的基因(如HSP70和HSP90)表达, 从而调节植物响应高温胁迫(Ishida et al., 2012).在热胁迫下, 真菌SUMO化修饰某些剪接因子, 促进这些剪接因子在特定剪接位点富集, 从而改变前体mRNA的剪接模式, 这种改变可能有助于产生特定的mRNA异构体, 进而响应热胁迫(Jian et al., 2023).研究发现, 拟南芥SIZ1剪接变体SSV2和SSV5在热应激下大量积累, 二者通过编码同种蛋白质, 在热应激条件下作为质膜中的SUMO E3连接酶发挥作用; SSV2介导热应激下细胞质膜蛋白或膜连接蛋白的类泛素化修饰, 从而调节它们的稳定性或功能.此外, 在拟南芥siz1-2突变体中表达SSV2基因可提高植株的耐热应激能力.这些结果表明, SIZ1剪接产物SSV2在调节拟南芥响应高温胁迫方面具有重要作用(Kwak et al., 2024). ... Distinct functions of SR proteins in recruitment of U1 small nuclear ribonucleoprotein to alternative 5' splice sites 1 1995 ... SR蛋白包含1个或2个N端RNA识别基序型(RNA Recognition Motif, RRM) RNA结合结构域和1个长度可变的C端精氨酸/丝氨酸富集结构域(arginine/serine- rich domain, RS) (Manley and Tacke, 1996).SR蛋白参与剪接体的组装过程, 通过结合到特定的剪接增强子或沉默子序列附近, 引导剪接体识别内含子和外显子边界, 进而影响剪接方式(Lopato et al., 1996).SR蛋白为内含子剪接所必需, 可以促进U1 snRNP与5′剪接位点的结合(Zahler and Roth, 1995).当SR蛋白结合在外显子上时, 通常促进外显子和剪接因子的结合, 起到剪接激活的作用; 而当其结合在内含子上时, 可能会抑制剪接.然而, 对于hnRNP (heterogeneous nuclear ribonucleoprotein)蛋白, 也有类似的位置依赖性剪接调控模式, 只是根据具体情况剪接模式有所不同(Erkelenz et al., 2013).富含丝氨酸/精氨酸的剪接因子1 (serine/argininerich splicing factor 1, SRSF1)通过使用与RNA结合位点相反的表面将U1-70K (U1 snRNP 70K)的RRM桥接到前体mRNA, 参与介导早期的剪接体组装事件(Cho et al., 2011). ... Population-level exploration of alternative splicing and its unique role in controlling agronomic traits of rice 1 2024a ... (2) 作物基因的可变剪接变异是分子育种的有利资源.例如, 水稻中OsPIE1基因剪接异构体比例可以决定株高等性状(Zhang et al., 2024a), 未来可运用分子标记辅助选择育种, 快速筛选出具有优良基因可变剪接变异的育种材料, 加速培育具有理想农艺性状的作物新品种. ... Splicing factor SR34b mutation reduces cadmium tolerance in Arabidopsis by regulating iron-regulated transporter 1 gene 2 2014 ... Alternative splicing-related genes involved in regulating plant responses to abiotic stress in different species
拟南芥SR45.1亚型通过调节SOS基因的表达, 在调控离子稳态和赋予耐盐性方面起重要作用(Albaqami et al., 2019).镉胁迫下, 拟南芥剪接因子SR34b通过调控下游靶基因IRT1的剪接和稳定性, 增强IRT1蛋白的组成型积累, IRT1蛋白通过参与镉吸收过程增强镉耐受性(Zhang et al., 2014).拟南芥SAD1基因过表达显著提高了转基因植株中盐胁迫响应相关基因的剪接效率, 进而提高转基因植株的耐盐性(Cui et al., 2014).SKIP是植物剪接体的关键组分之一, 通过直接与剪接体的另一个组分SR45相互作用, 维持剪接体功能, 并调节基因可变剪接(Wang et al., 2012); 在盐胁迫下, 拟南芥SKIP通过调控剪接体靶向基因中可变5′端供体位点和可变3′端受体位点的识别或切割诱导全基因组可变剪接, 提高植株对盐胁迫的耐受性(Feng et al., 2015).拟南芥AtU1A是剪接体的组成部分, 负责识别前体mRNA的5′剪接位点, 同时AtU1A通过调节活性氧清除相关基因的剪接, 维持活性氧的平衡, 从而提高植株的盐胁迫耐受性(Gu et al., 2018).SiCYP19的2个可变剪接变体(SiCYP19-a和SiCYP19-b)均可增强谷子(Setaria italica)的耐盐性, 其中SiCYP19-b定位于线粒体, 通过提高脯氨酸含量和促进活性氧清除方式增强谷子的耐盐性(Zhang et al., 2024c).研究发现, 拟南芥Sm核心蛋白SmEb通过调控RCD1可变剪接减少盐诱导的细胞死亡, 从而增强植株的耐盐性(Hong et al., 2023).胡杨(Populus euphratica) PeuHKT1;3通过可变剪接产生PeuHKT1;3a变体, 进一步通过改变离子选择性提高对K+的亲和力, 增强植株在盐胁迫下的适应能力(Lv et al., 2024).GmNTL9和GmRSZ22剪接变体通过激活抗氧化清除系统提高大豆对碳酸氢盐胁迫的耐受性; GmRSZ22两种剪接变体均可与GmU1-70K相互作用, 可能调控盐胁迫响应基因的可变剪接过程(Liu et al., 2024).在盐胁迫下, GsSnRK1.1通过调节转录因子活性和稳定调控下游靶基因表达, 并调控离子平衡和渗透调节等生理过程, 进而提高植株的耐盐性(Liu et al., 2023).最新研究发现, 盐胁迫激活了拟南芥SnRK1激酶, 使其磷酸化SRRM1L, 随后SRRM1L与U1-70K相互作用进入剪接体, 调控NFYA10前体mRNA可变剪接, 产生功能性NFYA10.1变体, 而NFYA10.1过表达可增强拟南芥对盐胁迫的抗性(Sun et al., 2024).上述研究表明, 基因可变剪接调控植物响应盐胁迫主要通过以下2条途径进行: 一是mRNA剪接体或剪接组分通过调节盐胁迫响应相关基因的表达增强植物的耐盐性; 二是剪接体通过直接参与分子网络调控途径增强耐盐性. ...
拟南芥SR45.1亚型通过调节SOS基因的表达, 在调控离子稳态和赋予耐盐性方面起重要作用(Albaqami et al., 2019).镉胁迫下, 拟南芥剪接因子SR34b通过调控下游靶基因IRT1的剪接和稳定性, 增强IRT1蛋白的组成型积累, IRT1蛋白通过参与镉吸收过程增强镉耐受性(Zhang et al., 2014).拟南芥SAD1基因过表达显著提高了转基因植株中盐胁迫响应相关基因的剪接效率, 进而提高转基因植株的耐盐性(Cui et al., 2014).SKIP是植物剪接体的关键组分之一, 通过直接与剪接体的另一个组分SR45相互作用, 维持剪接体功能, 并调节基因可变剪接(Wang et al., 2012); 在盐胁迫下, 拟南芥SKIP通过调控剪接体靶向基因中可变5′端供体位点和可变3′端受体位点的识别或切割诱导全基因组可变剪接, 提高植株对盐胁迫的耐受性(Feng et al., 2015).拟南芥AtU1A是剪接体的组成部分, 负责识别前体mRNA的5′剪接位点, 同时AtU1A通过调节活性氧清除相关基因的剪接, 维持活性氧的平衡, 从而提高植株的盐胁迫耐受性(Gu et al., 2018).SiCYP19的2个可变剪接变体(SiCYP19-a和SiCYP19-b)均可增强谷子(Setaria italica)的耐盐性, 其中SiCYP19-b定位于线粒体, 通过提高脯氨酸含量和促进活性氧清除方式增强谷子的耐盐性(Zhang et al., 2024c).研究发现, 拟南芥Sm核心蛋白SmEb通过调控RCD1可变剪接减少盐诱导的细胞死亡, 从而增强植株的耐盐性(Hong et al., 2023).胡杨(Populus euphratica) PeuHKT1;3通过可变剪接产生PeuHKT1;3a变体, 进一步通过改变离子选择性提高对K+的亲和力, 增强植株在盐胁迫下的适应能力(Lv et al., 2024).GmNTL9和GmRSZ22剪接变体通过激活抗氧化清除系统提高大豆对碳酸氢盐胁迫的耐受性; GmRSZ22两种剪接变体均可与GmU1-70K相互作用, 可能调控盐胁迫响应基因的可变剪接过程(Liu et al., 2024).在盐胁迫下, GsSnRK1.1通过调节转录因子活性和稳定调控下游靶基因表达, 并调控离子平衡和渗透调节等生理过程, 进而提高植株的耐盐性(Liu et al., 2023).最新研究发现, 盐胁迫激活了拟南芥SnRK1激酶, 使其磷酸化SRRM1L, 随后SRRM1L与U1-70K相互作用进入剪接体, 调控NFYA10前体mRNA可变剪接, 产生功能性NFYA10.1变体, 而NFYA10.1过表达可增强拟南芥对盐胁迫的抗性(Sun et al., 2024).上述研究表明, 基因可变剪接调控植物响应盐胁迫主要通过以下2条途径进行: 一是mRNA剪接体或剪接组分通过调节盐胁迫响应相关基因的表达增强植物的耐盐性; 二是剪接体通过直接参与分子网络调控途径增强耐盐性. ...
本文的其它图/表
-
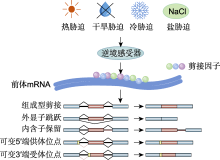 图1
非生物胁迫下可变剪接的主要类型(参考Laloum et al., 2018)
图1
非生物胁迫下可变剪接的主要类型(参考Laloum et al., 2018)
-
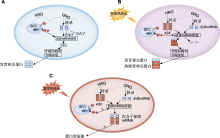 图2
正常条件和不同程度热胁迫下, 富含丝氨酸/精氨酸(SR)蛋白质介导的前体mRNA调控机制(参考Ling et al., 2021)
图2
正常条件和不同程度热胁迫下, 富含丝氨酸/精氨酸(SR)蛋白质介导的前体mRNA调控机制(参考Ling et al., 2021)
(A) 植物正常发育情况下进行的组成型剪接模式图(在正常条件下, 热响应基因(heat-responsive genes, HRG)未被激活或几乎不表达, 生长相关基因(genes responding for growth, GRG)正常表达。SR蛋白发生磷酸化(例如, 由剪接因子复合物(splicing factor complex, SFC)中的SR蛋白激酶(SR protein kinase, SRPK)进行磷酸化), 从而参与组成型剪接, 产生大量发育相关蛋白); (B) 植物在轻度热胁迫下可变剪接模式图(在轻度热胁迫(例如, 32°C持续6小时)下, 包括热诱导SR基因在内的HRGs在转录水平被激活, 磷酸化的SR蛋白参与HRGs的组成型剪接或可变剪接, 同时GRGs在转录水平上被抑制。部分来自GRGs的转录本片段也由磷酸化SR蛋白剪接, 产生不同功能的剪接变体。植物细胞通过该机制产生大量的热耐受蛋白进而响应热胁迫); (C) 植物在重度热胁迫下的可变剪接模式图(在重度热胁迫(例如, 45°C持续90分钟)下, 包括热诱导SR基因在内的HRGs在转录水平被激活。然而, 在重度热胁迫下SR蛋白去磷酸化(例如, 由SRPK缺乏引起), 导致功能性剪接因子短缺, 从而使HRGs和GRGs内含子保留的转录本在细胞核中积累, 最终导致功能性转录本数量显著减少。因此, 植物细胞中的热耐受蛋白和发育相关蛋白短缺)。ASF: 可变剪接片段; ×: 该过程被抑制。
|
