
|
|
||
|
植物SWEET基因参与逆境胁迫响应及其调控机制
植物学报
2025, 60 (4):
640-655.
DOI: 10.11983/CBB24158
SWEETs是一类新发现的双向糖转运蛋白, 其家族成员在各种生物体中广泛存在。在植物中, 不同进化分支的SWEETs成员对转运已糖(葡萄糖、果糖和半乳糖)和蔗糖具有特异性, 通过特定的糖信号转导对生长发育和生理过程产生影响。该文重点综述了SWEETs转运蛋白响应生物和非生物胁迫的功能, 系统总结了SWEETs在转录水平、蛋白翻译后水平以及多种信号转导途径中响应环境胁迫的调控机制, 旨在为揭示SWEET转运蛋白的复杂生物学功能及其作用机制提供新的视角, 为未来植物抗逆研究和高产抗病作物分子育种提供有价值的参考。 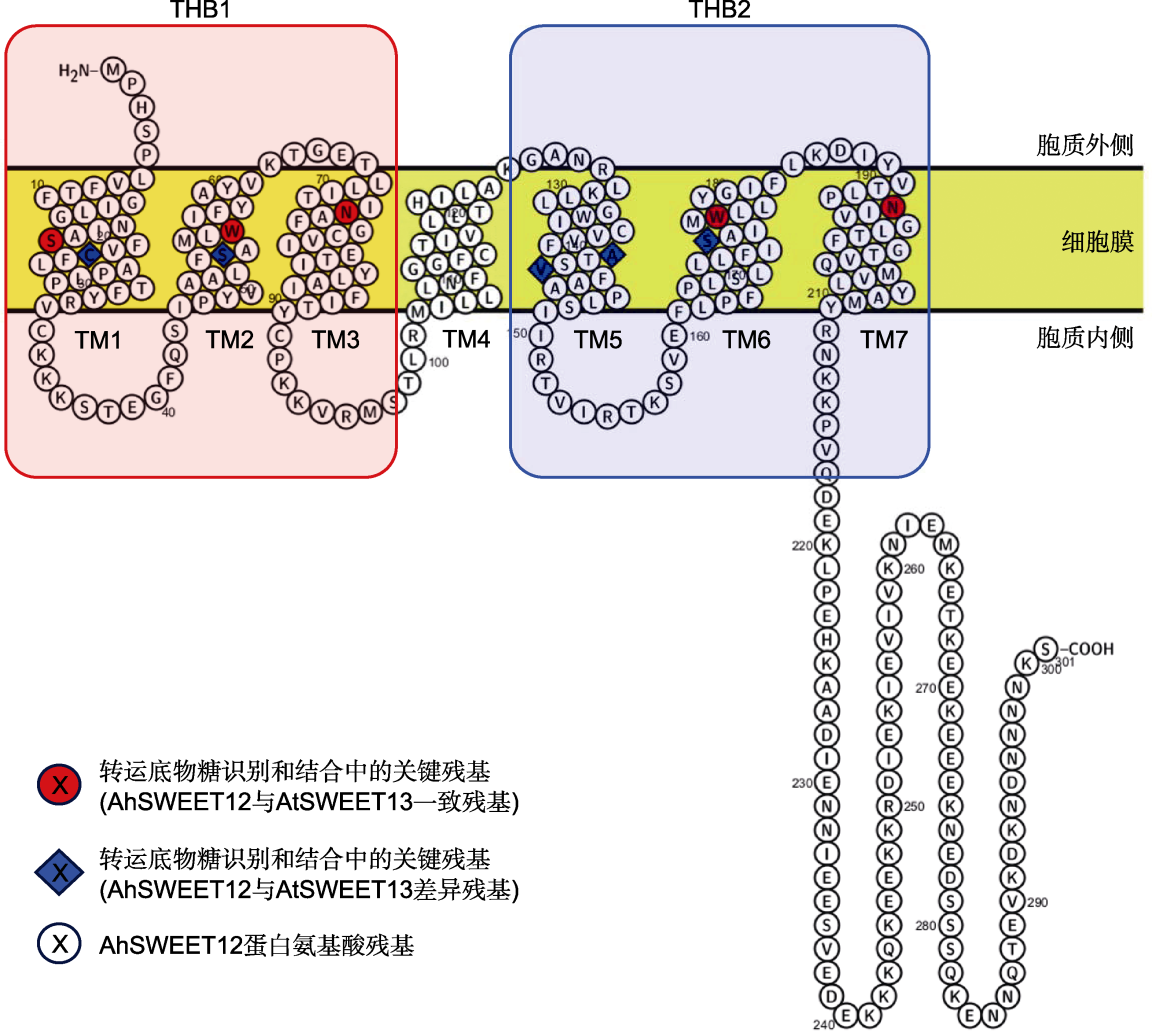 View image in article
图1
植物SWEET蛋白的跨膜结构(以花生AhSWEET12为例)
THB1, 2: 三螺旋束串联结构; TM1-7: 跨膜α-螺旋结构域。带颜色的氨基酸残基为糖识别和结合关键位点。
正文中引用本图/表的段落
植物SWEET蛋白含有7个跨膜α-螺旋结构域(α-helical transmembrane domain, TM), 位于蛋白N端(细胞质外侧)和C端(细胞质内侧)的2个3次跨膜螺旋(TM1-3和TM5-7)分别构成相对保守的MtN3/saliva结构域, 称为三螺旋束(triple-helix bundle, THB)。2个THBs (THB1和THB2)之间由保守性较低的第4个TM链接在一起, 构成“3-1-3”形式的对称跨膜结构(图1) (Bermejo et al., 2011)。
花生(Arachis hypogaea) AhSWEET12与AtSWEET13蛋白的跨膜结构非常相似, 在底物识别和结合的保守位点分布上也极为一致。不同物种的SWEET蛋白结构高度保守。已发现AtSWEET13有10个氨基酸残基在糖底物识别与结合中发挥关键作用, 包括位于TM1的Ser20 (Ser20TM1)、Leu23TM1、Asn54TM2、Trp58TM2、Asn76TM3、Ser142TM5、Met145TM5、Asn176TM6、Trp180TM6和Asn196TM7 (Han et al., 2017)。这些位点中有5个在AhSWEET12与AtSWEET13之间存在差异(图1), 推测这是2个SWEET蛋白对糖底物选择具有差异的原因(王鸿梅, 2024)。AhSWEET12蛋白三级结构模拟结果显示, AtSWEET13 (5xpd.1)是最优的同源建模模板(Han et al., 2017), AhSWEET12也具有典型的7次跨膜结构域(图2)。
本文的其它图/表
|